陈学思院士团队最新《自然·通讯》:手性多肽水凝胶,可调节局部免疫微环境和抗肿瘤免疫反应
时间:2025-02-04 12:08:44 热度:37.1℃ 作者:网络
手性对免疫反应的影响近年来引起了癌症疫苗研究的极大兴趣。然而,手性合成多肽水凝胶作为癌症疫苗以及生物材料本身对抗肿瘤免疫治疗的影响的研究还很少见诸报道。
在此,中科院长春应化所陈学思团队贺超良研究员和Yan Rong等人展示了多肽水凝胶残基手性在抗肿瘤免疫和局部免疫微环境调节中的关键作用。研究发现,与聚(γ-乙基-L-谷氨酸)基水凝胶(L-Gel)相比,聚(γ-乙基-D-谷氨酸)基凝胶(D-Gel)可诱导免疫细胞浸润水平的提高。然而,D-Gel在抗原呈递细胞上引起更高水平的抑制性标志物,甚至比L-Gel诱导更强的T细胞耗竭。最后,D-Gel建立了局部慢性炎症和免疫抑制微环境,显示出不足的抗肿瘤作用。相反,L-Gel诱导的宿主免疫反应能够导致更有效的肿瘤抑制。本研究深入探讨了残基手性在调节局部免疫微环境和影响抗肿瘤免疫反应中的作用。相关工作以“Chiral polypeptide hydrogels regulating local immune microenvironment and anti-tumor immune response”为题发表在Nature Communications。

【文章要点】
在此,作者设计并合成了具有不同手性残基的甲氧基-(乙二醇)-多肽(mPEG-多肽)水凝胶,并通过负载抗原和佐剂将其用作癌症疫苗(图1)。研究发现,基于手性残基(包括L/D-谷氨酸、L/D-缬氨酸和L/D-丙氨酸)的多肽水凝胶在化学结构、孔径、凝胶化行为、力学性能和药物释放行为方面表现出相当的性能,但手性和伴随的降解行为除外。两种水凝胶疫苗中的抗原和佐剂在体内持续释放超过2周,模拟了多剂量注射的效果。在小鼠的皮下层,D-Gel在水凝胶和周围皮肤中比L-Gel招募了更多的免疫细胞,尤其是巨噬细胞和树突状细胞。因此,D-Gel在淋巴结中诱导的抗原反流(antigen reflux)比例高于L-Gel。
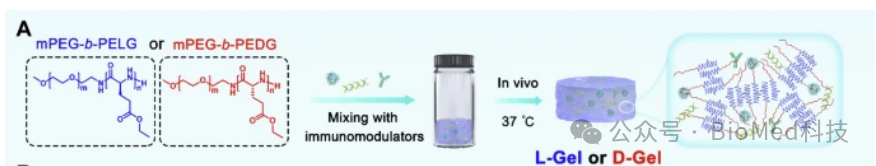
图1 水凝胶疫苗的制备
尽管D-Gel招募了更多的免疫细胞,但这些细胞倾向于表达更多的抑制性标志物(PD-L1和PD-1),特别是在APC的表面,包括DC和巨噬细胞。这些抑制性标记物的高水平抑制了APC和T细胞之间的相互作用,导致适应性免疫反应的启动减弱。此外,D-Gel甚至通过在T细胞表面表达更高水平的耗竭标志物,如PD-1、LAG-3和TIM-3,诱导T细胞耗竭。基于RNA-seq和q-PCR,作者证实D-Gel上调了与炎症和免疫原性相关的多种途径,包括移植物抗宿主病、吞噬体、溶酶体和补体凝血级联,改变了局部免疫微环境,最终建立了炎症但免疫抑制的微环境。当装载OVA和CpG时,与D-Gel疫苗相比,L-Gel疫苗在C57BL/6小鼠中引发了更高水平的T细胞活化和增殖,以及特异性抗OVA-lgG抗体的产生。此外,在使用C57BL/6小鼠的预防性模型中,与D-Gel疫苗相比,L-Gel疫苗对B16OVA黑色素瘤细胞产生了显著更强的抗肿瘤免疫力,抗原特异性DC、IFN-γ+CD8+T细胞、中枢记忆CD4+和CD8+T细胞的水平也有所提高。此外,在使用携带B16F10的C57BL/6小鼠的术后复发模型中,也证实了含有肿瘤抗原、CpG和aPD-L1的L-Gel疫苗具有增强肿瘤抑制效果(图2)。
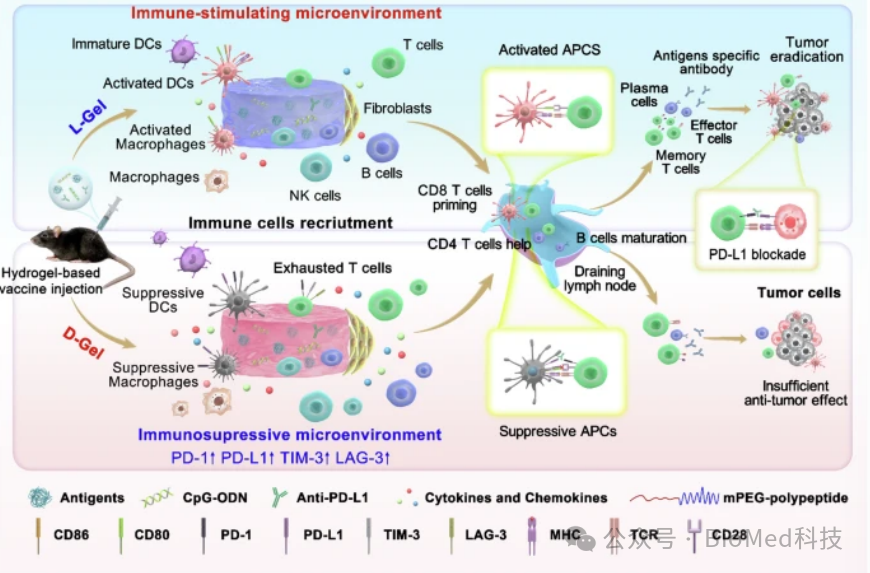
图2 宿主免疫反应以及用于免疫疗法的抗肿瘤反应
原文链接:
https://www.nature.com/articles/s41467-025-56137-w


