奥加伊妥珠单抗治疗成人R/R ALL的IV期研究,探索不同剂量对SOS的影响
时间:2025-02-09 12:10:13 热度:37.1℃ 作者:网络
奥加伊妥珠单抗
急性淋巴细胞白血病(ALL)是一种罕见的、影响骨髓、血液和/或髓外部位的肿瘤。尽管标准治疗可以使约90%的新诊断成人患者达到疾病缓解,但许多患者会复发,成人R/R ALL的治愈率低于40%。奥加伊妥珠单抗是一种抗体药物偶联物,已在许多国家获批用于治疗R/R ALL。批准的起始剂量为1.8 mg/m²/周期,分3次给药;后续根据反应调整剂量。
既往研究显示,接受InO治疗的患者在HSCT后发生肝窦阻塞综合征(SOS)的比例高于接受化疗的患者。为了评估较低剂量的InO是否能降低HSCT后SOS的风险,同时不影响疗效,学者开展了一项上市后开放标签IV期研究。近日发表于《Haematologica》。

研究结果
该研究包含导入期和随机期,纳入18-75岁CD22阳性R/R B细胞ALL患者(骨髓原始细胞≥5%),且患者存在≥1个SOS危险因素。导入期纳入22例患者,接受1.2 mg/m²/周期的InO治疗。随机期纳入80例患者,根据年龄、挽救治疗状态和既往HSCT情况进行分层,随机分配接受1.8 mg/m²/周期(n=38)或1.2 mg/m²/周期(n=42)的InO治疗。主要终点包括SOS的发生率和血液学缓解(CR/CRi)率。
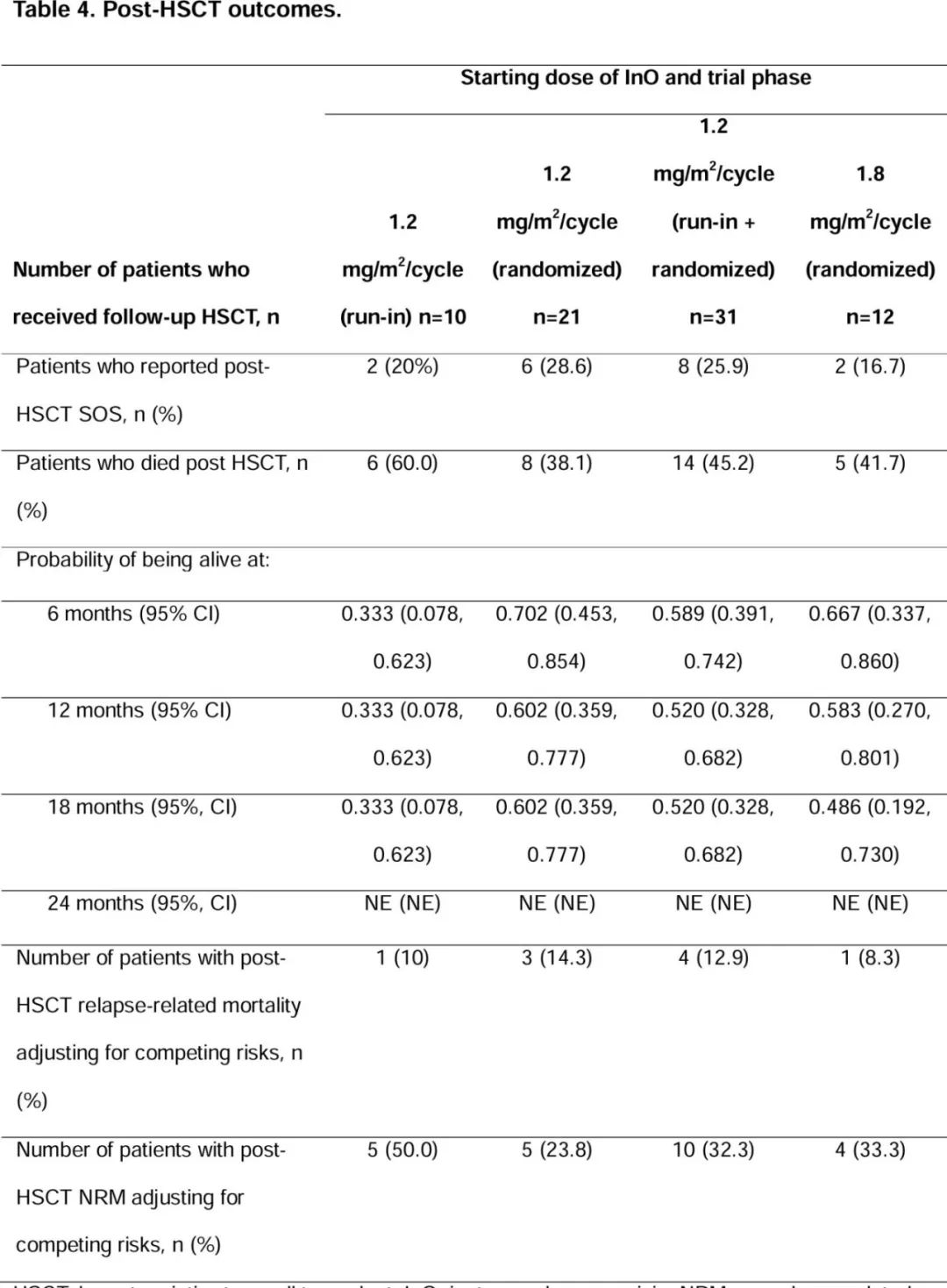
SOS发生率:共报告10例SOS(9.8%),均为HSCT后发生。在进行HSCT的患者中,1.2 mg/m²/周期(导入期)、1.2 mg/m²/周期(随机期)、1.2 mg/m²/周期(导入期+随机期)和1.8 mg/m²/周期(随机期)组的HSCT后SOS发生率分别为20%、28.6%、25.8%和16.7%。
血液学缓解:CR/CRi率,1.2 mg/m²/周期(导入期)为50.0%,1.2 mg/m²/周期(随机期)为83.3%,1.2 mg/m²/周期(导入期+随机期)为71.9%,1.8 mg/m²/周期(随机期)为68.4%。
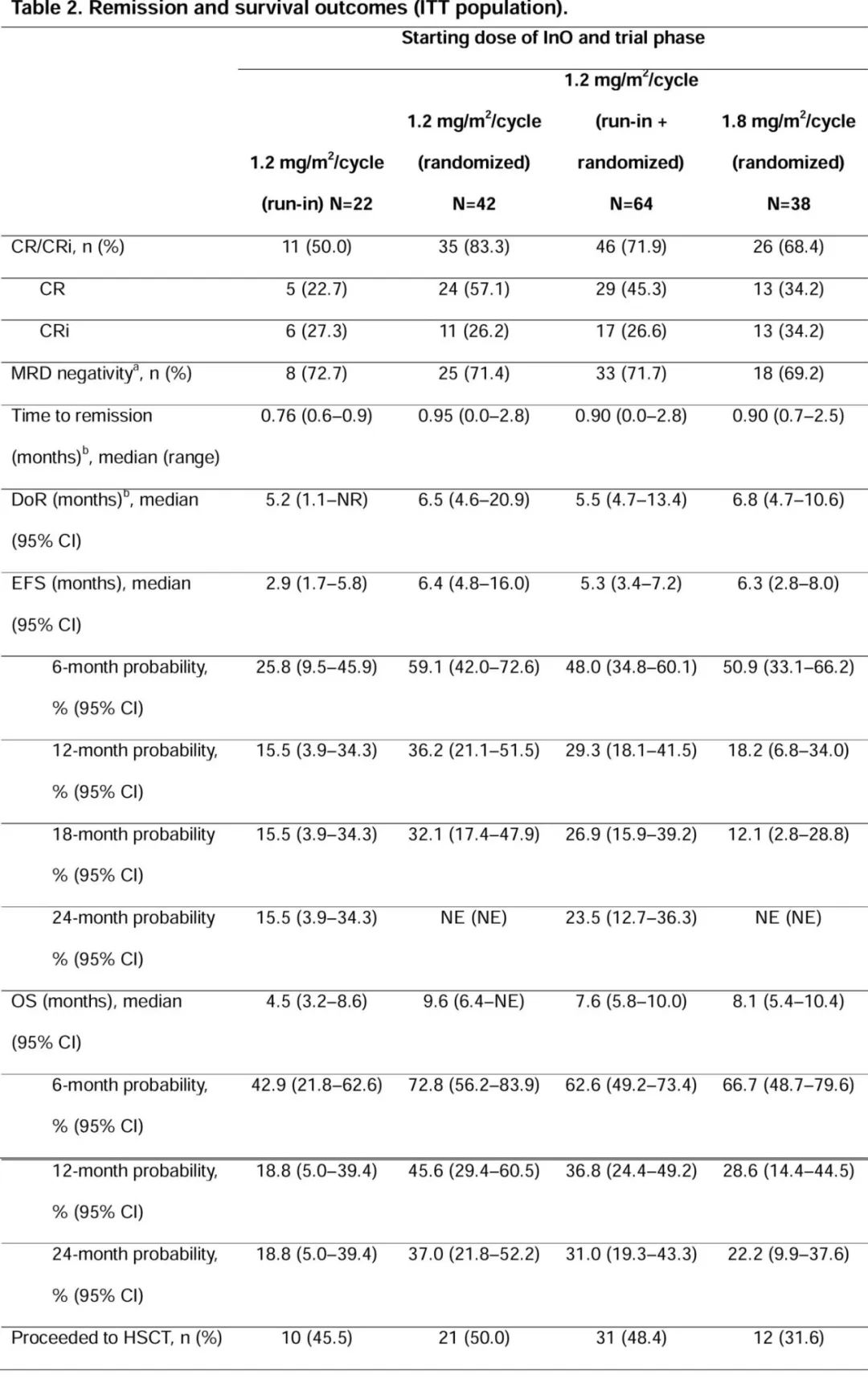
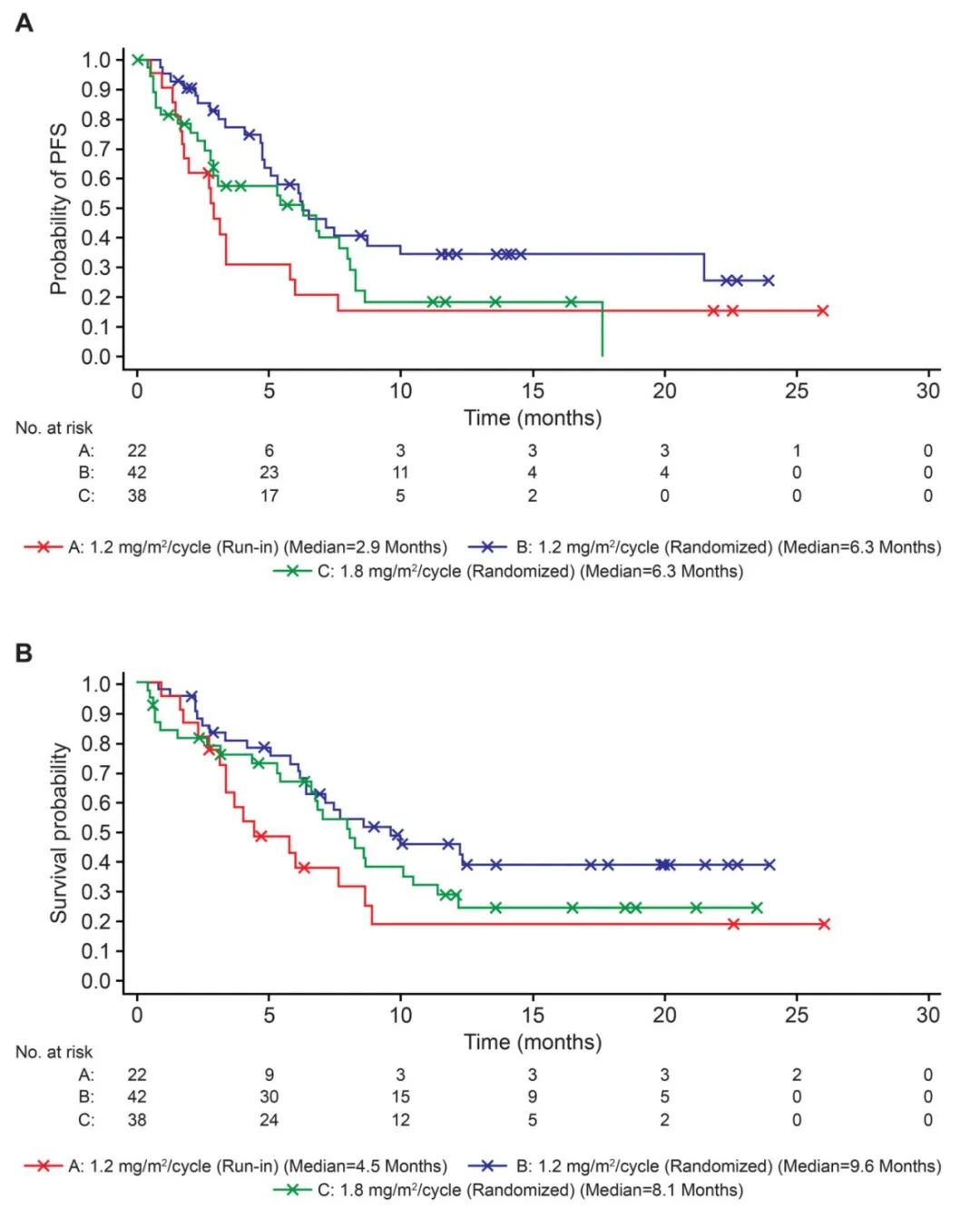
生存结局:中位无事件生存期(EFS),1.2 mg/m²/周期(导入期)为2.9个月,1.2 mg/m²/周期(随机期)为6.4个月,1.2 mg/m²/周期(导入期+随机期)为5.3个月,1.8 mg/m²/周期(随机期)为6.3个月。中位总生存期(OS),1.2 mg/m²/周期(导入期)为4.5个月,1.2 mg/m²/周期(随机期)为9.6个月,1.2 mg/m²/周期(导入期+随机期)为7.6个月,1.8 mg/m²/周期(随机期)为8.1个月。
HSCT相关结局:42.2%的患者在达到CR/CRi后接受了HSCT。HSCT后的18个月累积复发率,1.2 mg/m²/周期(导入期)为11.1%,1.2 mg/m²/周期(随机期)为20.5%,1.2 mg/m²/周期(导入期+随机期)为17.6%,1.8 mg/m²/周期(随机期)为26.7%。
安全性:93.1%的患者发生≥1次治疗相关不良事件(TEAE),62.7%发生≥1次治疗相关严重不良事件(TESAE)。最常见的TEAE为血液学异常,包括血小板减少症(31.4%)和中性粒细胞减少症(29.4%)。
总结
该研究表明,1.2 mg/m²/周期的InO在疗效和安全性方面与批准的1.8 mg/m²/周期剂量相当,特别是在HSCT前使用时。然而较低剂量并未降低HSCT后SOS的发生率。因此不推荐降低InO起始剂量,而应考虑其他措施来降低SOS的风险,例如限制InO暴露在1-2个周期内,或在移植前同时使用熊去氧胆酸。
该研究还发现,接受HSCT的患者比例高于既往报道的贝林妥欧单抗治疗患者。此外,INO-VATE研究发现InO治疗周期数与HSCT后SOS风险增加有关,提示治疗周期数可能对HSCT后SOS风险有贡献。
参考文献
Muhit Özcan, Ryan D. Cassaday, Ewa Zarzycka, Erik Vandendries, Fan Zhang, Ying Chen, Alejandra Nieto, Fatih Demirkan, Pau Montesinos and Fevzi Altuntas. Efficacy and safety of currently approved and lower starting doses of inotuzumab ozogamicin in adult patients with relapsed or refractory acute lymphoblastic leukemia: a phase IV study.Haematologica. 2025 Jan 30. doi: 10.3324/haematol.2024.286091


