“绘”解读 真报告丨甲状腺癌检出BRAF融合罕见变异,检测全面精准,方能提供更多!
时间:2025-01-30 12:08:54 热度:37.1℃ 作者:网络
实践证实,甲状腺癌患者通过多基因检测能带来多方位临床指导,作为指南的强烈推荐,是辅助患者管理的主流手段。B-Raf原癌基因,即BRAF基因,这个指南推荐检测的重中之重,高频的V600E突变及其邻近的T599、V600、K601都非常关键,而事实证明,相对罕见且往往被检测所忽视的BRAF融合变异也应受到关注!为此,我司多项甲状腺基因检测产品均覆盖了BRAF融合变异,追求好而全的检测服务(检测产品服务见文末)!
近期,一位年龄41岁病理确诊为“甲状腺乳头状癌”的女性患者,手术过后,送检新鲜组织标本至我司,检测“甲状腺癌80基因检测”项目,用于指导后续治疗和遗传性评估等。

图1 患者病理报告
患者送检新鲜手术标本,在检测前,进行了蜡块包埋及肿瘤细胞占比评估。再经过系统的质控和检测分析后,报告检出MACF1-BRAF融合,具体为MACF1基因第1-60号外显子区域与BRAF基因第9-18个外显子区域融合,形成含有BRAF蛋白激酶结构域(位于BRAF基因11-18号外显子)的融合基因,同时,未检出遗传性基因突变,提示遗传风险较低。
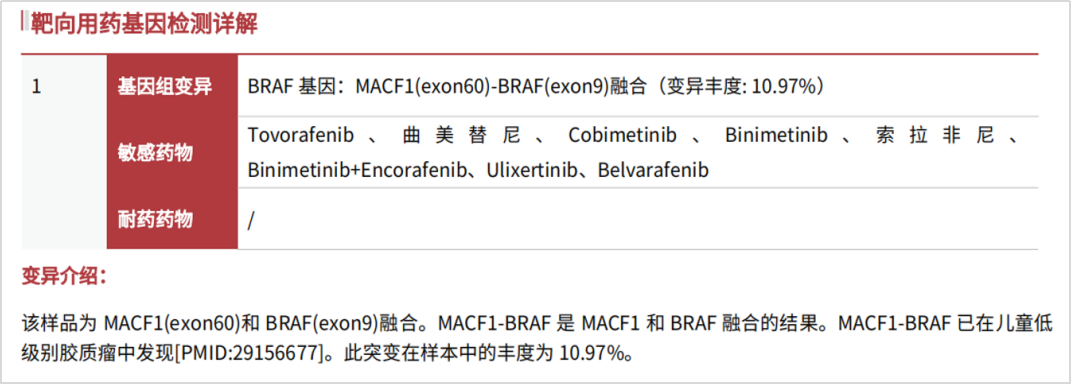
图2 报告检出MACF1-BRAF融合
一、TCGA数据,近1/7的PTC患者携带融合变异,融合基因检测理应关注
本次受检者是病理亚型最常见的甲状腺乳头状癌(PTC),恶性程度相对较低,预后较好。TCGA(The Cancer Genome Atlas)在484例PTC人群中的研究发现[1],除了像BRAF V600E这类基因错义突变类型之外,约15.3%(74/448)的患者携带基因融合类型变异,其中,2.7%(13/484)的患者为BRAF融合,其他以RET融合最为常见,比例为6.8%(33/484),还有ALK、NTRK1、NTRK3等基因融合,比例均为1%左右。大多数融合变异都相关靶向药物建议,还能带来PTC的预后信息,也是指南推荐,如若通过基因检测有效检出,则势必为患者带来更多和更长久的获益机会!所以,在选择基因检测时,理应受到关注。

图3 摘自甲状腺NCCN临床实践指南
二、罕中寻因,甲状腺癌BRAF融合少见,检出富有挑战
有学者提到,在甲状腺癌中,与RET或NTRK3融合相比,BRAF融合是第三常见的驱动基因融合变异,并且具有多个很罕见的融合伙伴。这凸显了在PTC中检出BRAF融合具有挑战[2]。确实,经过我们细致地调研文献,发现甲状腺癌中多为BRAF V600E等点突变,融合变异很少,但报道出的融合伴侣基因却非常多,而且相识度不高;本次患者检出的MACF1-BRAF融合基因变异,早在2018年,就报道在文献中,但没有给出较为具体的介绍,类似的,融合包括9-18号外显子的变异有PICALM-BRAF, NFYA–BRAF, SND1–BRAF,LMO7-BRAF变异[3]。

图4 文献报道的甲状腺融合亚型
三、治疗探索,BRAF融合变异推荐,多方检索提供参考依据
BRAF融合以年轻患者或者儿童案例居多,与预后呈现一定关系。例如,AGK-BRAF融合是儿童PTC中的一种常见事件,可促进侵袭性表型,并且与较高水平的端粒相关基因组不稳定性相关[4]。目前,针对BRAF融合变异的治疗方法还没纳入指南推荐,BRAF V600E突变已经实现面向实体肿瘤的药物获批。NCCN黑色素瘤指南提示,BRAF融合对MEK抑制剂(曲美替尼等)和非特异性RAF抑制剂(如索拉非尼)敏感。由于BRAF基因变异会导致BRAF的组成性激活以及下游MAPK通路的激活,达拉非尼是BRAF抑制剂,曲美替尼是MEK1/2抑制剂,联合使用通过双重阻断抑制肿瘤,是甲状腺癌指南主推的用药方案[5]。而基于机制层面,BRAF融合可参考BRAF V600E突变,成为探索性治疗的良好策略。

图5 共识推荐甲状腺部分
此外,临床试验方面,我们发现,已经被FDA批准用于复发或难治性BRAF阳性儿童低级别胶质瘤新药—Tovorafenib(DAY101),正在开展1b/2期、多中心临床试验[6],研究A组将招募患有复发性或进展性黑色素瘤或其他具有BRAF融合或CRAF/RAF1融合或扩增的实体瘤的患者,具体也可关注Clinical Trial NCT04985604。期待尽早出具令人满意的结论。

图6 Tovorafenib(DAY101)临床研究介绍
四、案例总结及产品服务
本案例中,患者选择甲状腺癌80基因检测,为患者检出罕见的BRAF融合变异,不仅从预后、治疗和遗传角度均带来了一定指导,还说明甲状腺癌选择项目时,应关注一些罕见的变异类型或者基因,检测产品的选择尤为重要。而我司拥有的多个甲状腺项目,都同时包括BRAF融合变异,能够为患者带来较为全面地分子指导!
参考文献:
[1]Cancer Genome Atlas Research Network. Integrated genomic characterization of papillary thyroid carcinoma. Cell. 2014 Oct 23;159(3):676-90.
[2]Jun Li et al. ,A functional genomic approach to actionable gene fusions for precision oncology.Sci. Adv.8,eabm2382(2022).DOI:10.1126/sciadv.abm2382
[3]He H, Li W, Yan P, Bundschuh R, Killian JA, Labanowska J, Brock P, Shen R, Heerema NA, de la Chapelle A. Identification of a Recurrent LMO7-BRAF Fusion in Papillary Thyroid Carcinoma. Thyroid. 2018 Jun;28(6):748-754.
[4]Renaud E, Riegel K, Romero R, Suryamohan K, Distler U, Tenzer S, Schad A, Musholt TJ, Rajalingam K. Multiomic analysis of papillary thyroid cancers identifies BAIAP2L1-BRAF fusion and requirement of TRIM25, PDE5A and PKCδ for tumorigenesis. Mol Cancer. 2022 Oct 10;21(1):195. doi: 10.1186/s12943-022-01665-y. PMID: 36217175; PMCID: PMC9549631.
[5]中华医学会肿瘤学分会,中国临床肿瘤学会罕见肿瘤委员会.BRAF抑制剂治疗恶性实体肿瘤专家共识(2024版)[J].中华肿瘤杂志, 2024, 46(10):919-929.
[6]https://www.cancer.gov/research/participate/clinical-trials-search/v?id=NCI-2021-12476



