携带EGFR ex20ins和PIK3CA共突变的晚期肺腺癌获益伏美替尼四线治疗
时间:2025-01-30 12:08:49 热度:37.1℃ 作者:网络
肺癌,包括小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC),是全球最常见的癌症,并且仍是癌症相关死亡的主要原因。表皮生长因子受体(EGFR)突变经常出现在女性NSCLC患者中,随着酪氨酸激酶抑制剂(TKI)的出现,彻底改变了这种突变的治疗策略。这些疗法显著提高了生存率,被认为是携带EGFR突变患者的标准治疗方法。然而,大多数患者最终会对EGFR-TKI产生耐药性,导致病情进展。耐药机制分为EGFR依赖性或EGFR非依赖性,后者涉及旁路通路激活,包括下游信号级联失调。EGFR非依赖性耐药通常会导致所有EGFR-TKI无效,因此需要进一步研究耐药机制。本文报告了一例 63 岁中国女性病例,该患者同时患有EGFR ex20ins肺腺癌和肾透明细胞癌(ccRCC)。多学科团队建议对肺腺癌进行系统治疗,并对ccRCC进行临床观察。一线治疗采用贝伐珠单抗联合培美曲塞-卡铂,无进展生存期(PFS)为 7 个月。二线治疗采用信迪利单抗和奈达铂,PFS为 4.9 个月。三线治疗采用信迪利单抗和安罗替尼,结果无效。在四线治疗中,患者接受了基于FAVOUR试验的第三代EGFR-TKI伏美替尼治疗。该治疗实现了持久的疾病控制和出色的耐受性,PFS为 27 个月,并有持续的临床获益。本病例表明,伏美替尼可为携带复杂耐药机制(包括涉及PIK3CA/mTOR通路的耐药机制)的NSCLC患者提供显著的临床获益。这些发现支持了伏美替尼克服EGFR-TKI耐药的潜力,值得在类似的临床环境中进一步研究。
背 景
表皮生长因子受体(EGFR)在调节细胞增殖、分化、分裂和存活等过程中起着关键作用,与癌症的发展密切相关。EGFR被认为是肿瘤学的关键治疗靶点,在非小细胞肺癌(NSCLC)中经常发生突变。EGFR-酪氨酸激酶抑制剂(TKI)在肿瘤缓解方面表现出显著疗效,尤其是在EGFR突变的NSCLC患者中,其疗效优于传统的细胞毒性化疗方案。
尽管EGFR-TKI有效,但新证据表明,患有EGFR 20号外显子插入(exon20ins)的晚期NSCLC患者对这些抑制剂表现出明显的耐药。在亚洲各地进行的研究(涵盖中国大陆、台湾和印度人群)均表明,在使用第一代EGFR TKI作为一线或后续治疗时,EGFR ex20ins突变的转移性NSCLC患者的无进展生存期(PFS)和总生存期(OS)最差。结构分析表明EGFR药物结合口袋存在突变,这可能会降低TKI与受体的结合亲和力。
在现有的第三代EGFR-TKI中,奥希替尼已成为一种潜在的对策药物,证明了其能够克服某些EGFR ex20ins变异对EGFR-TKI敏感性降低的问题(无论是体外还是体内)。尽管如此,EGFR ex20ins导致的EGFR-TKI治疗耐药仍是一项十分艰巨的挑战。
伏美替尼是一种新型第三代EGFR-TKI,在克服由ATP结合盒式转运体ABCB1和ABCG2介导的耐药性方面表现出良好的前景,这两种转运体是接受常规化疗的癌症患者产生多药耐药的关键。通过ATPase检测确认了伏美替尼的作用机制,揭示了其与ABCB1和ABCG2的相互作用,提出了一种克服EGFR 20号外显子突变癌症耐药的潜在策略。本文报道一例伏美替尼治疗EGFR 20号外显子插入的肺癌病例,即使存在PIK3CA突变,伏美替尼作为后续疗法治疗肺癌也是有效的。
病 例
患者女,63 岁,中国人,出现咳嗽、咳痰、右侧腰部钝痛4个余月,院外对症治疗无效。患者既往身体健康,无重大疾病、外伤或手术史。患者个人及家族病史无异常,无家族癌症病史,总体健康状况良好。体格检查未触及浅表淋巴结肿大,双肺听诊未闻及干湿啰音,心律齐,未闻及杂音,腹部柔软,无压痛,无反跳痛,未触及肿块,肝脏及肾脏未闻及叩击痛。增强胸部CT(CCT)显示肺野清晰,右肺上叶靠近纵隔处有一明显增强的肿块。病灶最长直径为 6.3 cm,具有典型的癌症特征,包括胸膜凹陷、分叶和毛刺。双肺可见大量小转移淋巴结,提示转移广泛。此外,纵隔内可见多个淋巴结肿大(图1A)。出乎意料的是,右肾也发现了一个明显的病变。颈部超声检查发现淋巴结进一步肿大。随后,患者接受增强MRI检查以排除其他脑肿瘤。

▲图1 胸部CT影像
患者可能患有同步原发恶性肿瘤,因为肺癌肾转移或肾癌肺转移的现象极为罕见。两个肿瘤均通过细针穿刺活检发现。组织病理学和免疫组织化学分析证实为肺腺癌(LUAD,图2A)和肾透明细胞癌(ccRCC,图2B)。LUAD组织的基因检测发现了两个显著的基因突变:EGFR exon20ins和PIK3CA H1047R突变,变异丰度分别为 28.85% 和 18.66%(表1)。根据Fuhrman分类,ccRCC为 1 级,表明进展风险低且具有高分化特征。根据病理、影像和实验室检查结果,LUAD和ccRCC均得到确诊。根据第八版TNM分期系统,LUAD分期为IVa(cT4N3M1a),伴有EGFR和PIK3CA突变。同样,根据第八版TNM分期系统,ccRCC分期为I(cT1bN0M0),并根据Fuhrman分类法归类为 1 级。

▲图2 肺腺癌(A)和肾透明细胞癌(B)HE染色
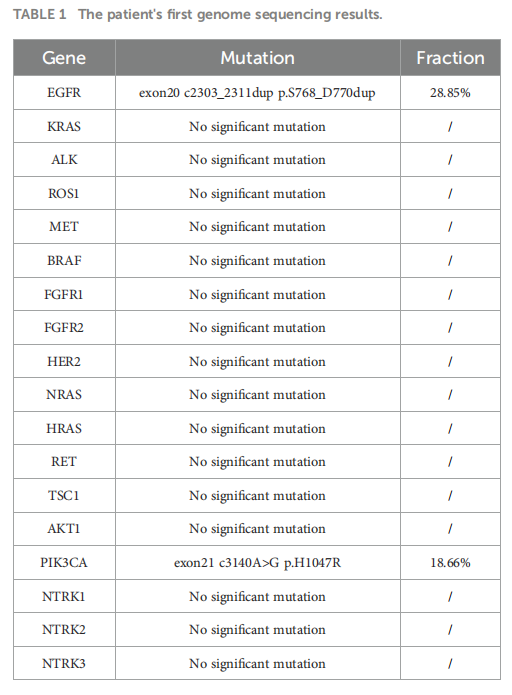
▲表1 患者首次基因检测结果
一线治疗:根据2020年CSCO非小细胞肺癌诊疗指南,EGFR 20号外显子突变LUAD的一线治疗是化疗联合贝伐珠单抗。同样,CSCO肾癌指南推荐对ccRCC使用贝伐珠单抗联合IFNα-2b。由于治疗方案重叠,患者接受了贝伐珠单抗和培美曲塞-卡铂的联合治疗。经过 2 个周期的联合治疗后,根据RECIST v1.1标准,患者的病情评估为疾病稳定(SD),肺部靶病变最大直径缩小 21.5%,非靶病变明显萎缩(图1B)。ccRCC也保持SD。经过 6 个周期的联合治疗和随后的贝伐珠单抗和培美曲塞的维持治疗后,LUAD局部进展(图1C),而ccRCC继续表现出持续的SD。一线治疗的PFS为 7 个月。
二线治疗:患者接受PD-L1抑制剂信迪利单抗联合奈达铂和紫杉醇二线治疗,前 4 个周期治疗后,患者取得 4.9 个月无进展生存,靶病灶最大直径略有缩小,6 个周期治疗后,患者局部再次进展(图1D),但ccRCC保持稳定,该二线治疗的PFS为 4.9 个月。
三线治疗:根据2021年CSCO非小细胞肺癌诊疗指南,患者接受信迪利单抗联合抗血管生成药物安罗替尼治疗。由于新的肺转移导致疾病迅速进展,三线治疗无效(图1E)。但ccRCC保持稳定。
四线治疗:FAVOUR研究发表后,患者开始接受针对EGFR突变的伏美替尼作为四线治疗,该药物提供了持续的获益,经过两个月的伏美替尼治疗,疾病获得部分缓解(PR),ccRCC保持稳定,四线治疗PFS已达 24 个月。近期因局部进展(图1F),患者再次接受基因检测,第二次基因检测结果与第一次相似:EGFR exon20ins和PIK3CA H1047R突变,变异丰度分别为 51.07% 和 13.66%(表2)。由于癌症控制时间延长和并检出相同基因突变,给予患者三倍剂量的伏美替尼(240mg QD)。两个周期治疗后,患者接受另一次CCT以评估治疗效果。肺部病变较之前扫描结果明显缩小(图1G)。患者使用伏美替尼治疗后共获得 27 个月的PFS,且PFS仍在延长(图3)。
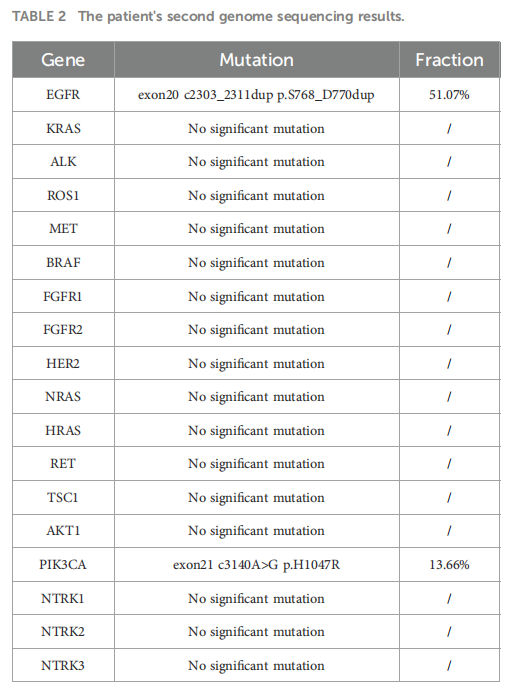
▲表2 患者第二次基因检测结果

▲图3 疗效评价及治疗时长回顾
患者对剂量增加的伏美替尼耐受性良好,副作用可控。在高剂量治疗期间,主要副作用是 1 级口腔黏膜炎。患者报告轻微口腔疼痛,偶尔在咀嚼时发生,这种疼痛可以忍受,不会显著影响日常活动或生活质量。无需医疗干预,伏美替尼的治疗剂量保持不变,无需调整。
讨 论
肺癌分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC),是全球最常见的癌症,也是癌症死亡的主要原因。EGFR突变常见于大多数女性NSCLC患者中。对携带EGFR突变的患者使用TKI可显著提高总体生存率。
制定治疗计划
该患者患有同步原发癌:LUAD和ccRCC。根据Fuhrman分类,该患者属于ccRCC的低风险亚组,即使不治疗也可能保持稳定。因此,临床观察可以成为管理低风险ccRCC的可行选择。但LUAD需要及时治疗。考虑到患者的同步原发肿瘤,治疗决策应采用多学科团队方法,以有效解决这两个肿瘤。2020 年CSCO非小细胞肺癌诊疗指南建议对EGFR突变LUAD使用贝伐珠单抗联合化疗,这也可为ccRCC带来治疗获益。一项真实世界研究表明,对于携带EGFR ex20ins的LUAD,化疗比EGFR-TKI更有效。这是因为突变会改变激酶活性位点的构象,从而降低一、二代EGFR-TKI的疗效。研究表明,化疗与贝伐珠单抗联合使用可改善客观缓解率,这种方法使PFS达到 7 个月。二线治疗基于Orient-11研究,将免疫疗法与化疗相结合,为非鳞状细胞癌NSCLC患者提供更长的PFS。此方案使PFS达到 4.9 个月。随着癌症的进展,抗癌疗法的疗效逐渐减弱。三线治疗涉及抗血管生成疗法,这是LUAD后续治疗的标准选择,有时会带来良好的临床结果。由于药品营销政策,患者免费接受了信迪利单抗,将抗血管生成疗法与免疫疗法相结合。尽管采用了这种联合治疗,但未观察到PFS显著改善。当LUAD再次进展时,FAVOUR研究发表,表明携带EGFE 20号外显子插入的患者可从伏美替尼中获益,该药物具有良好的安全性。根据该研究,患者获得了长期PFS。
经过 24 个月的标准剂量 80 mg/天的伏美替尼治疗后,患者病情出现进展,肺部病变面积增大。第二次基因检测显示,EGFR ex20ins突变持续存在,且与基线相比,变异丰度增加,且未出现任何新的耐药相关基因变异。这一发现表明耐药机制仍依赖于EGFR,可能是因为EGFR突变负荷增加,使得标准剂量不足以有效抑制肿瘤进展。为此,治疗方案调整为更高剂量的伏美替尼(240 mg/天),以增强EGFR抑制。经过两个周期高剂量伏美替尼治疗后,随访影像学评估显示肺部病变面积显著缩小,表明疾病控制有效。
NSCLC中的EGFR 20号外显子插入突变
EGFR是一种糖蛋白,由三个主要结构域组成:胞外EGF结合结构域、跨膜区和调节催化活性所必需的胞质酪氨酸激酶结构域。胞质结构域包括较小的N端叶(N-terminal lobe)和较大的C端叶(C-terminal lobe),由ATP结合间隙隔开。配体与EGFR结合会触发二聚化,激活激酶结构域并启动下游信号通路(图4A)。NSCLC中常见的EGFR突变包括 19号外显子缺失(exon19del)和21号外显子L858R,合计占NSCLC中观察到的EGFR突变的 85%。
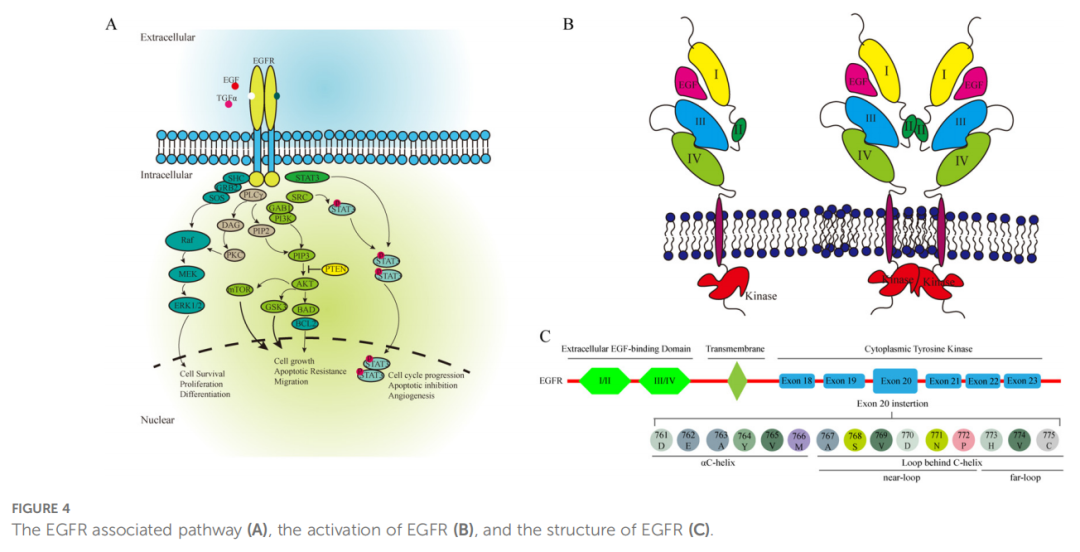
▲图4 EGFR相关通路(A)、EGFR激活(B)和EGFR结构(C)
EGFR ex20ins突变约占所有EGFR突变的 4%-12%,是第三大常见突变。此类突变主要见于女性、非吸烟者和亚洲人。EGFR ex20ins突变主要发生在αC螺旋的C末端环(ex20ins-L)和αC螺旋内部,可进一步分为近环(AA767-772)和远环(AA773-775)亚型。远环突变对第一代和第二代EGFR-TKI明显耐药。EGFR-TKI对EGFR 21号外显子远环插入患者往往疗效不佳(图4B)。
奥希替尼是第三代EGFR-TKI,对EGFR ex20ins的NSCLC患者疗效有限。研究显示ORR低(5%-6.5%)且中位PFS短(2.3-3.6 个月)。一项II期试验将奥希替尼的推荐剂量加倍,未达到 30% ORR,仅记录到 24% 的ORR和 9.6 个月的中位PFS。因此,奥希替尼在较高剂量下的获益可能有限。
伏美替尼一线治疗对EGFR ex20ins突变的晚期NSCLC患者有效,中位PFS为 8.13-10.90 个月。伏美替尼及其主要代谢产物可有效靶向治疗携带EGFR敏感突变和T790M耐药突变的癌症,同时对野生型细胞的影响极小。FURLONG研究表明,对于中国EGFR突变阳性晚期NSCLC患者,伏美替尼较吉非替尼可显著延长中位PFS。正在进行的临床试验也报告了伏美替尼对携带这些特定突变的患者具有良好的疗效和耐受性。
新型EGFR ex20ins抑制剂
近期的研究进展推动了针对EGFR ex20ins的NSCLC患者的新型靶向疗法的开发。莫博赛替尼、埃万妥单抗、CLN-081和舒沃替尼等药物已在临床试验中显示出良好的治疗效果。莫博赛替尼是一种小分子EGFR/HER2 TKI,专门靶向EGFR exon20ins。它通过不可逆地结合EGFR的半胱氨酸-797(c-797)残基实现选择性增强,临床研究报告称,在NSCLC患者中,研究者确认的缓解率为 43%,中位PFS为 7.3 个月。埃万妥单抗是一种针对EGFR和c-MET的创新型双特异性单克隆抗体,已通过多种机制显示出抗肿瘤功效,包括破坏配体结合和受体磷酸化以及免疫细胞参与。在CHRYSALIS I期临床试验中,携带ex20ins突变的既往接受过治疗的NSCLC患者的ORR为 40%,中位PFS为 8.3 个月。CLN-081是一种口服不可逆EGFR-TKI,选择性靶向ex20ins突变,在临床前研究中已通过抑制各种ex20ins突变证明其有效。CLN-081的临床试验表明,在携带ex20ins突变的NSCLC患者中,56% 的PR率为 40%,病情稳定。舒沃替尼是一种选择性EGFR ex20ins小分子抑制剂,在一项关键研究中表现出显著的抗肿瘤活性,在携带这些突变的中国NSCLC患者中,已证实的ORR为 60.8%。
EGFR依赖性耐药机制
第三代EGFR-TKI的获得性耐药是EGFR突变型肺腺癌治疗的重大临床挑战。在EGFR依赖性耐药机制中,EGFR激酶结构域内的二次突变占主导地位。C797S突变会破坏第三代EGFR-TKI的共价结合,是最常见的突变,通常在长期治疗后出现。其它突变,包括 T790M、L792H、G796R、M766Q和L798I,可改变激酶结构域并降低药物疗效。此外,EGFR异二聚体的形成(例如EGFR-HER2或EGFR-HER3)会启动绕过EGFR抑制的补偿性信号通路。这种二聚化会驱动致癌下游信号,从而维持肿瘤细胞增殖和存活。另一个关键机制是激活PKCδ信号通路,这会导致PKCδ的核易位,随后激活AKT和NF-κB信号,从而促进细胞存活和治疗耐药性。这些机制共同凸显了EGFR依赖性耐药性的复杂性,并强调需要针对EGFR激酶域及其下游效应物的治疗策略。将EGFR抑制剂与针对HER2/3或PKCδ通路的药物联合使用,可能有望克服耐药性。有必要进一步研究以制定预防或延迟这些耐药机制出现的策略,最终改善EGFR突变肺腺癌患者的预后。
NSCLC中的PIK3CA突变
PIK3CA基因编码磷脂酰肌醇3-激酶(PI3K)催化亚基的α异构体,在PI3K/AKT/mTOR信号通路的激活中起关键作用,而该通路对于调节癌症相关的细胞过程至关重要。PIK3CA突变发生在各种癌症中,在NSCLC病例中的突变频率为 5%-8%,在中国泛肿瘤样本中约 6.33% 被发现存在该突变。关键突变热点包括E545K/Q/A/V/D/G、E542K和H1047R/L/Y。这些突变通过激活PI3K/AKT/mTOR通路促进细胞存活和增殖。值得注意的是,H1047R突变是最常见的突变之一,位于激酶结构域,在促进细胞生长和存活方面起重要作用。该突变还通过激活下游效应因子(如AKT和mTOR)导致肺癌对EGFR-TKI产生耐药性。此外,研究表明,与仅有EGFR突变的患者相比,同时存在EGFR和PIK3CA突变的NSCLC患者在接受EGFR-TKI治疗时,进展时间明显缩短,总体生存率降低。
PIK3CA抑制剂在癌症中的应用
近年来,许多PI3K/AKT通路特异性TKI被开发出来,例如泛AKT抑制剂、双PI3K/mTOR抑制剂、PI3K亚型抑制剂和mTOR抑制剂。选择性PI3Kα抑制剂阿培利司在针对PIK3CA突变肿瘤(乳腺癌中的一个重要基因亚群)方面表现出显著疗效。III期SOLAR-1试验提供的证据表明,阿培利司与氟维司群在内分泌治疗中的治疗协同作用显著延长了既往接受过抗雌激素治疗的PIK3CA突变、ER+转移性乳腺癌患者的PFS。阿培利司作为PI3Kα特异性抑制剂脱颖而出。PI3Kα特异性抑制剂Taselisib因其在乳腺癌治疗中的潜在作用而受到临床试验的严格审查。III期SANDPIPER试验表明,对于在芳香化酶抑制剂(AI)治疗期间或之后出现进展的ER+晚期乳腺癌患者,Taselisib和氟维司群联合治疗与氟维司群单药治疗相比,可略微延长PFS(有显著统计学意义)。这种改善虽然不显著,但却引人注目,不区分PIK3CA突变状态,中位PFS分别为 7.4 个月 vs 5.4 个月(p=0.0037)。相反,II期LORELEI试验显示,在早期ER+/HER2-乳腺癌患者的新辅助治疗中,无论患者是否携带PIK3CA突变,Taselisib和来曲唑联合治疗与来曲唑单药治疗之间的病理完全缓解(pCR)率没有显著差异。SANDPIPER和LORELEI试验均报告了与Taselisib治疗相关的严重不良反应发生率较高,导致治疗中断率较高——分别为 17% 和 11%。这些安全问题掩盖了该药物的潜在获益,阻碍了其临床开发进程。
本文患者检出了两个基因突变,EGFR exon20ins和PIK3CA H1047R。如先前的研究,EGFR-TKI可能对该患者无效。但伏美替尼使PFS延长,即使是作为四线治疗。EGFR-TKI对该患者起作用的原因很复杂。该患者有多线治疗史,包括化疗、免疫疗法和抗血管生成疗法。联合疗法是该患者的关键点之一。它可能改变了基因表达,使EGFR突变丰度更高,或者PIK3CA/AKT/mTOR通路可能不是该患者肿瘤细胞增殖的主要通路。另一个原因可能是药物伏美替尼。伏美替尼可以不可逆地抑制EGFR耐药(T790M突变)或激活突变。先前的研究表明,伏美替尼可能适合作为EGFR 20号外显子插入患者的一线治疗选择,因为它可以显著改善症状、延长生存期,副作用更少且更易于控制。
本案例研究有几个局限性。在诊断LUAD和ccRCC时,应完成骨扫描和PET/CT等额外检查。必须通过全面的基因检测方法确认胸部病变的遗传状态,例如全基因组测序(WGS)或转录组测序(RNA-Seq),以检测已知和未知的基因突变。关于这名患者,需要解决三个关键问题:第四次进展后的下一步治疗计划是什么?肺组织中是否需要检测PD-L1?ccRCC的最佳手术时机?研究人员所在小组致力于通过扩大样本队列来扩大研究范围,从而更明确地评估伏美替尼作为携带EGFR 20号外显子插入点突变和其它基因突变的NSCLC患者有效治疗方法的临床疗效。研究人员还将探讨伏美替尼联合其它治疗对EGFR ex20ins突变的NSCLC的潜在临床获益。
参考文献:
Sun K, Wang P. A good response to furmonertinib fourth-line treatment of an advanced lung adenocarcinoma patient with EGFR exon20in and PIK3CA mutation: a case report and literature review. Front Oncol. 2024 Dec 17;14:1467722. doi: 10.3389/fonc.2024.1467722. PMID: 39743996; PMCID: PMC11688600.



