CCR:血液ctDNA预测转移性结直肠癌一线化疗疗效,大panel和多次采样可提高准确性
时间:2025-01-30 12:08:47 热度:37.1℃ 作者:网络

研究者评估了循环肿瘤DNA(ctDNA)的变化是否可用于评估接受一线全身抗癌治疗(SACT)的转移性结直肠癌(mCRC)患者的早期疗效和临床结局。在接受一线SACT的mCRC患者中,从基线(BL,一线治疗开始前2天内)开始每4周采集一次血浆样本,直至疾病进展,共采集862份血浆样本。采用不依赖组织类型的二代测序panels对ctDNA进行检测。ctDNA正常化(normalization,即ctDNA清除)的定义为:在BL ctDNA中,变异丰度最高的3个变异,在治疗1个月(Mo1)后清除率达到≥99%。
来自75名患者的83对样本可供分析。其中12对(14.4%)在BL或Mo1时均未检测到变异。在其余71对比较样本(65名患者)中,37对(52.1%)在Mo1时出现ctDNA正常化。与未实现ctDNA正常化的患者相比,ctDNA清除的患者总生存期(45.6个月)和无进展生存期(13.9个月)显著更长[未正常化患者的总生存期为22.6个月(对数秩检验P = 0.01),无进展生存期为10.7个月(对数秩检验P = 0.036)]。此外,ctDNA清除的患者缓解率(72.9%)高于未正常化的患者(38.2%)。对无进展生存期大于10个月的患者进行至少四个时间点的纵向测序,结果显示47.8%的病例出现新的变异;在所有这些患者中,这些新的“异常”变异的轨迹似乎与疾病的临床 - 影像学进程以及其他突变的趋势形成鲜明对比。
ctDNA的清除是mCRC患者从一线SACT中获益的早期指标;有必要对多种变异进行连续追踪,以提高特异性,避免因出现临床意义不明的突变而产生误导性信息。
研究背景
结直肠癌是全球癌症相关死亡的第三大主要原因。以氟嘧啶为基础,联合奥沙利铂和(或)伊立替康,再结合EGFR或VEGF抑制剂的双药或三药化疗方案,是转移性结直肠癌(mCRC)治疗的基石。对于这些患者,通过定期影像学检查评估治疗反应,而癌胚抗原(CEA)和糖类抗原19 - 9(CA19.9)等肿瘤标志物则常被用于对疾病进行纵向监测。这两种方法都有局限性,因为影像学检查无法提供有关肿瘤功能状态或分子构成的信息,而循环糖蛋白的敏感性和特异性有限。
循环肿瘤DNA(ctDNA)代表循环游离DNA(cfDNA)的一小部分,是癌细胞在细胞转换和应激反应期间通过不同机制脱落,如凋亡、坏死、吞噬或NETosis。对cfDNA中的基因组变异或甲基化模式进行分析的准确性极高,并且在实体恶性肿瘤的多种临床应用中越来越受到重视。在mCRC中,对ctDNA进行连续分析已被用于评估接受抗EGFR单克隆抗体治疗患者的至治疗失败时间,并且鉴于RAS变异随时间衰减,还可在停药一段时间后,使用相同方案对患者再次进行治疗,这在临床试验中取得了令人鼓舞的结果。在I至III期结直肠癌中,正在对ctDNA作为预后指标进行评估,以便根据术后ctDNA状态以及辅助化疗后ctDNA的清除情况,来指导治疗的降级或强化。尽管ctDNA在早期和晚期结直肠癌患者的管理方面极具潜力,但人们对治疗期间或治疗后ctDNA的动态变化了解甚少。事实上,迄今为止报道的大多数分析主要聚焦于接受EGFR抑制剂治疗患者的RAS/RAF变异情况,而关于化疗联合VEGF抑制剂对ctDNA变化趋势影响的数据却十分有限。鉴于临床研究人员和监管机构将ctDNA清除视为临床获益的替代终点,深入了解接受标准化疗方案±生物制剂治疗患者的ctDNA动态变化,仍是一项尚未满足的需求。在此,研究者旨在一个前瞻性队列研究中,检验使用ctDNA监测来评估接受一线化疗联合抗VEGF或抗EGFR抗体治疗的mCRC患者的早期治疗反应和临床结局,探索其中的前景与挑战。
研究结果
治疗前液体活检中的ctDNA:
对于接受一线SACT的81例微卫星稳定/DNA修复功能正常的mCRC患者,从BL起至疾病进展,每月采集862份血浆样本。其中6例患者因疾病进展迅速,或在首个化疗周期后因严重毒性反应而停止化疗,仅提供了1份ctDNA样本,因此被排除在分析之外。在其余75名受试者中,8名患者在疾病进展后重新接受维持治疗,因此总共可检测83份BL样本(一线治疗样本数n = 70;二线治疗样本数n = 13)。在对克隆性造血进行校正后,70名患者中检测到244个单核苷酸变异(SNV)和16个拷贝数变异。13例(15.7%)ctDNA检测结果为阴性,而8例(9.6%)仅显示一个SNV;其余BL样本中可检测到多达9个SNV(74.7%)。在ctDNA阳性病例中,观察到RAS野生型(WT)基因型和肝转移的比例较高,不过由于ctDNA阴性的BL样本数量有限,这一趋势未达到统计学意义。突变驱动基因的频率与结直肠癌大型测序研究中观察到的分布情况相符。在相同的ctDNA阳性样本中,CEA和CA19 - 9阳性的病例分别占68.5%和42.8%。根据如CIViC和CGI等临床可操作性知识库对突变驱动基因进行基因组定位,结果显示34例样本存在符合ESCAT I级标准的对SACT耐药和敏感的基因组驱动因素。这些样本/生物标志物大多与RAS/RAF突变的存在有关。
多项研究分析了组织活检与液体活检中RAS/RAF状态的一致性;然而,其中大多数研究仅检测特定的RAS/RAF热点区域,并未纳入其他基因(如APC或TP53)作为参照。在本队列研究中,依据标准的组织分析,36例患者为RAS/RAF三重野生型;其中32例患者的ctDNA检测出一个或多个SNV。在这32例中,28例(87.5%)为RAS/RAF野生型,1例在重新接受治疗时出现BRAF V600E突变,2例出现KRAS变异,但配对组织中未检测该变异,还有1例出现KRAS突变(G12C),在匹配的组织中检测时未发现此突变。另一方面,依据组织DNA分析,39个样本为RAS或RAF突变型;其中39例在BL ctDNA中可检测到一个或多个单核苷酸变异。31例(79.5%)组织与血液检测结果一致,8例依据ctDNA分析判定为野生型,尽管其中1例在组织中检测到的RAS变异在一个月后才在ctDNA中出现。对于ctDNA检测出一个或多个单核苷酸变异的患者,相较于基于组织的诊断方法,液体活检检测的准确率为0.86,灵敏度为0.79,特异度为0.93。
接受一线SACT治疗的mCRC患者的早期ctDNA清除率和临床结局:
接下来,研究者评估了接受一线和二线治疗的mCRC患者,治疗1个月后(Mo1)ctDNA的变化是否可以预测SACT的临床获益情况。首先,研究者分析了变异等位基因频率(VAF)的变化(图1A);研究者将ctDNA正常化定义为BL时等位基因频率最高的三个SNV清除率≥99%(图1B)。根据预先设定的分析,如同先前其他晚期胃肠道癌类似研究报道的那样,使用最多三个变异(等位基因频率最高的变异)来检测ctDNA清除情况。值得注意的是,除了下文所述的携带“异常变异”的患者外,在ctDNA完全清除的病例中,经过1个月治疗后所有变异均发生转变,呈现相同趋势,无论在基线ctDNA中最初检测到的突变数量如何。
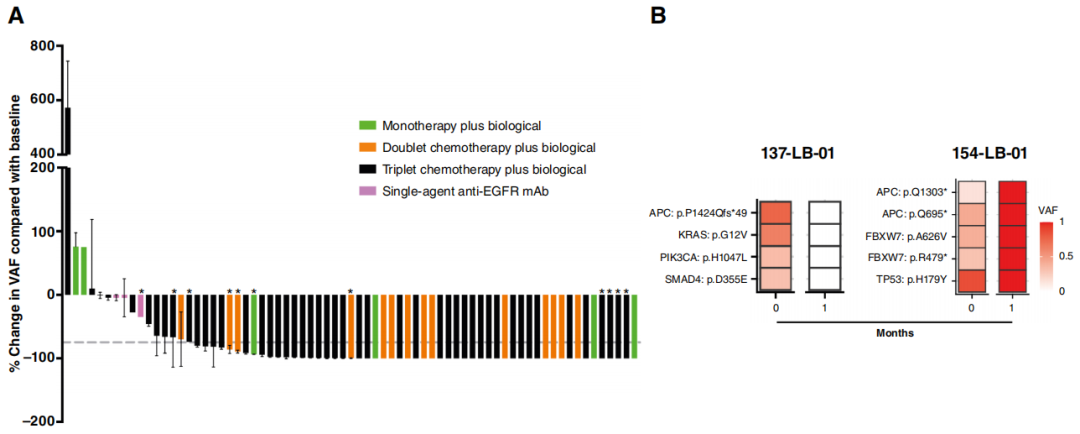
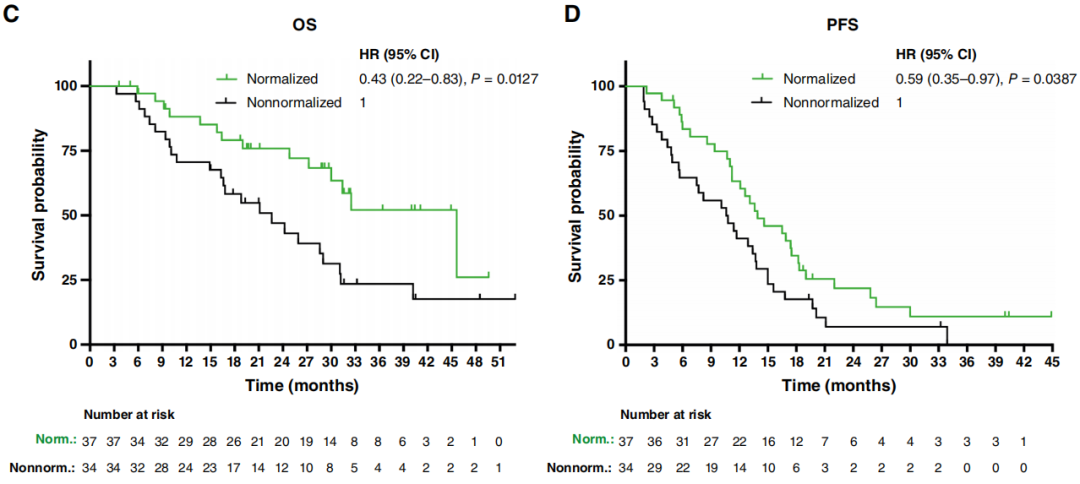

图1
来自75名患者的83对样本可供分析(8名患者同时有一线和二线治疗时采集的血样)。12对样本(14.4%)在BL或Mo1时均未检测到变异。在其余71组对比样本(65名患者)中,37组(52.1%)在Mo1时显示ctDNA达到正常化。整个队列的中位随访时间为32.5个月(95%CI,29.2 - 39.9),中位OS和PFS分别为29.0个月(95%CI,22.6 - 40.2;38例事件)和12.6个月(95%CI,10.7 - 14.6;62例事件),客观缓解率(ORR)为54.9%(39/71例有缓解;95%CI,42.7 - 66.7)。77.5%的病例在Mo1时观察到ctDNA正常化或显著降低(VAF下降>75%),且这与所使用治疗方案的强度(单药、双药或三药方案)无关(图1A;表1)。
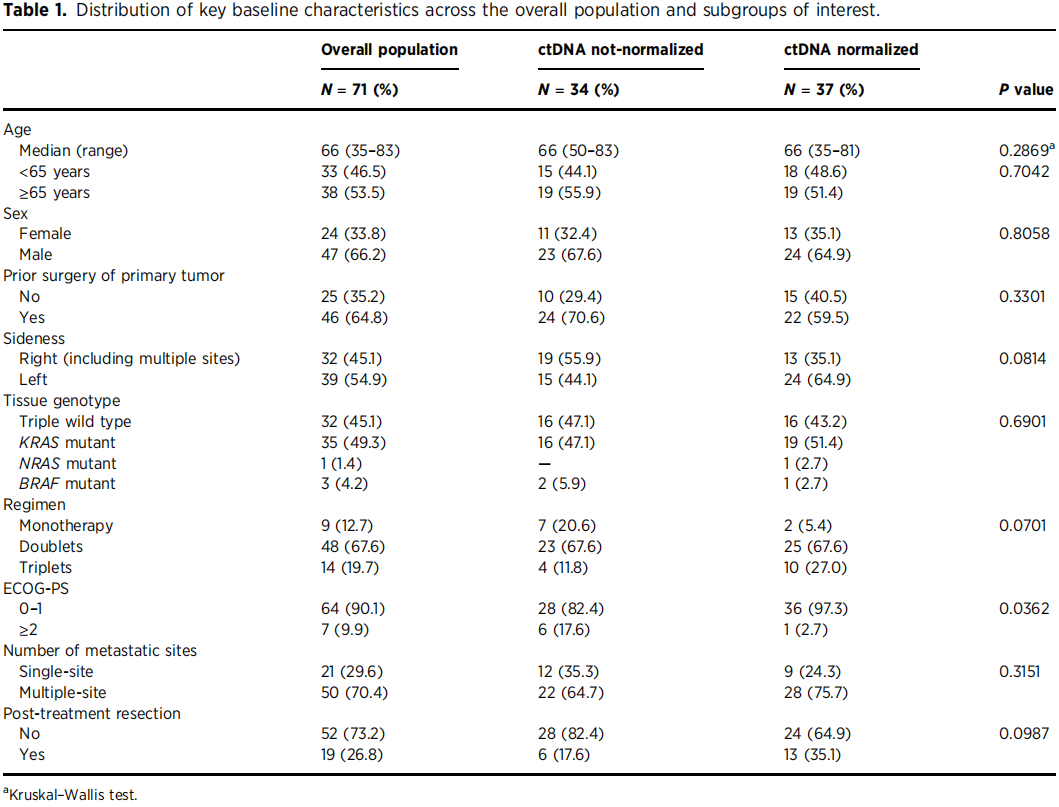
表1
与未达到正常化的患者相比,在ctDNA达到正常化的患者中,BL ECOG - PS为0至1分的病例比例更高(97.3% vs 82.4%;P = 0.0362),而其他临床病理特征,包括年龄、性别、原发肿瘤既往切除术、肿瘤部位、RAS/RAF基因型、治疗方案类型以及转移部位数量,均与ctDNA动态变化无显著相关性(表1)。与ctDNA未达到正常化的患者相比,ctDNA正常化的患者总生存期(OS)显著更长,中位OS为45.6个月(95%CI,30.0 - 未达到;14例事件),无进展生存期(PFS)为13.9个月(95%CI,11.2 - 18.3;30例事件),而ctDNA未正常化患者的OS为22.6个月(95%CI,16.6 - 31.2;24例事件;对数秩检验P = 0.01),PFS为10.7个月(95%CI,7.53 - 13.8;32例事件;对数秩检验P = 0.036)(图1C和D)。此外,ctDNA正常化的患者ORR更高,为72.9%(27/37例有缓解;95%CI,53.0 - 84.1),而未正常化患者的ORR为38.2%(13/34例有缓解;95%CI,22.1 - 56.4)(卡方检验P = 0.007)。在多变量模型中,ctDNA正常化被证实是降低死亡风险的独立预测因素(HR= 0.47,95%CI,0.23 - 0.96;P = 0.04),以及一线治疗获得客观缓解的可能性更高的独立预测因素(OR = 3.03,95%CI,1.08 - 8.49;P = 0.0351;表2)。
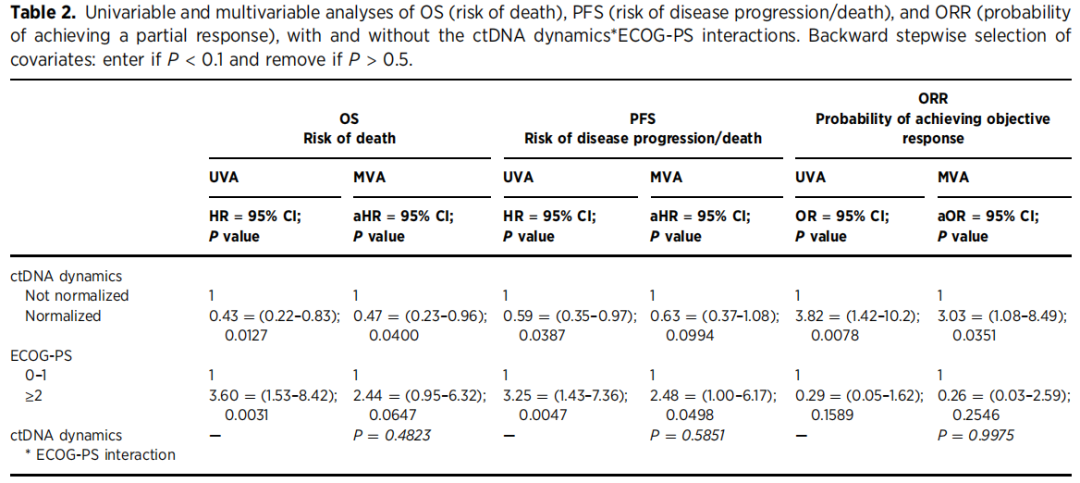
表2
鉴于诱导治疗后转移性病灶的手术切除、临床结局与ctDNA动态变化/清除之间存在关联,研究者基于ctDNA清除情况对临床结局进行了额外的敏感性分析,排除了所有接受诱导治疗后手术的患者。52名患者纳入敏感性分析。与ctDNA未达到正常化的患者相比,ctDNA正常化的患者OS显著延长[32.5个月(95%CI,18.9 - 45.6;10例事件)vs 18.9个月(95%CI,10.8 - 28.6;21例事件),对数秩检验P = 0.0297]。ctDNA正常化与PFS延长的趋势相关,但无统计学意义[13.9个月(95%CI,9.4 - 17.5;20例事件)vs 8.1个月(95%CI,4.9 - 13.4;27例事件),对数秩检验P = 0.1303]。同样,ctDNA达到正常化的患者ORR为58.3%(14/24例有缓解;95%CI,31.9 - 97.9),而未达到清除的患者ORR为35.7%(10/28例有缓解;95%CI,17.1 - 65.7;P = 0.1062)。
最后,研究者以ORR为基准,在同一队列中比较了ctDNA和CEA的准确性。对于ctDNA和CEA,BL与Mo1之间的变化,分别在85.5%和74.7%的患者中有参考意义,因为在其余病例中,这两种生物标志物在两个时间点均为阴性或低于病理阈值(CEA < 5 ng/mL)。ctDNA正常化显示出的灵敏度为0.68、特异度为0.68、准确度为0.68。对于CEA,仅22.6%的患者出现完全正常化,其灵敏度为0.25、特异度为0.8、准确度为0.5。
接受一线SACT的mCRC患者纵向ctDNA动态:
值得注意的是,当研究者对比BL和Mo1时的ctDNA,在来自11名患者的12组对比样本中(图1A中标记为∗;占队列的15.5%),观察到出现了13个在基线时不存在的新SNV。在其中一个病例(LB - 119 - 01)中,新变异与其他SNV的VAF稳定相关,而在其余10个病例中,新变异的出现与基线时存在的所有其他SNV的显著减少(n = 5)或完全清除(n = 6)形成鲜明对比。鉴于这些变异的意义尚不明确,在上述生存分析中,这些病例均未被视为ctDNA已清除。值得注意的是,当进行纵向监测时,这些新出现的变异并不遵循其他SNV的变化规律或疾病进程,因为在治疗过程中,它们常常自发出现和/或清除(图2A - D)。11名患者中有10名一线治疗的PFS大于10个月(范围为10.1 - 33.9个月),而LB - 119 - 01接受了二线SACT,PFS为8.2个月。
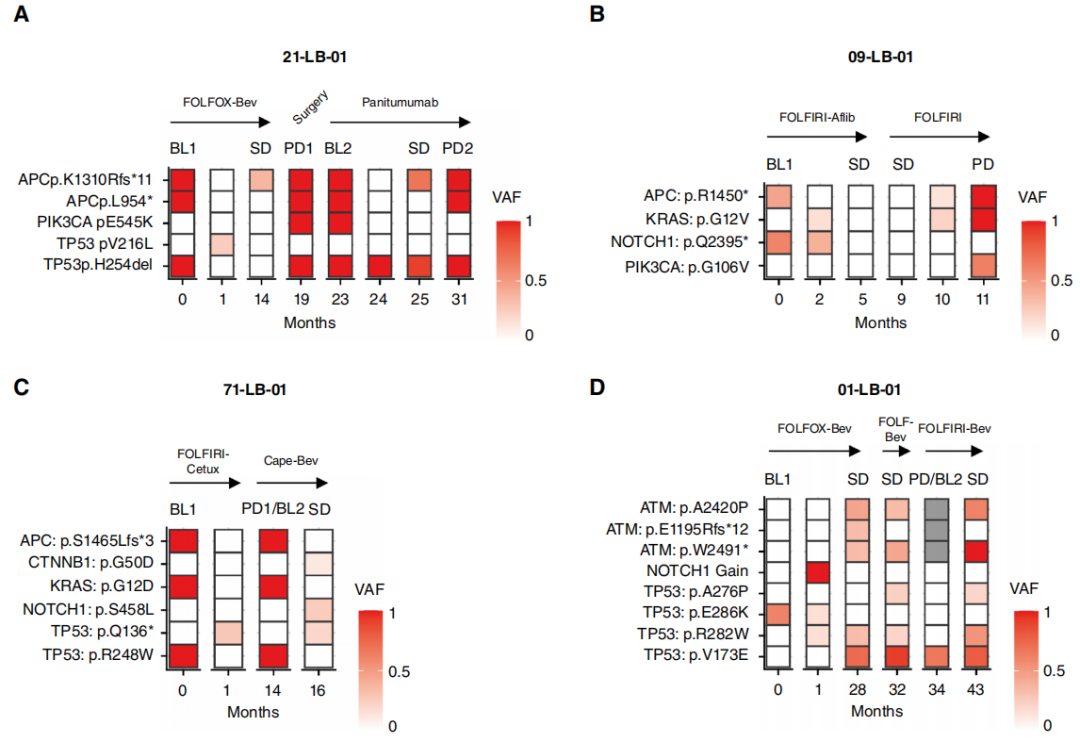

图2
这些观察结果引发了兴趣,于是研究者扩大了对系列ctDNA的测序分析范围,包括分析至少涵盖四个临床相关时间点,纳入了队列中所有PFS大于10个月的患者(比大型mCRC荟萃分析报告的一线治疗PFS更长的患者)。33名患者符合这些标准;其中7名患者此前已为另一项研究进行过分析,而3名患者在测序的四个时间点中任何一个都未检测到变异,因此最终有23名患者纳入此次分析。在这组患者中,共检测到116个SNV(每位患者中位数为5个;范围1 - 9个),并监测超过137个cs(每位患者中位数为6个;范围4 - 9个)。在12名患者中,所有SNV都反映了疾病进程和肿瘤负荷情况,即在病情缓解和肿瘤负荷降低时,VAF下降,而在疾病进展时,VAF上升(图3A - D)。在其余11名受试者(占47.8%)中,研究者检测到19个变异(占总数的17%),这些变异并不遵循在患者体内检测到的其他所有变异的变化轨迹,其出现或清除与疾病的临床进程、肿瘤负荷、肿瘤标志物或SACT的变化无关(图3E - H)。有或没有“异常”变异的患者在人口统计学、临床、病理或治疗方面均未观察到显著差异。为排除导致假阳性或假阴性变异的分析偏差,首先,研究者对分析中检测到的所有变异进行基因分型,并比较了经过临床验证的ctDNA分析流程所产生的VAF估计值与基于Platypus的VAF估计值,结果发现SNV、插入缺失变异(InDel)和多核苷酸变异(MNV)的估计值完全相关。接下来,研究者比较了检测到变异与未检测到变异的样本中的VAF(基于临床分析流程),结果表明,VAF > 0.01的突变始终能被检测到,而未被识别的变异/时间点的VAF显著较低,但这些变异为真阳性。综上所述,这些数据表明,在接受SACT的mCRC患者中,约50%的患者体内,常见结直肠癌驱动基因(如TP53、APC和ATM)的一些突变会在血液中出现和/或消失,且缺乏合理的临床生物学解释。
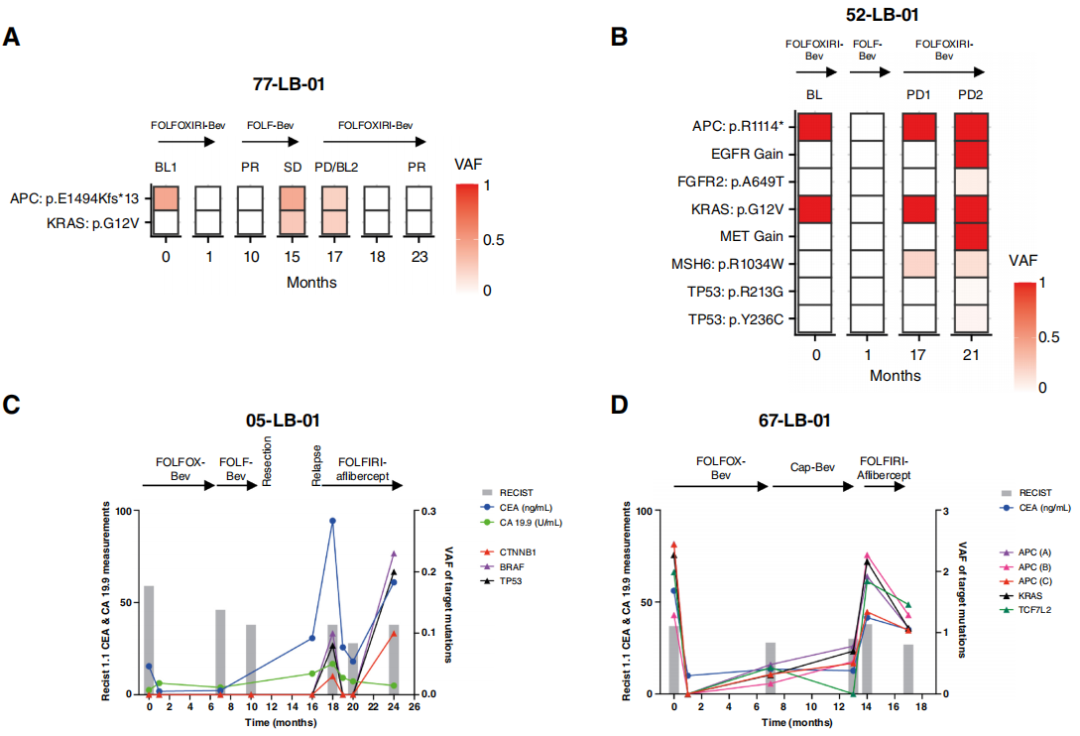
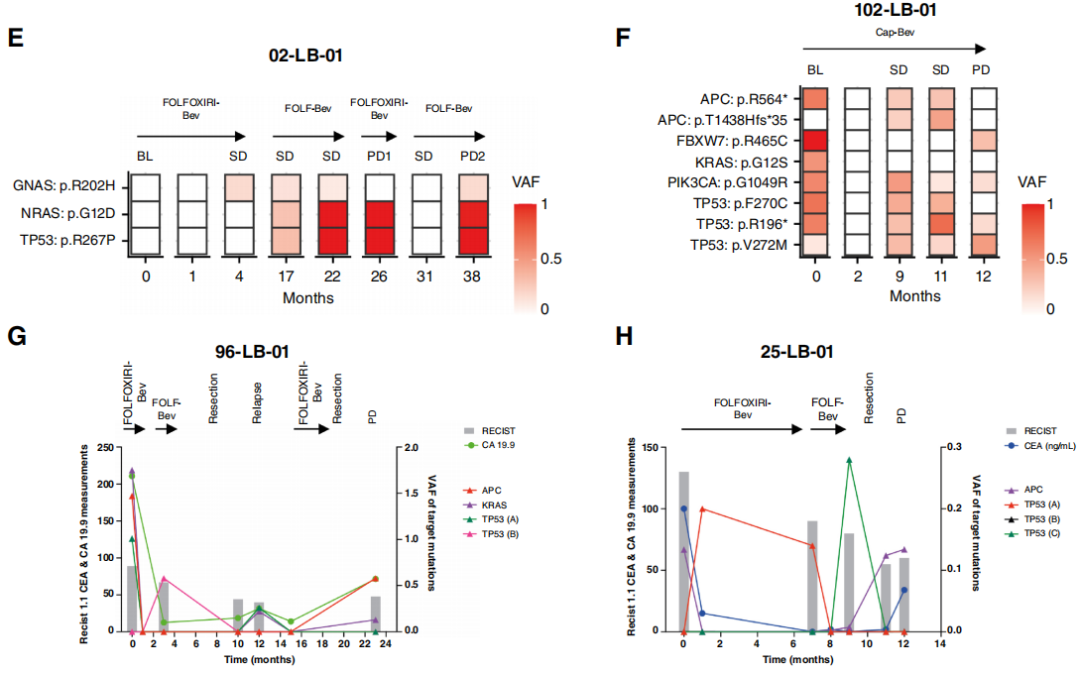

图3
在本队列中,18名患者在术前化疗后接受了转移灶切除手术(肝脏转移灶切除18例;肺部3例;腹膜2例),部分患者(n = 13)还同时切除了原发性结直肠癌。14例患者在术后一个月内采集了术前和术后的血液样本,而其他患者由于并发症或后勤问题,未能采集到术后血样。在这些患者中,11例患者术前和术后的ctDNA检测均为阴性,并且在所有这些病例中,无复发生存期均超过6个月,其中4例患者在随访24个月后仍未复发。在其余3例术后ctDNA检测呈阳性的患者中,2例患者(25 - LB - 01和94 - LB - 01)在术后3个月内复发,检测到多个突变;而在另1例患者(107 - LB - 01)中,仅存在一个低VAF的单一变异,且该变异在术后化疗期间清除,该患者在术后17个月才出现病情进展。
最后,在疾病进展时,根据临床可操作性知识库对突变基因进行基因组定位,与BL样本相比,除了3例基于组织检测被判定为KRAS突变的患者外,未发现符合ESCAT I级标准的新的可靶向驱动基因。这3例患者中,KRAS突变在基线时未检测到,但在疾病进展时出现;另有1例患者,尽管其他变异仍可检测到,但KRAS变异在SACT后被清除。
组织 VS 液体活检:
接下来,研究者对那些ctDNA在BL和Mo1间显示出变异趋势不一致的患者(如图2及图3E - H所述),检测了组织活检与液体活检结果的一致性。对11份存档的福尔马林固定石蜡包埋(FFPE)样本进行了全外显子组测序(WES),其中包括7例在BL和M01间VAF趋势不一致的患者,以及4例(05 - LB - 01;87 - LB - 01、95 - LB - 01和124 - LB - 01)作为对照的患者。在ctDNA中检测到的31个变异里,有23个(74%)在配对的组织样本中也能检测到(图4A)。在组织活检与液体活检的匹配分析中,未观察到VAF的线性相关性(图4B和C);然而,在11例的8例中,ctDNA中VAF最高的SNV,在组织样本中也是VAF最高的变异。
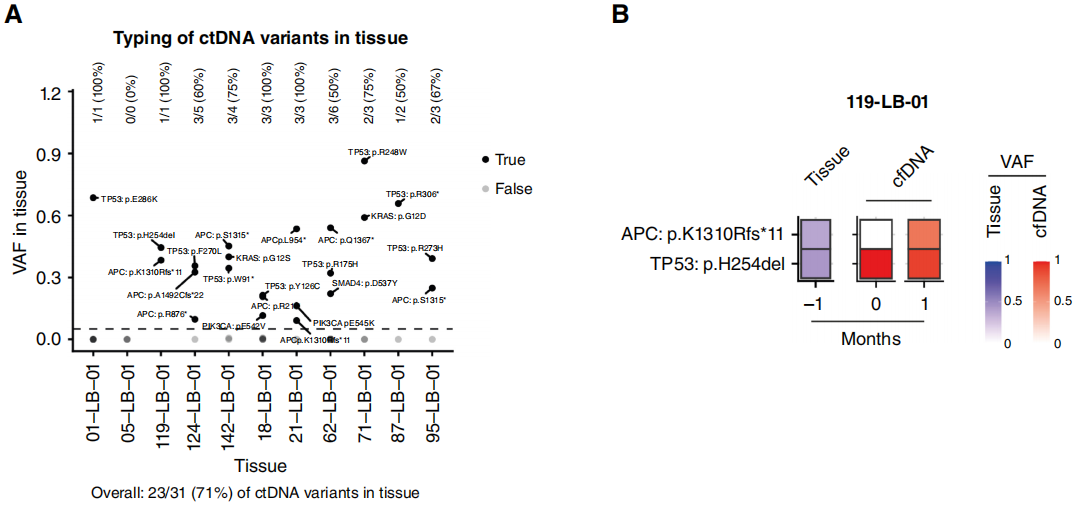
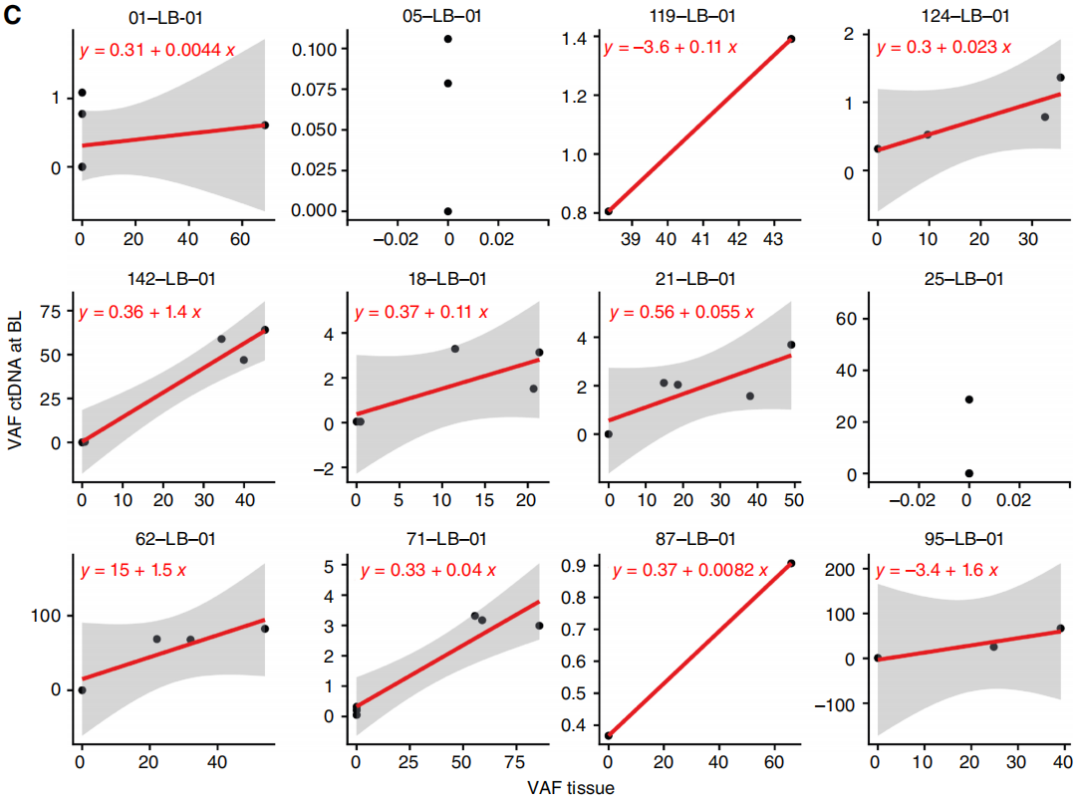

图4
在BL和Mo1对比中VAF趋势不一致的7例患者中,观察到其中3例(42.8%)的组织活检与液体活检结果存在差异:在1例患者(21 - LB - 01)中,血液中VAF最低的突变在组织中VAF最高;在第2例患者(71 - LB - 01)中,ctDNA中VAF最高的突变在匹配的组织中未检测到;最后,在1例患者(119 - LB - 01,图4B)中,Mo1检测到的两个突变在匹配组织中的VAF相近;然而,这两个突变中只有一个存在于BL血液样本中,另一个则没有。
讨 论
本研究深入探讨了ctDNA监测对接受一线化疗的mCRC患者的预后价值,同时突显了将ctDNA用作治疗反应替代生物标志物时所面临的机遇与挑战。若经进一步验证,将ctDNA作为mCRC临床获益的早期替代指标,有助于识别那些不太可能对当前标准SACT产生反应的患者。这便为临床决策提供了多种选择,比如将治疗方案从单药化疗强化为双药化疗,或从双药化疗升级为三药化疗;也可以启用新的治疗方案,又或是如该领域当前研究倡议所建议的,让患者在临床试验背景下改用实验性疗法。
在本队列中,约85%的患者在BL或Mo1时的ctDNA中显示出不止一种变异。这些结果与有限的现有文献相符,并证实与CEA和CA19.9等常规使用的肿瘤标志物相比,ctDNA状态(治疗前及治疗1个月后的清除情况)是更敏感的生物标志物。尽管已有研究表明,从基线到首次重新分期或诱导治疗结束时CEA的变化,可预测接受SACT的mCRC患者的疾病控制情况和长期预后,但本研究中观察到的ctDNA早期清除与ORR、PFS和OS之间的相关性,是一项新发现,为液体活检在临床中的应用提供了支持。
在本研究中,采用了CEA清除情况,并与治疗1个月后的ctDNA转阴情况进行比较,结果显示ctDNA具有较高的敏感性和较低的特异性。然而,值得一提的是,鉴于这些生物分析物的半衰期不同,仅经过一个月的治疗,CEA清除情况可能并非最佳的评估终点,这也是本研究的一个潜在局限性。事实上,如上文所述,肿瘤标志物的变化幅度(而非完全转阴)可能更具临床参考价值。遗憾的是,该领域的大多数研究存在异质性,采用不同的治疗方案或评估时间安排,这使得跨研究比较颇具挑战。因此,研究者决定对这两种生物标志物采用相同的衡量标准(完全清除)。
尽管就ORR而言,ctDNA清除情况显示出比CEA更高的敏感性,但其特异性似乎较低。此外,无论采用何种治疗方案(单药、双联或三联化疗),在约77%的患者中观察到ctDNA出现显著变化(减少幅度>75%)。这些观察结果与在使用瑞戈非尼治疗的mCRC难治性患者中得到的类似临床发现相符,在这些患者中,经过一个月的治疗,无论长期临床结果如何,所有病例都出现了ctDNA清除情况,这可能反映了对不同抗癌疗法中控制ctDNA脱落的生物学原理的理解存在差距。
在任何将ctDNA作为评估终点的临床试验中,ctDNA检测的准确性都至关重要,而且在追求高敏感性的同时,需要优化特异性以充分发挥ctDNA在临床上的潜力。这样的障碍并非仅存在于本研究中;实际上,在接受辅助化疗的患者中,不同研究中的ctDNA清除率差异显著,范围从20%到67%不等。鉴于辅助化疗的类型和持续时间在全球范围内相对标准化,因此清除率变异性如此之大的主要原因必须归因于ctDNA检测的不同预测值。除了对不同类型检测的结果进行比较和协调外,随时间推移重复进行ctDNA分析或许可以解决其中一些方法特异性不足的问题,并且正在被纳入一系列正在进行的试验中以提高准确性。
在本研究中,纵向ctDNA监测带来了一些有趣的观察结果。实际上,早在治疗约4周时,约15%的患者就出现了临床意义不明的变异,当分析范围扩大到治疗时间超过10个月的受试者时,这些事件的发生频率在近半数患者中被观察到。在所有这些情况下,这些“异常”变异的存在或清除情况并不与其他“主要”变异、对治疗反应的影像学和临床-生化指标或治疗方案的改变相匹配。与该领域的其他研究不同,本分析并未将NGS panel的准确性与基于ddPCR的单一靶点方法的准确性进行比较;然而,在研究者看来,在很大比例的患者中出现临床意义不明的变异表明需要使用多靶点方法来可靠地追踪治疗反应,这与之前的其他观察结果相符。尽管由于样本量有限可能存在潜在的问题,但组织WES和ctDNA结果之间的比较强化了这样一个观点,即包含多种变异的广泛panel更适合临床应用。实际上,本研究的数据显示,在许多情况下,组织中高VAF的变异在液体活检中呈现相反的趋势,反之亦然,这暗示着即使对于基于组织信息的检测,同时评估多种变异可能不仅会提高检测的敏感性,还会提高其特异性。
综上所述,本研究结果证实了ctDNA在mCRC患者中的预后价值和临床效用,但同时也指出了在现实情况下数据解释中可能存在的偏差,建议采用重复确认性采样和更广泛panel的方法来克服ctDNA检测中准确性的不足。
最后,尽管ctDNA似乎是一种非常有前景的早期预测工具,但未来的研究工作应当评估基于标准和/或功能影像并结合深度学习方法的早期影像(4至6周)是否能在尽可能早地预测患者治疗反应方面与ctDNA相媲美、更优或互补,以便为那些不太可能从正在进行的治疗中获益的患者转向不同的治疗选择。
参考文献:
Ghidini M, Hahne JC, Senti C, et al. Circulating tumor DNA dynamics and clinical outcome in metastatic colorectal cancer patients undergoing front-line chemotherapy. Clin Cancer Res. Published online December 17, 2024. doi:10.1158/1078-0432.CCR-24-0924



