ACS Nano:郑州大学杨炜静/秦志海/张震中合作研究构建基于具备免疫佐剂功能纳米载体的个性化纳米疫苗用于癌症免疫治疗
时间:2025-01-27 12:09:14 热度:37.1℃ 作者:网络
肿瘤特异性T细胞在抗肿瘤免疫中起着至关重要的作用。然而,其疗效受到抗原呈递的时空协调以及树突状细胞(DC)中先天免疫反应的严重影响。
2025年1月16日,郑州大学杨炜静、秦志海、张震中共同通讯在ACS Nano在线发表题为“Personalized Nanovaccine Based on STING-Activating Nanocarrier for Robust Cancer Immunotherapy”的研究论文。该研究开发了一种简单的纳米疫苗,即双重免疫功能聚合物纳米平台(DIPNP),在DC中可同时作为STING激动剂和免疫佐剂,通过静电相互作用封装卵清蛋白(OVA)。
体外结果表明,纳米载体通过阻断聚甲基丙烯酸18-crown-6-酯(P18C6MA)介导的K+扰动级联反应与内质网应激促进干扰素调节因子3磷酸化来诱导STING激活,并通过伯胺激活Toll样受体4刺激DC成熟。体内研究表明,在B16-OVA和EG7-OVA肿瘤模型中,纳米疫苗均能显著抑制肿瘤生长,并产生长期免疫记忆反应。与程序性死亡配体-1抗体(aPD-L1)联合使用后,小鼠存活率显著延长。切除的自体原代肿瘤细胞膜修饰后,DIPNP形成个性化的纳米疫苗,在同源远端肿瘤模型中具有高抗肿瘤活性,为通过免疫功能纳米载体构建个性化纳米疫苗提供了灵感。

环二核苷酸(CDN)或2',5–3′5′环磷酸鸟苷-腺苷一磷酸(cGAMP)等激动剂可激活干扰素基因刺激剂(STING),并伴有I型干扰素介导的炎症反应和有效的抗原呈递。通过STING激活引发抗肿瘤免疫反应应用前景广阔。由于CDN、cGAMP和其他激动剂的内吞作用较差,纳米技术通常用于促进内吞和胞质递送。据报道,PC7A纳米颗粒是一种由含有叔胺的七环结构聚合物制成的纳米平台,能够形成PC7A-STING缩合物以激活STING。PC7A纳米平台的STING激活效果更强,具备一定免疫功能。类STING激动剂聚合物纳米载体在临床转化中也具有多种免疫功能和合成可行的优势。此外,内质网(ER)中的STING靶向能够引起某些细胞和细胞器应激。据报道,具有冠状结构的聚合物能够通过钾离子(K+)干扰诱导ER应力。然而,尚未有研究报道冠状结构是否也能够激活STING。
基于纳米颗粒的疫苗(nanovaccine)在癌症免疫治疗期间通过激活抗原特异性T细胞刺激宿主免疫反应,其中树突状细胞(DC)中有效的胞质抗原递送和抗原呈递尤为重要。带伯胺或叔胺聚合物的质子海绵效应能够促进纳米颗粒从内涵体/溶酶体中逃逸,并将药物递送到细胞质中。除了抗原,形成纳米疫苗的另一个重要成分是免疫佐剂。如CpG是toll样受体9(TLR-9)激动剂的佐剂,而resiquimod(R848)是TLR7/TLR8激动剂。据报道,聚合物与伯胺的纳米载体自组装能够作为免疫佐剂以促进DC成熟。因此,构建以纳米载体作为免疫佐剂同时具有逃逸功能的聚合物纳米疫苗在癌症免疫治疗中潜力巨大。
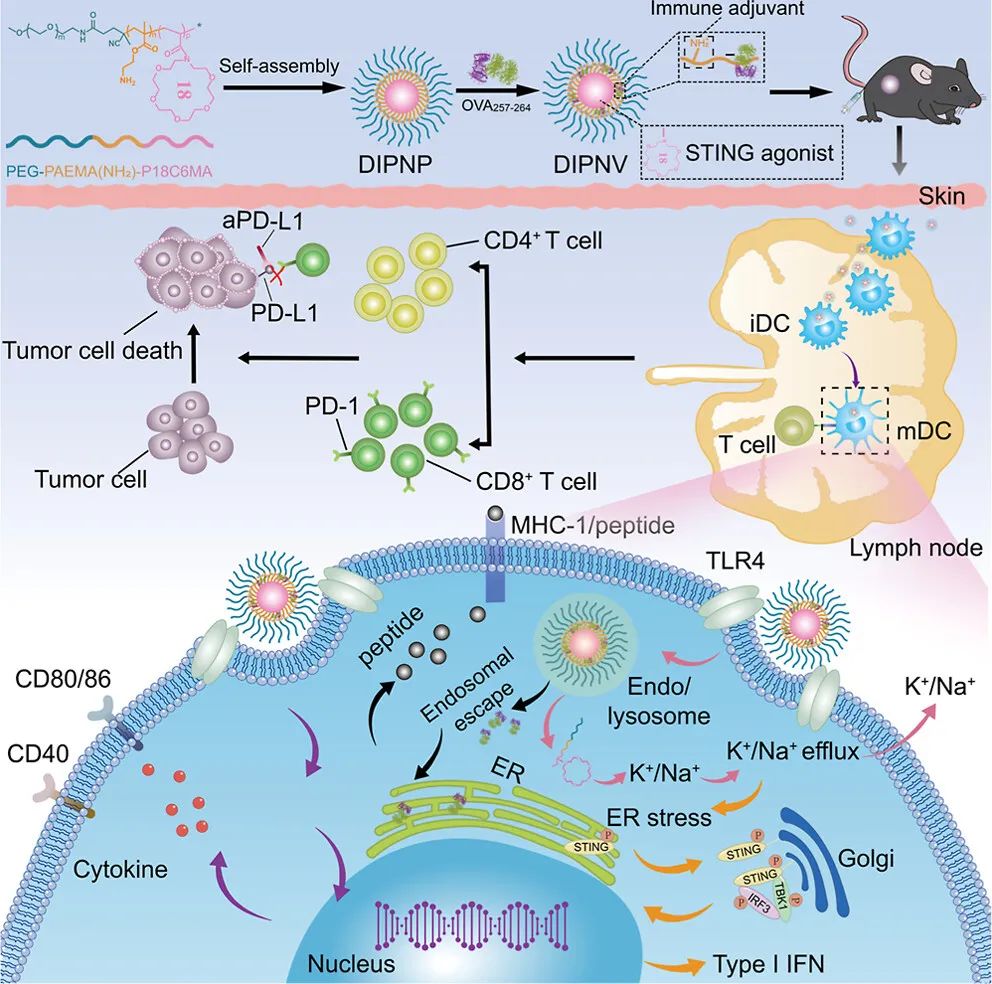
图1 DIPNV联合免疫检查点阻断在B16-OVA或EG7-OVA肿瘤模型中进行癌症免疫治疗示意图(摘自ACS Nano)
肿瘤可以通过免疫检查点通路(如程序性死亡-1/程序性死亡配体1(PD-1/PD-L1))逃避免疫监视。美国食品药品监督管理局(FDA)已批准多种免疫检查点抑制剂用于治疗恶性肿瘤。利用siRNA-PD-L1抑制PD-L1表达也可以阻断免疫检查点。然而,不同肿瘤模型的免疫反应率差异很大,选择合适的肿瘤类型在提高免疫治疗效果方面起着关键作用。在多种肿瘤类型中,黑色素瘤细胞的PD-L1表达相对较高,可通过免疫检查点阻断显著抑制肿瘤生长,而晚期激活的T细胞也会上调细胞表面的PD-1表达。因此,利用抗PD-1等免疫检查点阻断疗法与其他T细胞激活策略联合后,可以同时以高免疫反应率重新激活耗竭的T细胞。
该研究开发了一种双重免疫功能聚合物纳米疫苗(DIPNV),通过可逆加成-断裂转移(RAFT)自由基聚合和酸解NH-Boc基团自组装形成DIPNP。聚合物链中的嵌段聚甲基丙烯酸18-crown-6-酯(P18C6MA)激活STING和有效的免疫反应,且伯胺确保了其免疫佐剂的发挥,卵清蛋白(OVA)的包封和内涵体/溶酶体逃逸。体外结果表明,P18C6MA通过K+扰动介导的ER应激诱导STING激活,激活的STING蛋白立即发生构象变化,通过ER和高尔基体经自噬体转运到核外周体。该过程促使STING磷酸化,STING募集TANK结合激酶1(TBK1)表达下游干扰素调节因子3(IRF3)激活,以促进DC中I型干扰素的分泌。聚合物链中的伯胺通过TLR4促进DC成熟以及炎性小体分泌,进一步推动了纳米疫苗的形成和用OVA封装后的抗原交叉呈递。体内研究表明,多功能纳米疫苗在B16-OVA和EG7-OVA肿瘤模型中都引发了强大的宿主免疫反应,表现出明显的肿瘤生长抑制和长期免疫记忆反应。与aPD-L1联合使用后,抗肿瘤活性显著提高,中位生存期延长。肿瘤细胞膜包裹纳米载体后形成个性化纳米疫苗(DIPNP@M),其在原发肿瘤术后同源远端肿瘤模型中与aPD-L1协同作用,显示出高抗肿瘤功效。该研究提供了一种基于DIPNP的策略,在癌症免疫治疗方面前景广阔。
参考消息:
https://pubs.acs.org/doi/10.1021/acsnano.4c11014


