【论肿道麻】Nat Rev Mol Cell Biol:抗氧化在健康和疾病中的作用机制
时间:2024-12-15 16:01:55 热度:37.1℃ 作者:网络
生物体内产生多种活性氧(reactive oxygen species, ROS),在生理功能和疾病发展中扮演角色。氧化损伤可能是疾病的原因,更可能是疾病的结果。抗氧化防御网络通过调节ROS水平发挥作用并减少氧化损伤。新加坡国立大学的Barry Halliwell教授是开创性研究自由基理论的专家,是科睿唯安(Clarivate)2021年年度引文桂冠奖(Citation Laureate)得主。2024年1月3日,他在Nature Reviews Molecular Cell Biology杂志上(IF:81.3)发表题为《Understanding mechanisms of antioxidant action in health and disease》的综述,这篇自由基领域的最新综述非常有助于我们了解世界顶级学者对自由基生物医学的最新观点和这一领域的最新进展。在文章中,Halliwell教授阐述了以活性氧(ROS)为代表的促氧化剂与抗氧化剂在体内的平衡,探讨体内合成、饮食来源及合成抗氧化剂的作用机制及其在正常生理与病理中发挥的作用;并强调了目前相关知识与研究的空缺。Halliwell教授指出,虽然人们在上百种疾病发现ROS等的异常变化,但是活性氧并不一定起驱动作用,有些时候还通过触发内源机体保护机制等途径来发挥积极作用;目前也很少有抗氧化药物展示积极的临床效果,即使有效果的几种也没有充分证据支持就是通过抗氧化发挥功能。下面为大家简单介绍抗氧化在健康和疾病中的作用机制。

一、背景介绍
自由基活性氧概述
体内产生的几种活性氧(ROS)被广泛定义为含有氧原子但比氧气本身更具反应性的分子。一些ROS是自由基,含有一个或多个未配对电子的原子或分子,即单独占据原子或分子轨道的电子;而另一些是非自由基,其所有电子都成对。一些ROS是偶然产生的,例如,通过自动氧化反应和电子传输链中电子的泄漏;而另一些ROS则是生物细胞主动产生的,以支持防御病原体和信号转导等重要过程。
ROS密切参与需氧生命过程的各个方面,从精子功能和卵子受精到胎盘的形成、胚胎发育/组织重塑、出生以及器官包括大脑的生长和发展。特别指出,婴儿从宫腔低氧过渡到空气环境中21%氧气时发生的超氧应激,导致ROS产生增加。
这篇综述重点介绍了抵消ROS的抗氧化剂,探讨了抗氧化剂的含义、不同类型、作用机制、生理学和病理学重要性、目前对上述内容的理解差距以及如何填补这些差距。此外,文章对天然和合成抗氧化剂在治疗或预防疾病方面的成功和失败之处及原因也进行了深入探讨。
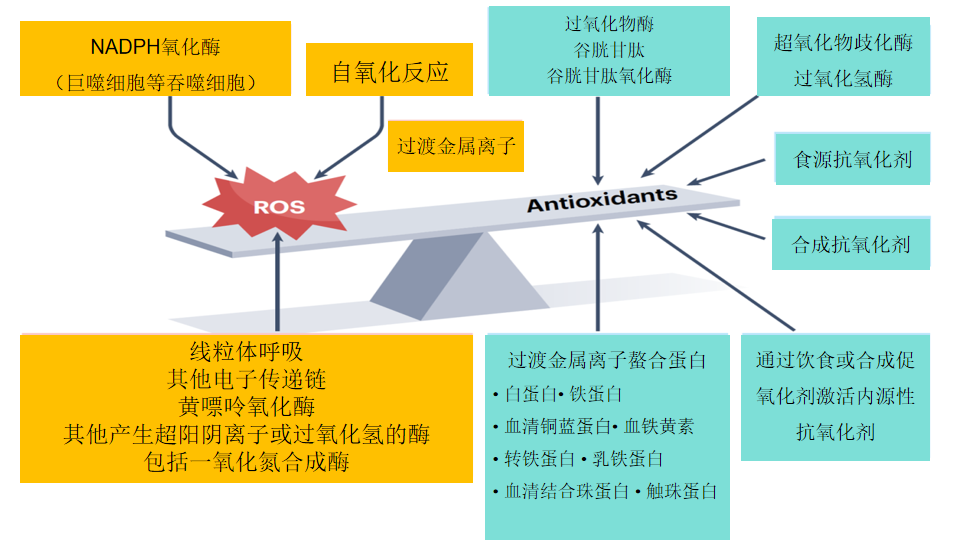
图1.体内活性氧和抗氧化剂平衡
二、抗氧化剂的定义和特性
本节描述了抗氧化剂的定义、存在的类型及其作用机制。
2.1 抗氧化剂的定义
2022年的共识声明提出了抗氧化剂的两种定义:(1)任何延迟、预防或消除目标分子氧化损伤的物质;(2)与氧化剂反应以调节其与其他目标的反应,从而影响氧化还原依赖的生物信号传导途径和/或氧化损伤的物质。第二个定义更全面,强调了ROS的生理作用。尽管修复氧化损伤对健康重要,但不同抗氧化剂在不同细胞、亚细胞和细胞器内以不同速率与不同ROS反应,保护不同分子靶标。另有“促氧化剂”一词,指刺激目标分子氧化损伤的化合物。
2.2 抗氧化剂的类型
抗氧化剂在人体内可自行产生、从饮食中获取或作为合成分子用于治疗疾病。前两者构成“抗氧化防御网络”,由Lester Packer提出。ROS在信号传导和抵御病原体中有生理作用,但也会损伤生物分子。抗氧化防御网络调节ROS水平以平衡其作用和损伤,特别是通过过氧化物酶调控H2O2水平。抗氧化防御因个体、组织、细胞类型及性别差异而异,女性内源性抗氧化剂水平通常高于男性,可能与寿命相关。尽管抗氧化防御不完全去除ROS,氧化损伤仍持续发生。修复氧化DNA对阻止癌症等疾病发展至关重要,而氧化脂质、RNA和蛋白质通常通过泛素-蛋白酶体系统处理。修复系统效率下降会导致氧化损伤增加,尤其在衰老和疾病如痴呆症中。
2.3 抗氧化剂的作用机制
抗氧化剂的作用机制包括以下几个方面:
(1)催化去除ROS的酶。
(2)通过结合或以非氧化还原活性形式储存铁离子、铜离子、血红素和含血红素蛋白质,减少氧化剂的可用性。
(3)物理性的ROS“猝灭剂”,例如类胡萝卜素从单线态氧中移除多余的能量,并将单线态氧转化回正常氧分子。
(4)“牺牲剂”优先与ROS反应,保护重要生物分子。有时,牺牲剂的氧化形式可通过酶回收为原始化合物,如谷胱甘肽还原酶将GSSG还原为GSH。否则,它们被破坏后需重新合成或通过饮食补充。
(5)亚细胞定位过渡金属离子氧化剂。细胞或组织结构的破坏会加速氧化损伤(尤其是在大脑中),部分原因是金属离子从其正常的受限位置释放到细胞的其他部分。
(6)生活方式改变和生物体策略可减少ROS产生。线粒体通过解偶联蛋白(UCP1、UCP2、UCP3)调节ROS生成,电子载体组装成复合物减少电子泄漏和降低胞内氧浓度。抗氧化策略包括减少氧气暴露,人类血管系统提供适量氧气以避免损伤。一些干细胞在缺氧环境中保持低氧化损伤,某些细胞改变膜脂质或用耐ROS酶替代敏感酶增强抗氧化能力。
2.4 内源性抗氧化剂的产生
抗氧化剂防御网络主要依靠酶来催化去除ROS。酶通过处理多个ROS底物在体内发挥重要作用,敲除或抑制这些酶会导致显著表型变化。例如,敲除MnSOD会产生严重表型,显示过多的线粒体O2•−会造成损害。特定分子如铁蛋白和转铁蛋白通过隔离过渡金属离子来防止氧化损伤。牺牲性抗氧化剂如白蛋白和GSH则通过与ROS反应消耗自身,需定期补充或回收。内源性抗氧化剂的活性受多层次调节控制,水平随时间变化,尤其是GSH和过氧化氢酶。当生物体暴露于高水平ROS时,抗氧化剂防御水平会增加。
2.5 饮食来源的抗氧化剂
许多饮食分子在体外表现出抗氧化特性,被认为在体内也很重要,如维生素E、抗坏血酸、类胡萝卜素和多酚等。研究表明,这些化合物的高浓度与降低疾病风险有关,如心血管疾病、糖尿病和某些癌症。抗坏血酸和维生素E(尤其是α-生育酚)对人体必需,尽管每日需求量尚不确定,但在不同国家估计分别为60-200毫克/天和约15毫克/天。低摄入量与氧化损伤增加有关,而高摄入量未必显著降低损伤。尽管富含抗氧化剂的补充剂流行,其健康效益尚不确定。
2.6 胃肠道内的抗氧化剂
膳食中的抗氧化剂在胃肠道中发挥重要作用,影响身体其他部位,尤其是大脑。富含水果、蔬菜和谷物的饮食可提高体内类胡萝卜素、生育酚等抗氧化物水平,这些物质能清除活性氧(ROS)并保护胃肠道免受促氧化剂的损害,如防止DNA损伤引发的胃肠道癌症。抗氧化剂如黄酮类和类胡萝卜素能清除由亚硝酸盐和胃酸反应产生的有害物质。某些饮料中的过氧化氢与过渡金属离子反应生成有害的羟基自由基(OH•),但抗坏血酸和多酚类物质能清除这些自由基,并结合金属离子以降低其生成能力。肉类中的血红素蛋白质可作为促氧化剂,与过氧化物反应产生有害的高价铁物种,抗坏血酸和谷胱甘肽可清除这些物种。膳食抗氧化剂能阻止食物中的细胞毒性脂质氧化产物对细胞的损害。在胃肠道中,抗坏血酸、谷胱甘肽和维生素E被吸收,而未完全吸收的类胡萝卜素和多酚类在结肠中代谢生成有益分子,改善大脑和血管功能,并影响肠道菌群组成。多酚类和类胡萝卜素的降解产物可激活NRF2系统,提高抗氧化水平。谷胱甘肽被肠道细菌吸收,可能与人类肠粘膜的谷胱甘肽转运蛋白竞争,尽管其对细菌和宿主的重要性尚不明确,但可能有助于保护细菌免受ROS影响。此外,谷胱甘肽可能预防结肠癌的发生。胃肠道还可能提供具有抗氧化活性的反应性硫物质。
2.7 作为药物的合成抗氧化剂
为了治疗疾病,已开发出多种具有体外抗氧化活性的合成化合物,包括重组SOD、过氧化氢酶、氮氧自由基、铁离子螯合剂、氘化PUFAs、硫醇及ROS生成酶抑制剂。这些化合物通过不同机制减缓脂质过氧化和抑制ROS生成。此外,一些药物如四环素、水杨酸、普罗布考、丙泊酚、吡哆醇胺和曲格列酮等也被认为具有抗氧化作用,但相关证据有限,未作深入讨论。
2.8 建立体内抗氧化能力
评估膳食化合物的抗氧化作用需考虑其体内浓度是否足够有效清除活性氧(ROS)。例如,硫化氢和褪黑素在体内水平下无法有效清除ROS,而抗坏血酸在体液中的浓度和反应速率足以清除多种ROS。然而,清除ROS不一定有益,可能产生有毒副产物。通过生物标志物评估化合物是否减少体内氧化损伤是关键。2022年共识声明确定了DNA、RNA、蛋白质和脂质氧化损伤的生物标志物。研究表明,推荐膳食水平的α-生育酚可防止脂质过氧化,而高剂量抗坏血酸、多酚或麦角硫因的全身抗氧化作用证据薄弱。抗坏血酸作为酶辅因子的重要性可能超过其清除ROS的作用。在细胞培养或癌症患者体内,抗坏血酸可能成为促氧化剂。生物标志物有局限性,只能测量体液或少数组织,无法反映全身情况。例如,抗坏血酸在呼吸道清除氧化性污染物的效果可能无法通过血浆或尿液检测。组织损伤可能上调麦角硫因转运蛋白,导致局部积聚,未必影响全身生物标志物。胃肠道中的抗氧化或促氧化作用也可能无法通过传统生物标志物检测。
2.9 总抗氧化能力
测量化合物清除ROS的速度最好使用体内存在的ROS。实验室可生成多种自由基以测量反应速率,但市面上有检测系统声称能测量食品或体液的“总抗氧化能力”(TAC),即清除合成自由基的能力。TAC常用于比较不同食品和饮料的抗氧化能力,但其结果不反映体内抗氧化酶的作用,且体外结果不一定适用于体内。不同方法可能导致不同结果,有些物质虽在TAC检测中表现出抗氧化作用,但可能有毒。因此,不建议将TAC作为健康指标。然而,TAC在筛选新型抗氧化剂方面有价值,可用于鉴定潜在的治疗剂、食品防腐剂和化妆品。
三、使用抗氧化剂预防和治疗人类疾病
这部分总结了抗氧化剂在疾病治疗中的成功与失败经验及原因。
3.1 ROS在人类健康和疾病中的作用
抗氧化剂用于预防或治疗疾病存在复杂性,因ROS在疾病中有双重角色。抗氧化防御可预防癌症,但在癌症患者中使用抗氧化剂可能无效甚至有害。相反,旨在抑制肿瘤而非促进肿瘤的抗氧化剂方法已被建议作为治疗癌症的方法。抗氧化剂在神经退行性疾病中有潜力,但需平衡ROS的有益作用,如大脑中调节血压、学习和记忆等。ROS在心脏功能中也有重要作用,尽管过量可能导致损伤。因此,治疗时需谨慎平衡ROS与抗氧化防御。
3.2 膳食抗氧化剂作为治疗剂
许多临床试验使用高剂量膳食抗氧化剂(如维生素C、E和β-胡萝卜素)尝试延缓疾病进展,如痴呆症和心血管疾病,但结果多为负面。高剂量α-生育酚对痴呆症的效果不一致,甚至可能有害。尽管心血管疾病结果不理想,但某些糖尿病患者可能受益。Hp2–2型血红蛋白的抗氧化效果较差,可能影响α-生育酚的作用。对癌症风险人群,抗氧化补充剂的使用存在争议,尤其是吸烟者应避免β-胡萝卜素。抗氧化剂可能影响癌症治疗效果,动物研究显示某些抗氧化剂可能加速癌症进程。
3.3 抗氧化剂无效的原因
抗氧化剂在疾病治疗中的效果有限,可能因为氧化损伤并非某些疾病的关键因素。氧化应激常见于多种疾病,但可能是结果而非原因。ROS的增加可由多种机制引发,且可能激活内源性抗氧化防御,保护组织。清除ROS有时反而加重病情,如心脏缺血-再灌注和某些自身免疫疾病中,ROS可抑制淋巴细胞活动。真实的抗氧化治疗可能导致副作用,如增加感染风险和破坏ROS依赖的信号传导。运动引发ROS,但促进抗氧化防御的适应性反应,补充维生素E或C可能削弱此反应,效果不一。在良好饮食中,抗氧化补充剂对运动表现改善有限。抗氧化剂的复杂作用和潜在副作用提醒我们需谨慎使用。
3.4 活性氧和抗氧化剂在痴呆中的作用
ROS在多种疾病如辐射损伤、铁过载、白内障、高血压、糖尿病、心血管疾病、某些癌症和神经退行性疾病如痴呆中起重要作用。证明ROS的关键作用需满足四个标准:氧化损伤在损伤部位可检测,时间过程一致,ROS应用再现损伤,清除ROS减少损伤。以阿尔茨海默病为例,证据显示大脑氧化损伤在疾病早期增加。动物模型中,抗氧化剂减缓病情,但在人类中效果有限。开发能透过血脑屏障的抗氧化剂如麦角硫因值得关注。
四、人工合成抗氧化剂
这部分总结了为治疗人类疾病而开发的合成抗氧化剂。
4.1 合成抗氧化剂简介
许多合成抗氧化剂已进入临床试验,包括髓过氧化物酶抑制剂、GSH前体、NADPH氧化酶抑制剂等。试验结果不一,有些未显示疗效,有些显示有益但需更多数据。关键问题是这些抗氧化剂是否通过减少氧化损伤或其他机制起作用。临床上证明有用的合成抗氧化剂包括依布硒、衣达拉奉和NAC,需进一步研究其作用机制。
4.2 依布硒
依布硒是GPx的酶模拟物,具有提高NRF2水平、清除过氧亚硝酸盐等作用。临床试验显示依布硒可改善中风患者的结果,但其疗效是否源于抗氧化活性尚不确定,因为试验中很少测量氧化损伤的生物标志物。依布硒类似物ALT-2074正在用于糖尿病和冠状动脉疾病的试验中,但需要更多研究来确定其具体作用机制。
4.3 衣达拉奉
衣达拉奉用于治疗中风和肌萎缩侧索硬化症,效果适中。尽管最初作为ROS清除剂开发,但其在体内的实际作用机制不明。由于OH•在形成位置反应,衣达拉奉可能无法有效拦截OH•。其化学结构未显示特别高的ROS清除活性,且缺乏氧化损伤测量数据。衣达拉奉与右旋龙脑醇组合在中风试验中效果更佳。
4.4 N-乙酰半胱氨酸
NAC用于治疗对乙酰氨基酚中毒和作为粘液溶解剂。尽管常被视为抗氧化剂,其主要作用可能在于通过提供半胱氨酸维持GSH水平,而非直接清除ROS。NAC在某些动物模型中加剧癌症发展,可能通过影响信号传导或与脂质过氧化产物反应。其作用机制复杂,不应简单视为ROS清除剂,需更多研究验证其在不同生物系统中的具体作用。
五、提高内源性抗氧化水平
由于抗氧化酶及其dc辅因子如GSH在最小化氧化损伤方面尤其重要,另一种抗氧化疗法是使用能够增加体内它们活性的试剂。
5.1 调节内源性抗氧化剂活性的机制
体内多种系统调节抗氧化剂水平,NF-κB响应压力增加基因转录,导致ROS产生增加。NF-κB激活增加ROS和某些急性期蛋白,部分具有抗氧化特性。AP-1、NRF2、p53和FOXO等转录因子调节抗氧化剂水平。p53与ROS的关系复杂,正常低p53活性防止癌症,而过多ROS抑制p53功能。FOXO调节代谢和抗应激,增加抗氧化酶表达。SIRT酶去乙酰化增加MnSOD活性,SIRT酶激动剂延长生物寿命,但在人类中效果不确定。
5.2 激活NRF2系统
NRF2通路是体内控制抗氧化防御的关键系统,与PGC-1α、FOXOs、p53和NF-κB相互作用。NRF2信号进化帮助海洋脊椎动物适应陆地生活。NRF2和NF-κB的相互作用影响基因转录和翻译后修饰。NRF2依赖性基因转录增加可能是氧化应激标志。阿尔茨海默病患者NRF2水平降低,增加氧化损伤。萝卜硫素增加小鼠模型中NRF2水平,减少氧化损伤和淀粉样物质积累。依达拉奉、Ebselen和ergothioneine可激活NRF2,但证据不足以证明其降低体内氧化损伤。
5.3 影响NRF2的饮食化合物
几种饮食化合物如姜黄素、sulforaphane等在细胞和动物实验中增加NRF2依赖性基因转录。这些化合物通过与keap1蛋白结合失活来影响NRF2。然而,通常饮食中吸收不足,且快速代谢,可能无法显著影响体内NRF2活性,但可能保护胃肠道细胞免受氧化损伤。高剂量的这些化合物已在临床试验中用于治疗多种疾病,但其有效性仍不明确。5.4 合成化合物影响NRF2:二甲基呋喃甲酰胺(DMF)被用于治疗多发性硬化症,通过失活keap1提高NRF2水平。尽管其机制不完全清楚,但在小鼠模型中显示了NRF2途径的激活。其他合成化合物如bardoxolone methyl和omaveloxolone也被研究,但存在安全性问题。
5.4 合成化合物影响NRF2
二甲基呋喃甲酰胺(DMF)被批准为复发性多发性硬化症的首选治疗,通过失活keap1提高NRF2水平。尽管DMF在小鼠模型中显示了NRF2途径的激活,其具体机制仍不明确。合成化合物bardoxolone methyl在临床试验中用于治疗慢性肾脏病和2型糖尿病,但因安全问题试验停止。另一种三萜类化合物omaveloxolone则被FDA批准用于弗里德赖希共济失调症,但效果有限。需要更多研究进一步探索更安全、特异的NRF2调节方法。
5.5 与增加NRF2活性相关的一些注意事项
NRF2的过度激活可能干扰ROS的生理作用,导致不良后果。缺乏keap1的小鼠因NRF2持续活跃而早夭,提示潜在风险。在增强NRF2时需谨慎,尤其是吸烟者或癌症高风险者,因为NRF2可能保护肿瘤免受氧化应激,削弱治疗效果,特别是在肺癌中。
六、结论和未来展望
氧化损伤与多种年龄相关疾病如痴呆、眼疾、癌症和心血管疾病有关。尽管抗氧化剂在预防和治疗这些疾病中的应用仍存在争议,现有数据显示补充饮食或合成抗氧化剂的效果有限。部分药物如DMF、依布硒和衣达拉奉显示出一定效果,但其机制尚不明确。开发能减少特定生物分子氧化损伤而不干扰ROS生理作用的抗氧化剂是关键。
生活方式改变被认为是有效的抗氧化“疗法”,包括运动、控制体重、血糖和胆固醇,以及摄入富含水果、蔬菜和谷物的饮食。这些措施可能通过降低ROS产生来促进健康,但许多饮食化合物的系统性作用不明显,可能只在特定部位有效或通过其他途径发挥作用。富含抗氧化剂的饮食可降低多种疾病风险,但其益处未必完全归因于抗氧化剂。良好饮食支持抗氧化防御网络,包括锰、铁、铜、锌等元素和相关酶的作用。
个体对氧化损伤和抗氧化剂反应差异显著,受饮食和遗传因素影响。吸烟增加氧化损伤标志物浓度,但个体差异很大,部分吸烟者与非吸烟者的标志物浓度重叠。个体化的抗氧化策略可能更为有效。研究抗氧化剂对疾病的影响时,常忽略ROS的来源、目标及其特定影响,氧化损伤具有特异性,如帕金森病中的鸟嘌呤损伤和阿尔茨海默病中的蛋白质氧化。膳食抗氧化剂在体内的分布和作用机制尚不明确,阻碍了研究。动物研究结果可能不适用于人类。
活性硫物种(RSS)如H2S在体内的抗氧化作用尚未完全确立,但其潜力值得研究。
综上所述,需深入研究抗氧化剂在分子水平上的作用机制及RSS的潜力,明确其在疾病防治中的有效性。
论肿道麻 述评
Barry Halliwell在其发表的综述文章《Understanding mechanisms of antioxidant action in health and disease》中,深入探讨了抗氧化剂在维护健康和疾病治疗中的关键作用。文章首先概述了活性氧(ROS)的生成机制及其在人类疾病中的双重作用,进而详细讨论了抗氧化剂如何通过调节ROS水平来平衡生理功能与氧化损伤。Halliwell清晰地定义了抗氧化剂,并根据其来源和作用机制进行了分类,包括体内合成的抗氧化剂、饮食来源的抗氧化剂以及合成抗氧化剂。文章特别强调了抗氧化剂防御网络在调节ROS水平中的重要性,以及这一网络如何影响个体、组织和细胞类型的抗氧化剂水平差异。此外,文章还探讨了抗氧化剂在胃肠道中的作用,以及它们如何通过影响肠道菌群和提升NRF2系统来增强机体的抗氧化能力。
Halliwell在综述中不仅总结了抗氧化剂在预防和治疗人类疾病中的成功与失败案例,还提出了未来研究方向,包括开发针对特定疾病病理的抗氧化剂。文章的结论部分强调了抗氧化剂在延缓衰老相关疾病,如痴呆、眼病和心血管疾病中的潜力,并提出了通过健康生活方式来提升内源性抗氧化剂水平的观点。
文章的述评部分,我们可以认为Halliwell的综述为抗氧化剂的研究领域提供了一个全面的视角,不仅涵盖了基础的生物化学机制,还涉及了临床应用和个体化治疗策略。文章的深度和广度使其成为该领域研究者和临床医生的重要参考资料。然而,文章也提示了抗氧化剂研究中的复杂性和挑战,尤其是在抗氧化剂的临床效果方面,许多研究结果并不一致,这可能与抗氧化剂的剂量、给药时间以及个体差异有关。因此,未来的研究需要更加精确地理解抗氧化剂的作用机制,并开发出更有效的抗氧化剂,以实现在特定疾病中的靶向治疗。总的来说,Halliwell的综述不仅为抗氧化剂的研究提供了坚实的理论基础,也为未来的研究方向指明了道路。
参考文献:
Halliwell, Barry. “Understanding mechanisms of antioxidant action in health and disease.” Nature reviews. Molecular cell biology vol. 25,1 (2024): 13-33. doi:10.1038/s41580-023-00645-4


