南方医科大学Science子刊:生物模拟皱褶型益生元微球用于慢性肾病高磷血症和血管钙化的治疗
时间:2025-01-23 12:10:12 热度:37.1℃ 作者:网络
对于慢性肾病(CKD)患者来说,迫切需要开发一种稳健且简便的治疗方法,以有效控制血清磷水平和合理调节肠道菌群,旨在预防心血管钙化并减少心血管并发症。本研究中,南方医科大学侯鸿浩/邱小忠/王国保受到肠道微结构的启发,开发了一种具有增强的肠道保留和吸收能力的仿生皱纹型益生元微球,用于减轻CKD模型大鼠的高磷血症和血管钙化。所得的CSM@5微球在体外展示了良好的磷结合能力,并能有效降低体内磷的血清浓度。通过增加有益菌群和减少有害菌群,这些益生元微球能够调节肠道菌群,进而显著改善血管钙化。这种可行且稳健的方法可能为治疗CKD的高磷血症及其心血管并发症提供一种潜在有效的策略。该研究以题为“Biomimetic wrinkled prebiotic microspheres with enhanced intestinal retention for hyperphosphatemia and vascular calcification”的论文发表在《Science Advances》上。

图1展示了生物模拟肠道皱褶型益生元微球(CSM@5)的制备过程及其在慢性肾病(CKD)模型中的应用机制。通过微流体技术制备的CSM@5微球,利用层层自组装(LBL)技术在其表面涂覆银纳米颗粒(Ag NPs),并采用酸膨胀/碱脱膨胀方法形成模拟肠道微环境的表面皱褶结构。这种结构不仅增强了微球的吸附能力,还延长了其在肠道中的滞留时间。实验结果表明,CSM@5微球能够有效减少肠道中磷的吸收,增加有益菌数量,减少有害菌数量,并显著改善血管钙化。
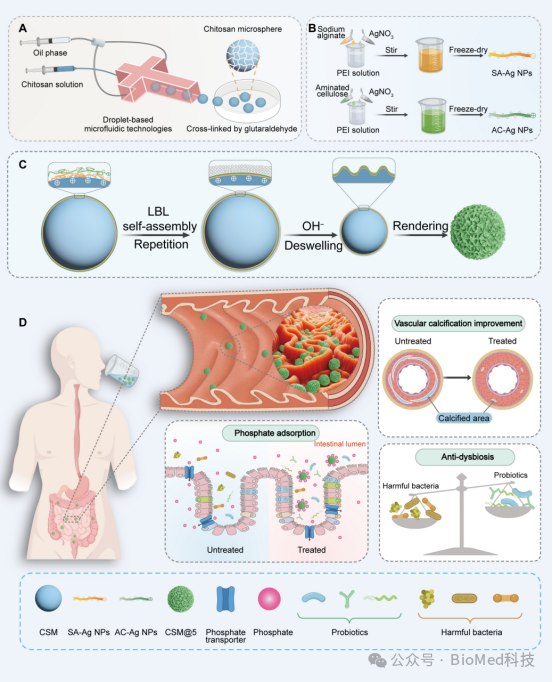
图 1. 生物模拟肠道皱褶型益生元微球CSM@5的制备及应用示意图
【通过微流体技术制备壳聚糖益生元微球(CSMs)的过程】
图2展示了通过微流体技术制备壳聚糖益生元微球(CSMs)的过程及其尺寸调控特性。研究通过调节水相与油相的流速比(w:o),成功制备出不同直径的均匀CSMs微球,并观察到其在酸性条件下膨胀和在碱性条件下收缩的pH响应行为。实验结果表明,当流速比为1:18时,微球的膨胀和收缩率最高,表现出对pH变化的最显著响应,因此被选为后续实验的最优条件。这一结果表明,微流体技术能够精确调控CSMs的尺寸和性能,为其在肠道微环境中实现高效吸附和干预提供了基础。
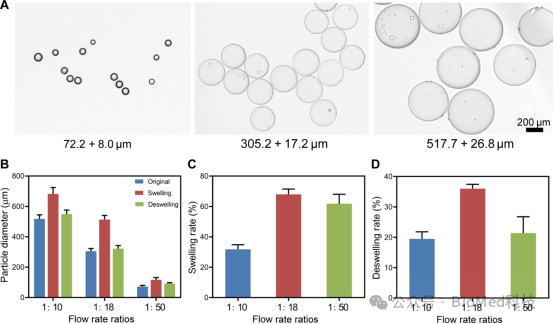
图 2.通过微流体技术制备壳聚糖益生元微球(CSMs)的过程
【通过层层自组装技术和酸膨胀/碱脱膨胀法制备CSM的表面皱褶微结构】
图3展示了通过层层自组装(LBL)技术和酸膨胀/碱脱膨胀方法制备的具有表面皱褶微结构的CSM@5微球的制备过程及其表征结果。研究通过在CSM表面交替组装带负电的海藻酸钠-银纳米颗粒(SA-Ag NPs)和带正电的氨基纤维素-银纳米颗粒(AC-Ag NPs),并经过酸碱处理,成功构建了模拟肠道微环境的表面皱褶结构。扫描电子显微镜(SEM)观察显示,CSM@5表面形成了均匀分布的皱褶,且随着LBL组装次数的增加,皱褶结构逐渐扩展并紧密排列,显著增加了微球的比表面积。此外,CSM@5在模拟胃肠液中展现出良好的稳定性,即使经过24小时的浸泡,其表面的皱褶结构仍能保持完整。这一结果表明,通过LBL技术和酸碱处理构建的表面皱褶结构不仅增强了微球的吸附性能,还提高了其在胃肠环境中的稳定性。
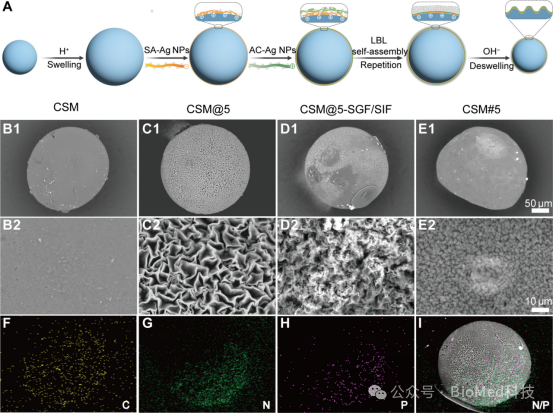
图3. 通过层层自组装技术和酸膨胀/碱脱膨胀法制备CSM的表面皱褶微结构
【CSMs的表征分析】
图4展示了通过X射线光电子能谱(XPS)、傅里叶变换红外光谱(FTIR)和热重分析(TG)对CSM和CSM@5微球的表征结果,并研究了CSM@5的磷酸盐吸附性能。XPS分析确认了CSM@5表面成功引入了银纳米颗粒(Ag NPs),并揭示了AC、SA和Ag NPs之间的电静力、氢键和配位相互作用。FTIR光谱进一步证实了SA-Ag NPs和AC-Ag NPs的存在,以及它们与CSM表面的紧密结合。热重分析显示CSM@5的残余质量增加,表明Ag元素的存在,且其热分解温度低于未修饰的CSM,推测是由于Ag NPs的催化作用。此外,CSM@5在体外表现出优异的磷酸盐吸附能力,随着层层自组装次数的增加,吸附能力显著提升。即使在模拟胃肠液处理后,其吸附性能仍保持稳定,且在不同pH条件下均优于临床常用的司维拉姆。吸附动力学实验表明,CSM@5在初始2小时内快速吸附磷酸盐,并在5-6小时达到吸附平衡,符合生理消化模式。此外,CSM@5的膨胀率显著低于司维拉姆,表明其在胃肠道中引起的不适感可能更小。
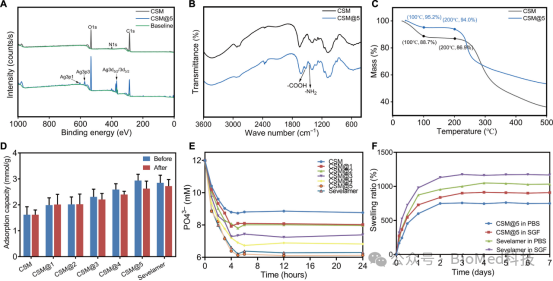
图 4.CSMs的表征分析
【CSMs的体外生物相容性研究】
图5展示了制备的壳聚糖益生元微球(CSM)及其衍生微球(CSM@5)的体外生物相容性研究。实验采用活/死细胞染色和细胞计数试剂盒(CCK-8)检测了CSM和不同浓度的CSM@5对人肾小管上皮细胞(HK-2)和人结肠癌细胞(Caco-2)的细胞活性影响。结果显示,细胞在与CSM和CSM@5共培养的条件下,其数量和活性随时间稳步增加,细胞存活率高,且不同处理组之间无显著差异。这表明CSM@5在广泛浓度范围内具有良好的生物相容性,无细胞毒性。
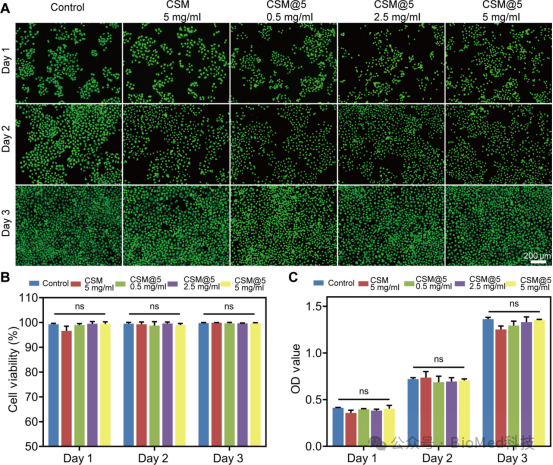
图5. CSMs的体外生物相容性研究
【CSM@5对CKD和高磷血症大鼠的剂量优化研究】
图6展示了CSM@5微球对慢性肾病(CKD)和高磷血症大鼠模型的剂量优化研究。实验通过腺嘌呤诱导建立CKD和高磷血症大鼠模型,并在不同时间点检测血清肌酐、磷和粪便磷的水平以评估模型成功与否。结果显示,模型组大鼠在腺嘌呤给药2周后血清肌酐和磷水平显著升高,4周后进一步增加,表明模型构建成功。随后,不同剂量的CSM@5微球(0.05、0.1、0.15和0.2 g/kg)被用于评估其体内磷酸盐结合能力。结果表明,CSM@5-0.15和CSM@5-0.2组在给药2周后血清磷水平显著下降,并在4周后进一步降低,而粪便磷水平显著增加,表明CSM@5通过增加肠道磷排泄有效降低了血清磷水平。此外,CSM@5-0.15组的尿磷水平显著下降,进一步证实了其通过肠道干预减少磷吸收的作用机制。综合考虑,CSM@5-0.15被认为是最佳剂量,为后续研究提供了依据。
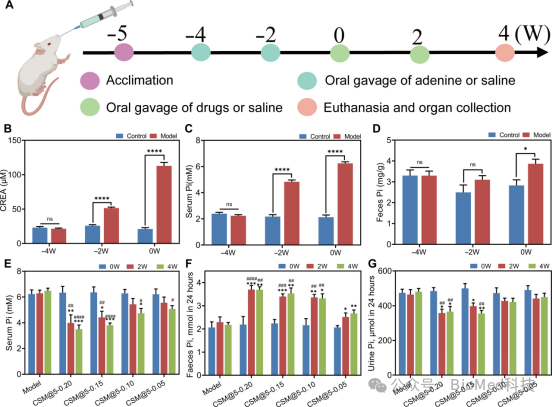
图6. CSM@5对CKD和高磷血症大鼠的剂量优化研究
【CSM@5对CKD和高磷血症大鼠的磷和钙水平的影响】
图7展示了制备的CSM@5微球对CKD和高磷血症大鼠体内磷和钙水平的影响。实验通过对比不同处理组(包括CSM、CSM@5、CSM#5和司维拉姆碳酸盐)在给药2周和4周后的血清磷、粪便磷和尿磷水平,评估了CSM@5的体内磷酸盐结合能力。结果显示,CSM@5-0.15组和司维拉姆碳酸盐组均能显著降低血清磷水平并增加粪便磷排泄,表明CSM@5具有与临床常用磷酸盐结合剂司维拉姆相当的磷酸盐结合效果。此外,CSM@5-0.15组的尿磷水平显著下降,进一步证实了其通过增加肠道磷排泄来降低血清磷的作用机制。在钙水平方面,CSM@5-0.15和司维拉姆碳酸盐组对尿钙水平有一定影响,但对血清和粪便钙水平无显著影响。这些结果表明,CSM@5微球在降低血清磷水平的同时,不会显著影响钙代谢,且可能减少胃肠道不适,是一种潜在的高磷血症治疗选择。

图7. CSM@5对CKD和高磷血症大鼠的磷和钙水平的影响
【CSM@5对CKD和高磷血症大鼠的脂质代谢、FGF-23和PTH水平以及主动脉钙化的影响】
图8展示了制备的CSM@5微球对CKD和高磷血症大鼠的脂质代谢、FGF-23和PTH水平以及主动脉钙化的影响。研究发现,CSM@5处理组大鼠的血清总胆固醇水平未显著变化,但高密度脂蛋白(HDL)水平显著升高,低密度脂蛋白(LDL)水平显著降低,这可能有助于减轻血管钙化。此外,CSM@5显著降低了血清中成纤维细胞生长因子23(FGF-23)和甲状旁腺激素(PTH)的水平,这两种因子与CKD患者的血管钙化和心血管事件密切相关。主动脉钙化染色结果显示,CSM@5处理组大鼠的主动脉钙化面积显著减少,且内膜断裂现象减少,表明CSM@5在抑制血管钙化方面优于传统磷酸盐结合剂司维拉姆碳酸盐。这些结果表明,CSM@5微球不仅通过调节磷代谢改善高磷血症,还通过调节脂质代谢和降低FGF-23与PTH水平,显著减轻CKD大鼠的血管钙化。

图8. CSM@5对CKD和高磷血症大鼠的脂质代谢、FGF-23和PTH水平以及主动脉钙化的影响
【CSM@5对肠道微生物群的调节作用】
图9展示了CSM@5微球对CKD和高磷血症大鼠肠道微生物群的调节作用。通过16S rDNA测序技术分析不同处理组大鼠的肠道微生物组成,结果显示CSM@5处理组的微生物群落与健康对照组更为相似,表明其对维持肠道微生物平衡具有积极作用。具体而言,CSM@5显著增加了有益菌(如Lactobacillaceae和Bifidobacteriaceae)的相对丰度,同时减少了与炎症相关的有害菌(如Staphylococcaceae)。此外,CSM@5处理组的肠道微生物多样性(通过Simpson和Shannon指数评估)显著高于模型组,且与司维拉姆碳酸盐相比,CSM@5在调节肠道微生物群落结构方面表现出更显著的优势。这些结果表明,CSM@5微球通过增加有益菌和减少有害菌的丰度,改善了CKD大鼠的肠道微生物群落结构,进而可能通过调节肠道微生态来减轻高磷血症和血管钙化,为慢性肾病的治疗提供了新的微生物学机制。

图9. CSM@5对肠道微生物群的调节作用
【CSMs的胃肠道滞留时间研究】
图10展示了制备的CSM、CSM@5和司维拉姆碳酸盐在体内外的胃肠道滞留时间研究。实验通过荧光标记和活体成像技术观察了这些微球在小鼠胃肠道中的滞留情况。结果显示,CSM@5微球在胃肠道中的滞留时间显著长于司维拉姆碳酸盐和普通CSM微球,即使在给药后24小时,CSM@5仍能在胃肠道中保持较高的滞留量。这种较长的滞留时间归因于CSM@5表面的仿生皱褶结构,该结构增加了微球与肠道内容物的接触面积和相互作用,从而增强了其吸附能力和肠道滞留性能。这一结果表明,CSM@5微球通过延长在肠道中的滞留时间,能够更有效地吸附磷并调节肠道微生物群。

图10. CSMs的胃肠道滞留时间研究
【小结】
该研究开发了一种模拟肠道微结构的生物模拟皱褶型益生元微球(CSM@5),用于慢性肾病(CKD)患者的高磷血症和血管钙化治疗。这种微球以壳聚糖为基础,通过微流体技术和层层自组装方法制备而成,具有优异的磷酸盐吸附能力、肠道微生物群调节功能以及较长的肠道滞留时间。在体外实验中,CSM@5展现出良好的磷酸盐结合能力;在体内实验中,能够显著降低CKD模型大鼠的血磷水平,同时增加粪便中磷的排泄,并通过调节肠道菌群、增加有益菌数量、减少有害菌数量,改善血管钙化。此外,CSM@5还表现出良好的生物相容性和较低的胃肠不适风险,为CKD患者的高磷血症治疗和心血管并发症预防提供了一种潜在的有效策略。
原文链接:


