论著|老年2型糖尿病患者尿白蛋白/肌酐水平与遗忘型轻度认知功能障碍的相关性研究
时间:2025-02-01 12:09:16 热度:37.1℃ 作者:网络
摘 要
目的 探讨老年2型糖尿病(type 2 diabetes,T2DM)患者尿白蛋白/肌酐(urinary albumin/creatinine ratio,UACR)水平与遗忘型轻度认知功能障碍(amnestic mild cognitive impairment,aMCI)的相关性。
方法 纳入2018年12月至2021年11月期间在新疆维吾尔自治区人民医院住院的198例老年T2DM患者。采用多种神经心理学量表对患者的认知功能进行评估。根据aMCI的诊断标准,将患者分为aMCI组和认知功能正常(normal cognition group,CON)组。依据UACR水平,将患者分为正常蛋白尿、微量蛋白尿和大量蛋白尿。
结果 198例患者中有aMCI者62例(31.3%),认知功能正常136例(68.7%)。在正常蛋白尿组、微量蛋白尿组和大量蛋白尿组间,总体简易精神状态检查量表得分呈现下降趋势,但差异无统计学意义(P>0.05)。微量蛋白尿及大量蛋白尿组的即时回忆和延迟回忆评分均低于正常蛋白尿组,且大量蛋白尿组表现尤为明显(P<0.01)。多因素logistic回归分析显示,调整协变量后,微量蛋白尿(OR=1.35,95%CI:1.16~4.95)和大量蛋白尿(OR=4.38,95%CI:1.68~11.87)与较高的aMCI风险相关。
结论 老年T2DM 患者尿蛋白异常与aMCI发病风险升高有关。
关键词
老年;2型糖尿病;尿白蛋白/肌酐;认知功能障碍;轻度;遗忘型
由于社会老龄化进程加速和2型糖尿病(type 2 diabetes,T2DM)患病率的持续增加,糖尿病合并认知功能障碍越来越多见。轻度认知功能障碍(mild cognitive impairment, MCI)是正常衰老与痴呆的中间状态,遗忘型轻度认知功能障碍(amnesia mild cognitive impairment,aMCI)是MCI的主要亚型,aMCI患者每年约16%转化为痴呆,6年可高达80%,其中约99%确诊为阿尔茨海默病(Alzheimer disease,AD),而正常老人每年的痴呆转化率仅为1%~2%,因此早期识别aMCI是预防痴呆的关键[1-2]。文献报告,糖尿病患者发生认知功能障碍的概率是非糖尿病人群的2~4倍[3]。研究发现肾功能不全、尿蛋白异常是T2DM患者认知功能降低的危险因素[4-5]。而对于肾功能在正常范围的老年T2DM患者,尿白蛋白/肌酐水平(urinary albumin/creatinine ratio, UACR)是否与糖尿病认知功能下降的发生发展相关尚存在争议。本研究以老年T2DM患者为研究对象,探讨T2DM患者UCAR与aMCI之间的关系,以期为早期筛查糖尿病认知功能障碍提供理论依据。
1 对象与方法
1.1 研究对象 顺序入组2018年12月至2021年11月在新疆维吾尔自治区人民医院综合保健内科住院的T2DM患者。患者纳入标准:①符合1999年WHO糖尿病诊断标准;②年龄≥60岁;③糖化血红蛋白在6.5%~10%;④简易精神状态检查量表(mini-mental state examination,MMSE)分值≥24分;⑤日常生活活动能力(daily life activity ability,ADL)基本正常,其量化积分<16分;⑥全面衰退量表(comprehensive decline scale,GDS)评定在2~3级;⑦海金斯基缺血量表(Hachiski ischemic scale,HIS)评分≤4分;⑧17项汉密尔顿抑郁量表(Hamilton depression scale,HAMD)评分<12分;⑨近期(3个月内)MRI显示无(或轻微的)颞叶、海马萎缩;⑩aMCI组需符合2004年PETERSEN制定的aMCI标准[6],即主诉记忆力减退并得到周围人的证实,与患者年龄不相符的记忆力损害客观证据(以记忆实验成绩的下降程度低于年龄和教育程度相匹配的对照组1.5个标准差以上为客观证据),总的认知功能充分保存,且不满足痴呆及相关疾病的诊断标准。排除标准:①文盲受试者MMSE评分≤19分,小学文化受试者MMSE评分≤22分,初中文化受试者MMSE评分≤26分;②估算肾小球滤过率(estimated glomerular filtration ratee, eGFR)<60 mL/(min·1.73 m2);③低血糖;④糖尿病酮症酸中毒等急性并发症患者;⑤任何影响记忆或认知功能的其他神经系统疾病;⑥合并其他严重急慢性疾病或有严重合并症,如严重心脑血管疾病、恶性肿瘤等,或甲状腺功能异常、显著的维生素B12或烟酸缺乏者;⑦嗜酒者。
共纳入198例T2MD患者。入组患者均签署知情同意书。本研究经医院医学伦理委员会审查同意(审批号:KY201911307,KY2023060161)。
入组患者根据aMCI诊断标准[6]分为aMCI组和认知功能正常组(CON组)。再根据基线UACR水平分为正常蛋白尿组、微量蛋白尿组以及大量蛋白尿组。
1.2 方法
1.2.1 一般资料 收集老年T2DM患者年龄、性别、受教育程度、糖尿病病程、吸烟史、饮酒史、高血压、冠心病、脑血管病相关病史及用药史等。测量身高、体质量,并计算体质指数(body mass index,BMI)。
1.2.2 实验室及辅助检查指标 禁食12 h,晨空腹抽血,检测指标包括糖化血红蛋白(glycosylated hemoglobin,HbA1c)、空腹血糖(fasting blood glucose, FBG)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、血肌酐(creatinine, Scr)、尿素氮(urea nitrogen, BUN)等。完善颈部血管B超、眼底照相、心脏彩超、头颅MRI和MRA检查。
糖尿病视网膜病变根据眼底照相结果提示微血管瘤形成、渗出、出血等改变。腔隙性脑梗死MRI表现[7]:大脑半球深部结构(基底节、丘脑、内囊、放射冠)脑干等中线部位,影像学表现为直径<15 cm的腔隙灶(边界清晰,T1低信号,T2高信号,呈圆形、椭圆形或裂隙状)。脑白质异常信号[8],病变范围可以大小不等,在T2WI或T2FLAIR序列上呈高信号,T1WI呈等信号或低信号,取决于序列参数和病变的严重程度,其内无空腔,与脑脊液信号不同。采用双盲法由2位专业技术人员诊断。
1.2.3 计算UACR 入院第2日晨7点前排空膀胱,留取第2次尿液约3 mL。采用免疫散射比浊法测定尿微量白蛋白(albumin,Alb),采用酶法测定尿Scr水平。计算UACR,UACR(mg/g)=尿微量白蛋白(mg/dL)/尿肌酐(g/dL)。依据《中国2型糖尿病防治指南(2020年版)》标准,将UACR<30 mg/g称为正常蛋白尿,UACR 30~300 mg/g称为微量蛋白尿,UACR>300 mg/g称为大量蛋白尿[9]。
1.2.4 神经心理量表评估 采用MMSE、ADL、GDS、HIS、HAMD评估临床症状。使用韦氏记忆量表子量表故事逻辑记忆(logical memory ⅡB,LM-ⅡB)评估逻辑记忆力,包括即时和延迟记忆力。受试者在2 min内阅读一小段简单的故事并尽量记住,阅读结束后立即回忆,每回忆出一个要点得1分,总分25分,30 min再次进行回忆,评分规则同前。
1.3 统计学方法 采用SPSS 26.0进行统计分析。呈正态分布的计量资料以x±s表示,组间比较采用t检验。偏态分布数据以中位数表示,采用Mann-Whitney U检验。频数数据比较用确切概率法或χ2检验。以aMCI为因变量,尿蛋白正常为参照组,微量蛋白尿、大量蛋白尿为自变量,采用二元logistic回归分析微量蛋白尿、大量蛋白尿与aMCI高风险的相关性。检验水准α=0.05。
2 结 果
2.1 aMCI组与CON组间一般资料及生化指标比较 共纳入老年T2DM患者198例,其中男124例,女74例。aMCI组62例,CON组136例,aMCI的发生率为31.3%。与CON组相比,aMCI组患者年龄更大,病程更长,收缩压、HbA1c、UACR更高,差异有统计学意义(P<0.05)。在肾损害方面,aMCI组的微量尿蛋白及大量尿蛋白比例均高于CON组,差异有统计学意义(P<0.05)。见表1。
表1 aMCI与CON组间一般资料及生化指标比较

1)与CON组相比,经t检验,P<0.05;2)与CON组相比,经χ2检验,P<0.05。
2.2 正常蛋白尿组、微量蛋白尿组、大量蛋白尿组的一般资料比较 纳入的198例老年T2DM患者中,正常蛋白尿、微量蛋白尿、大量蛋白尿分别为94例、76例和28例。3组的年龄、病程、收缩压、HbA1c、FPG差异有统计学意义(P<0.05);3组在糖尿病合并症及并发症方面也存在着差异,微量蛋白尿组、大量蛋白尿组糖尿病视网膜病变、脑缺血梗死、脑白质病变明显高于正常尿蛋白组(P<0.05)。见表2。
表2 正常蛋白尿组、微量蛋白尿组、大量蛋白尿组的一般资料比较
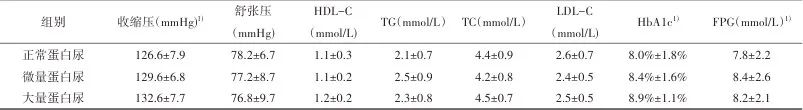
1)3组比较,经单因素方差分析,P<0.05;2)3组比较,经χ2检验,P<0.05。
2.3 正常蛋白尿组、微量蛋白尿组、大量蛋白尿组的认知量表评分比较 正常蛋白尿组、微量蛋白尿组、大量蛋白尿组MMSE总分呈下降趋势,但差异无统计学意义(P>0.05)。微量尿蛋白及大量尿蛋白组即时回忆、延迟回忆评分低于正常蛋白尿组,在大量蛋白尿组尤为明显(P<0.01)。见表3。
表3 正常蛋白尿组、微量蛋白尿组、大量蛋白尿组的认知量表比较

1)3组比较,经单因素方差分析,P<0.01。
2.4 遗忘型轻度认知功能障碍的logistic回归分析 以有无aMCI为因变量,UACR分组为自变量,以年龄、收缩压、受教育年限、糖尿病病程、糖化血红蛋白等连续变量,以及高血压及冠心病病史(1=有,0=无)、糖尿病视网膜病变(1=有,0=无)、脑白质病变(1=有,0=无)、脑缺血梗死(1=有,0=无)等二分类变量作为协变量,进行多因素logistic回归分析。校正多个变量后,结果显示,微量蛋白尿(OR=1.35,95%CI:11.16~4.95)、大量蛋白尿(OR=4.38,95%CI:1.68~11.87)与aMCI高风险相关。见表4。
表4 UACR水平与aMCI的logistic回归分析
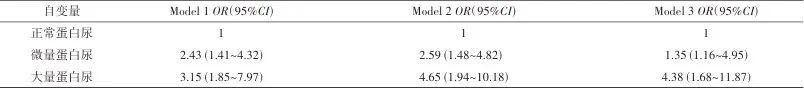
注:Model 1未调整其他危险因素;Model 2调整年龄、性别、受教育年限、糖尿病病程、高血压病史、冠心病病史;Model 3调整年龄、性别、受教育年限、糖尿病病程、高血压病史、冠心病病史、收缩压、糖化血红蛋白、糖尿病视网膜病变、脑白质病变、脑缺血梗死。
3 讨论
目前认为DM认知功能障碍是DM的一种新的并发症[10-11]。T2DM与痴呆均属增龄性疾病,而且两者相互影响。对于糖尿病患者要重视认知功能的筛查,以延缓痴呆的发生发展,而在痴呆防控中关键是要不断将关口前移,尽早发现尤为重要。
aMCI的诊断和评估目前缺少统一的金标准。不同评估工具在不同人群和临床状况下应用有其异质性。由于影响认知功能障碍的因素众多,如日常生活自理能力、情感障碍及抑郁等都可能影响认知功能评估,故本研究在调查对象入组前均先进行ADL、GDS、HAMD筛查,以尽量控制混杂因素的影响,排除了ADL评分>26分、GDS评定>3级、HAMD评分>7分的患者。既往关于认知功能障碍的研究中,目标人群为MCI、痴呆老年患者,鲜有aMCI的报道。而且既往认知评估量表多为MMSE、蒙特利尔认知评估(Montreal cognitive assessment,MoCA)等广谱认知功能的评估工具,对于单领域认知评估,尤其是记忆力评估缺乏特异性。因此本研究在多种神经精神心理量表的基础上,联合韦氏记忆量表子量表故事逻辑记忆,更具有针对性。
本研究老年T2DM患者aMCI的发生率为31.3%,远高于既往的研究[4]。主要是因为既往研究对象为MCI,未进一步分型。另一原因在于应用的认知功能评估量表不同,既往研究多为MMSE或MoCA,其对于单领域评估特异性及敏感性不高。与既往研究一致的是,研究发现年龄、糖尿病病程、糖化血红蛋白是aMCI的重要危险因素[12-13],是由于血糖控制不良会通过损伤血管、促进血管硬化和微循环异常等影响脑部的供血导致脑组织损伤和认知功能障碍的发生,对于其发病机制的假说,包括氧化应激、胰岛素抵抗、胰岛素信号通路受损、炎症介质等[14-15]。
既往研究提示,不仅肾功能不全与认知功能障碍相关,伴有蛋白尿与痴呆风险增加之间也存在关联[16-17]。LI等[18]进行了一项关于认知功能障碍/痴呆与蛋白尿相关性的系统综述和meta分析,共有16项研究(包括11项队列研究和5项横断面研究)被纳入meta分析,结果表明白蛋白尿与认知功能障碍和痴呆显著相关。提示白蛋白尿可能是一个潜在的预测因素,对应于肾脏疾病进展的更早期亚临床时间点,可预测未来痴呆的发生。刘婧茹等[19]探讨老年T2DM患者基线血尿酸及UACR与认知功能障碍的相关性,结果显示老年T2DM患者认知功能障碍与基线UACR密切相关,UACR>300 mg/g是认知功能障碍的危险因素。本研究结果显示,正常蛋白尿组、微量蛋白尿组、大量蛋白尿组MMSE总分呈下降趋势,与正常尿蛋白组相比,即时回忆、延迟回忆评分随蛋白尿的增加而下降。调整多个协变量,尿蛋白异常与aMCI高风险相关,微量蛋白尿者患aMCI风险是正常蛋白尿者的1.35倍,大量蛋白尿者患aMCI风险是正常蛋白尿者4.38倍。与既往研究结果相一致,白蛋白尿与认知功能障碍相关,而且尿蛋白含量越高,发生aMCI的风险越高。
尽管白蛋白尿与认知功能之间的关系机制尚未完全阐明,但可能有几种合理的机制可以解释这种关联。首先,蛋白尿可能作为氧化应激的替代标志物,氧化应激在痴呆的发病机制中起着重要作用[20]。其次,动脉粥样硬化过程,由于内皮损伤通常会持续数十年,可能有助于与AD相关的神经退行性变[21]。此外,动脉粥样硬化相关疾病,包括高血压和糖尿病已被证明与认知功能测试表现不佳以及痴呆风险增加有关[22]。最后,微血管病理学与肾脏、心脏和大脑各种血管疾病的风险增加相关,可能参与血管性痴呆的发病机制,也可能参与AD的发病机制[23]。
本研究同时发现,与正常蛋白尿组相比,微量蛋白尿组、大量蛋白尿组脑缺血梗死、脑白质病变者明显增多。这表明,肾脏微血管病变的程度与脑小血管病变存在正相关关系。关于肾损害与认知功能损害的发病机制研究认为,肾脏和大脑都是终末器官,由于其相似的解剖学和血液动力学特征均易受到血管损伤的影响。脑小血管病变导致脑部特定区域的血流供应不足,小血管病变常伴随着局部和系统性炎症反应,炎症因子可能导致神经元损伤,损害脑功能,脑小血管的内皮细胞损伤、氧化应激的增加可能导致血脑屏障功能障碍,损害细胞结构并引发神经毒性,影响认知功能的维持[24-27]。此外,痴呆和慢性肾脏疾病共有相似的危险因素,包括高血压、糖尿病和高脂血症,且伴有这两种疾病的患者发生脑小血管疾病、无症状脑梗死、白质病变和脑微出血的比例更高[28-29]。也有学者认为,认知功能减退与糖尿病微血管并发症之间的这种相关性可能是因为微血管病变影响了从基质到神经元之间有效传递的微血管路径,从而导致了大脑功能的障碍[30-31]。
综上所述,本研究发现了老年T2DM肾脏微血管损害与aMCI的相关性,且随着UACR的升高,认知功能障碍逐渐加重,脑小血管病监测率升高,对于糖尿病合并尿微量白蛋白/肌酐水平增高者需进一步评估认知功能。白蛋白尿对应于肾脏疾病进展的更早期亚临床时间点,是一个潜在的预测未来发生痴呆的因素。针对白蛋白尿的病理机制进行干预或治疗可改变的风险因素,可能对预防痴呆或延缓疾病进展具有临床意义。
本研究存在如下局限性:①作为横断面研究,无法证实尿蛋白异常与认知功能下降的因果关系,进一步随访研究有助于证实两者间的关系;②样本量较少,未评估用药及检测无症状低血糖发生;③UACR有波动性,基线UACR无法充分体现变异性;④对于脑白质变性、脑梗死在多因素回归分析中只做了二分类,后续需进一步量化,就程度进一步研究与aMCI的关系。在日后的研究中我们将会完善相关局限。
参考文献:
1. 田金洲, 解恒革, 王鲁宁, 等. 中国阿尔茨海默病痴呆诊疗指南(2020年版)[J]. 中华老年医学杂志, 2021, 40(3): 269-283.
2. CHOU Y H, SUNDMAN M, TON THAT V, et al. Cortical excitability and plasticity in Alzheimer’s disease and mild cognitive impairment: A systematic review and meta-analysis of transcranial magnetic stimulation studies[J]. Ageing Res Rev, 2022, 79: 101660.
3. 中华医学会内分泌学分会, 中国成人2型糖尿病降压治疗目标研究工作组. 2型糖尿病患者认知功能障碍防治的中国专家共识[J]. 中华内分泌代谢杂志, 2022, 38(6): 453-464.
4. 张玲, 陈政文, 陆晨, 等. 维吾尔族老年糖尿病患者轻度认知功能障的影响因素分析[J]. 中华老年医学杂志, 2017, 36(9): 951-954.
5. SMABREKKE S, SCHIRMER H, MELSOM T, et al. Low-grade impairments in cognitive and kidney function in a healthy middle-aged general population: A cross-pal study[J]. BMC Nephrol, 2019, 20(1): 166.
6. PETERSEN R C. Mild cognitive impairment as a diagnostic entity[J]. J Intern Med, 2004, 256(3): 183-194.
7. VERMEER S E, PRINS N D , DEN HEIJER T, et al. Silent brain infarcts and the risk of dementia and cognitive decline[J]. N Engl J Med, 2003, 348(13): 1215-1222.
8. FAZEKAS F, CHAWLUK J B, ALAVI A, et al. MR signal abnormalities at 1.5 T in Alzheimer’s dementia and normal aging[J]. Am J Roentgenol, 1987, 149(2): 351-356.
9. 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J].中华糖尿病杂志, 2021, 13(4): 315-409.
10. BIESSELS G J, DESPA F. Cognitive decline and dementia in diabetes mellitus: Mechanisms and clinical implications[J]. Nat Rev Endocrind 2018, 14(10): 591-604.
11. 陆少欢, 程万春, 黄琳. 老年2型糖尿病患者糖化血红蛋白与认知功能障碍的相关性[J]. 中国老年学杂志, 2019, 39(2): 282-284.
12. 张玲, 木亚斯沙尔, 蓓里·加帕尔, 等. 2型糖尿病血糖控制水平及其相关因素与维族老年人认知功能障碍的关系[J]. 中华老年心脑血管病杂志, 2017, 19(4): 353-357.
13. LUO A, XIE Z, WANG Y, et al. Type 2 diabetes -associated cognitive dysfunction: Advances in potential mechanisms and therapies[J]. Neurosci Biobehav Rev, 2022, 137: 104642.
14. EHTEWISH H, ARREDOUANI A, EL-AGNAF O. Diagnostic, prognostic, and mechanistic biomarkers of diabetes mellitus-associated cognitive decline[J]. Int J Mol Sci, 2022, 23(11): 6144.
15. 梁财, 陶娅, 蒲凤, 等. 糖尿病患者认知衰弱的研究进展[J]. 中华老年多器官疾病杂志, 2024, 23(7): 557-560.
16. VERHAGEN C, JANSSEN J, MINDERHOUD C A, et al. Chronic kidney disease and cognitive decline in patients with type 2 diabetes at elevated cardiovascular risk[J]. J Diabetes Complications, 2022, 36(10): 108303.
17. ARAFA A, KAWACHI H, MATSUMOTO C, et al. The association between the estimated glomerular filtration rate and cognitive impairment: The suita study[J]. Hypertens Res, 2024, 47(3): 672-676.
18. LI H, ZHAO S, WANG R, GAO B. The association between cognitive impairment/dementia and albuminuria: A systematic review and meta-analysis[J]. Clin Exp Nephrol, 2022, 26(1): 45-53.
19. 刘婧茹, 袁晓丹, 刘欢欢, 等. 老年2型糖尿病患者基线血尿酸、尿白蛋白/肌酐比值与认知功能障碍的相关性分析[J]. 中国糖尿病杂志, 2023, 31(3): 187-190.
20. DESCHAMPS V, BARBERGER-GATEAU P, PEUCHANT E, et al. Nutritional factors in cerebral aging and dementia: Epidemiological arguments for a role of oxidative stress[J]. Neuroepidemiology, 2001, 20(1): 7-15
21. HOFMAN A, OTT A, BRETELER M M, et al. Atherosclerosis, apolipoprotein E, and prevalence of dementia and Alzheimer’s disease in the Rotterdam Study[J]. Lancet, 1997, 349(9046): 151-154.
22. EKBLAD L L, TOPPALA S, JOHANSSON J K, et al. Albuminuria and microalbuminuria as predictors of cognitive performance in a general population: An 11‐year follow-up study[J]. J Alzheimers Dis, 2018(2), 62: 635-648.
23. ROGNE S O, SOLBU M D, ARNTZEN K A, et al. Albuminuria and carotid atherosclerosis as predictors of cognitive function in a general population[J]. Eur Neurol, 2013, 70: 340-348.
24. 中国研究型医院学会脑小血管病专业委员会《中国脑小血管病诊治专家共识》编写组. 中国脑小血管病诊治专家共识2021[J]. 中国卒中杂志, 2021, 16(7): 716-726.
25. WARDLAW J M, SMITH C, DICHGANS M. Mechanisms of sporadic cerebral small vessel disease: Insights from neuroimaging[J]. Lancet Neurol, 2013, 12(5): 483-497.
26. NYLANDER R, FAHLSTROM M, ROSTRUP E, et al. Quantitative and qualitative MRI evaluation of cerebral small vessel disease in an elderly population: A longitudinal study[J]. Acta Radiol, 2018, 59(5): 612-618.
27. 邢楠, 华素玉, 李俐涛. 脑小血管病影像学标志物与认知功能障碍相关性研究进展[J]. 中国神经精神疾病杂志, 2024, 50(4): 242-246.
28. 杨娟, 程健, 冯轶, 等. 老年2型糖尿病患者脑白质高信号和认知功能损伤危险因素随访研究[J]. 中国神经精神疾病杂志, 2023, 49(10): 598-603.
29. LU Y C, WANG C P, HUNG W C, et al. Interactive effect of obesity and cognitive function decline on the risk of chronic kidney disease progression in patients with type 2 diabetes mellitus: A 9.1-year cohort study[J]. Int J Med Sci, 2022, 19(11): 1660-1671.
30. ARITON D M, JIMÉNEZ-BALADO J, MAISTERRA O, et al. Diabetes, albuminuria and the kidney-brain axis[J]. J Clin Med, 2021, 10(11): 2364.
31. DREW D A, WEINER D E, SARNAK M J. Cognitive Impairment in CKD: Pathophysiology, management, and prevention[J]. Am J Kidney Dis, 2019, 74(6): 782-790.
【引用格式】张玲,王英,坎丽比努尔,等. 老年2型糖尿病患者尿白蛋白/肌酐水平与遗忘型轻度认知功能障碍的相关性研究[J]. 中国神经精神疾病杂志,2024,50(12):719-725.
【Cite this article】ZHANG L,WANG Y,KANLi B,et al.Association between urinary albumin creatinine ratio and amnestic mild cognitive impairment in elderly patients with type 2 diabetes mellitus[J]. Chin J Nervous Mental Dis,2024,50(12):719-725.
DOI:10.3969/j.issn.1002-0152.2024.12.003


