ATVB 南通大学刘东教授团队揭示单核细胞 “掌控” 器官血管化过程中血管走向的关键细胞机制
时间:2025-01-27 12:08:33 热度:37.1℃ 作者:网络
组织和器官的血管化过程是一个复杂且精密的生物学过程,对胚胎发育、组织修复和维持机体正常功能至关重要[1]。整个器官血管化过程受到多种因素的精细调控,包括生长因子、细胞外基质、信号通路以及细胞间的相互作用等,这些因素协同作用,确保血管能够准确、有序地形成和发育,为器官的正常生长、发育和功能维持提供必要的支持。血管发育异常,可能引发心脑血管疾病等严重问题[2]。因此,对血管形成的调控机制的研究一直是心血管领域的热点和重要方向。
血管发育主要包括血管发生(vasculogenesis)和血管新生(angiogenesis)两个阶段。血管发生是指在胚胎发育早期,由血管母细胞形成原始血管网络的过程;而血管新生则是在已有血管的基础上,通过出芽、延伸、吻合和修剪等一系列复杂事件,产生新血管的过程[3]。随着器官功能的逐渐完善和变化,血管会不断调整其分布和结构,以满足器官在不同生理状态下的代谢和功能需求。血管的定向迁移和连接是器官或者组织构建正确血管网络的关键环节,但长期以来,精确调控血管定向迁移的引导信号有待进一步明确;这些信号的细胞来源还未见报道。
2025年1月23日,南通大学刘东教授课题组在美国心脏学会(AHA)杂志Arteriosclerosis, Thrombosis, and Vascular Biology发表了题为“Monocyte-Derived cxcl12 Guides a Directional Migration of Blood Vessels in Zebrafish”的研究论文。该团队在斑马鱼胸鳍血管形成过程中发现一种长距离的血管定向迁移和吻合现象,而斑马鱼胸鳍从胚胎期到成年几乎完全透明,为研究血管的定向迁移提供了良好的模型。研究团队借助活体成像技术,阐释了胸鳍血管的发育过程,并且发现胸鳍血管其中一端(PFVc)会历经长距离迁移,精准地与第二对节间血管吻合(图1)。
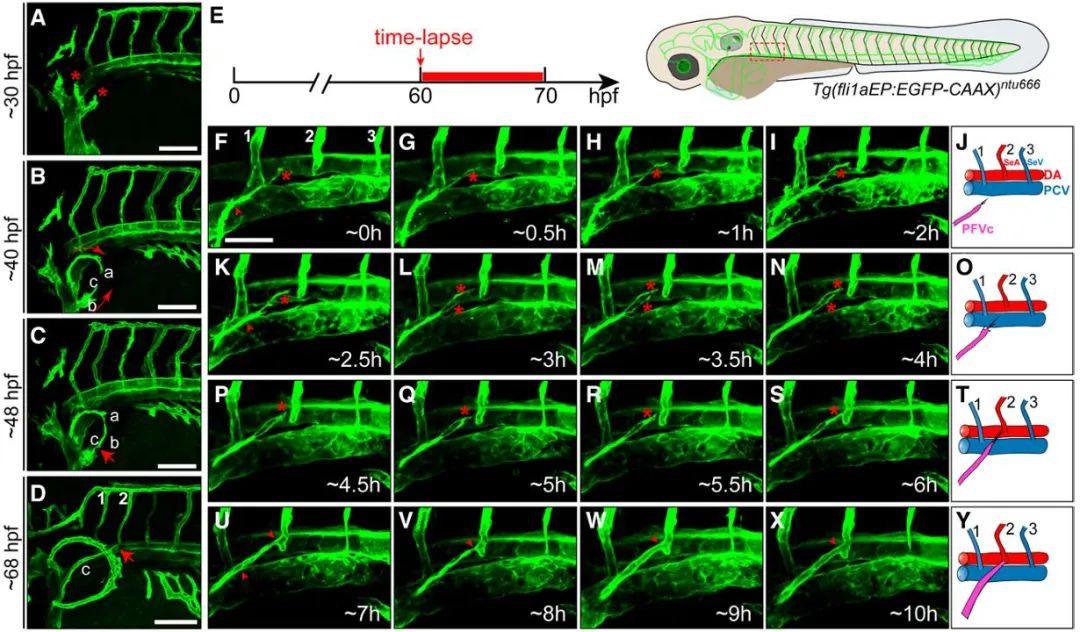
图1. PFVc定向迁移与吻合
探究其分子机制,研究人员发现cxcr4a-cxcl12a信号轴在其中起着核心作用。通过单细胞转录组测序、原位杂交等技术手段发现趋化因子受体cxcr4a在发育中的胸鳍血管内皮细胞有较高表达,而没有检测到其他受体的显著表达。原位杂交筛选发现其配体cxcl12a则在第二对节间血管附近特异性高表达。抑制或过表达该信号轴相关基因,均导致PFVc生长方向异常,并形成错误链接,证实了其关键引导作用(图2, 图3)。
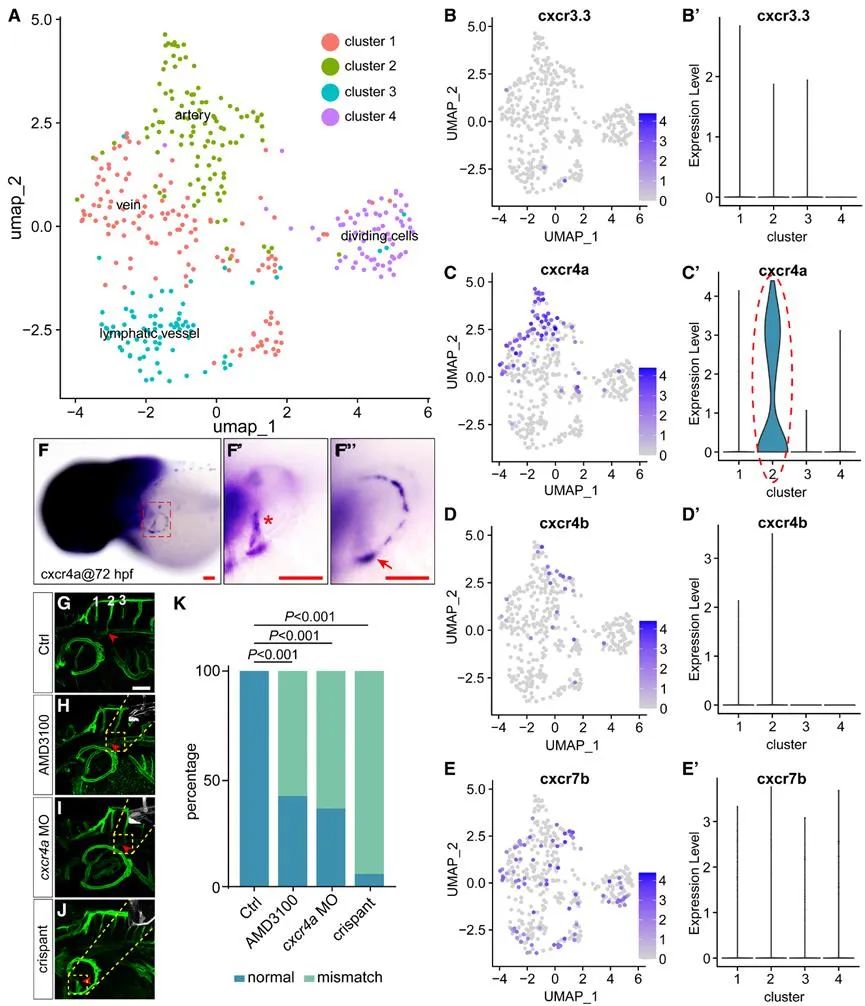
图2. Cxcr4a参与调控PFVc的迁移与吻合
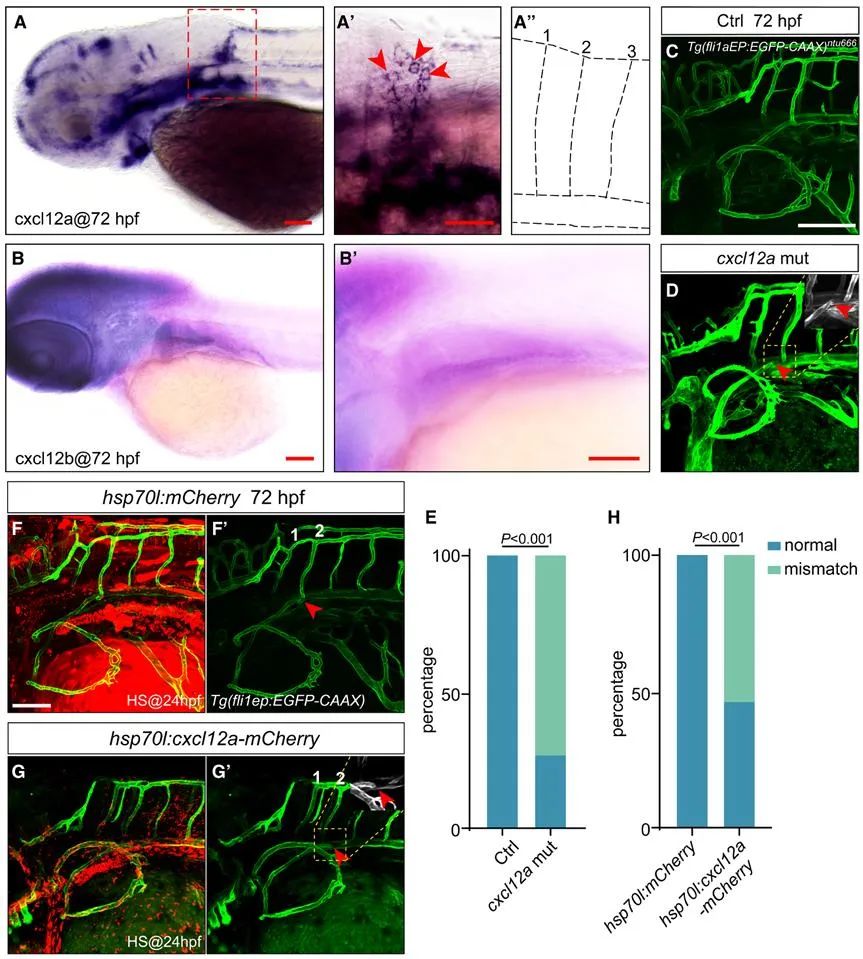
图3. Cxcl12a-cxcr4a调控PFVc的定向迁移与吻合过程
进一步通过单细胞转录组测序的数据分析、细胞消融、荧光原位杂交等实验数据表明,一群表达gata1a的单核细胞是cxcl12a的主要来源。这些单核细胞分泌的cxcl12a,引导着血管的迁移和吻合(图4)。
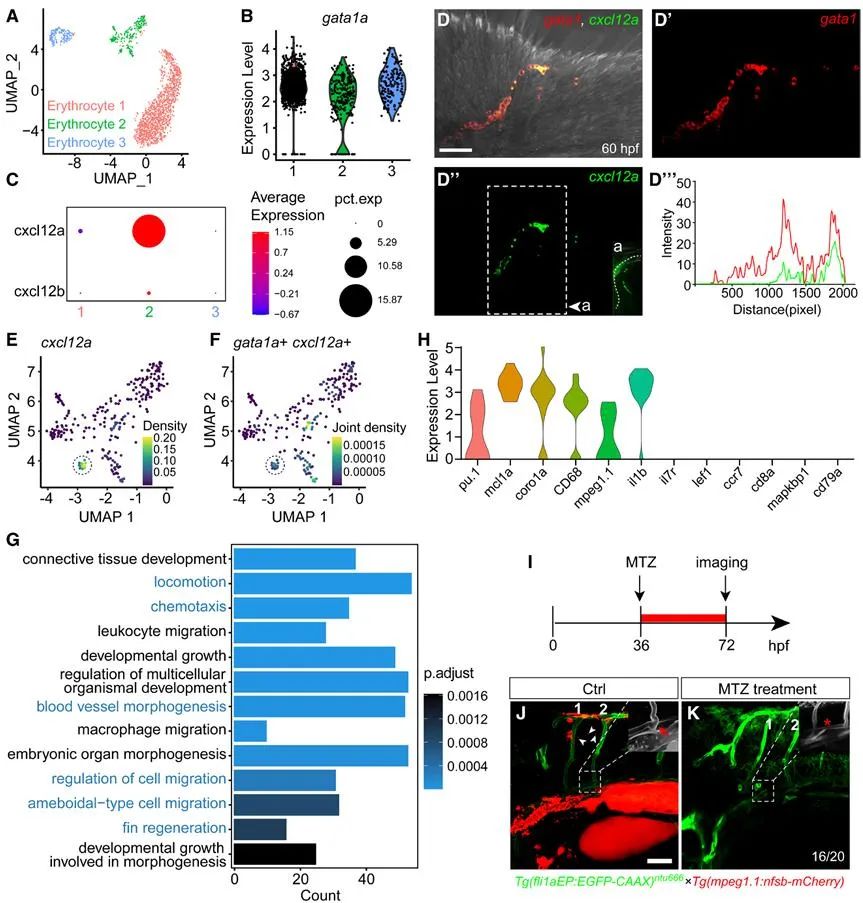
图4. 调控PFVc定向迁移与吻合的cxcl12a由单核细胞分泌
综上,该研究发现了器官血管化过程中一种长距离的血管迁移和吻合过程,首次明确了单核细胞来源的cxcl12a-Cxcr4在血管定向迁移和吻合中的关键作用,为脊椎动物器官特异性血管化机制的研究提供了全新的细胞生物学机制(图5)。
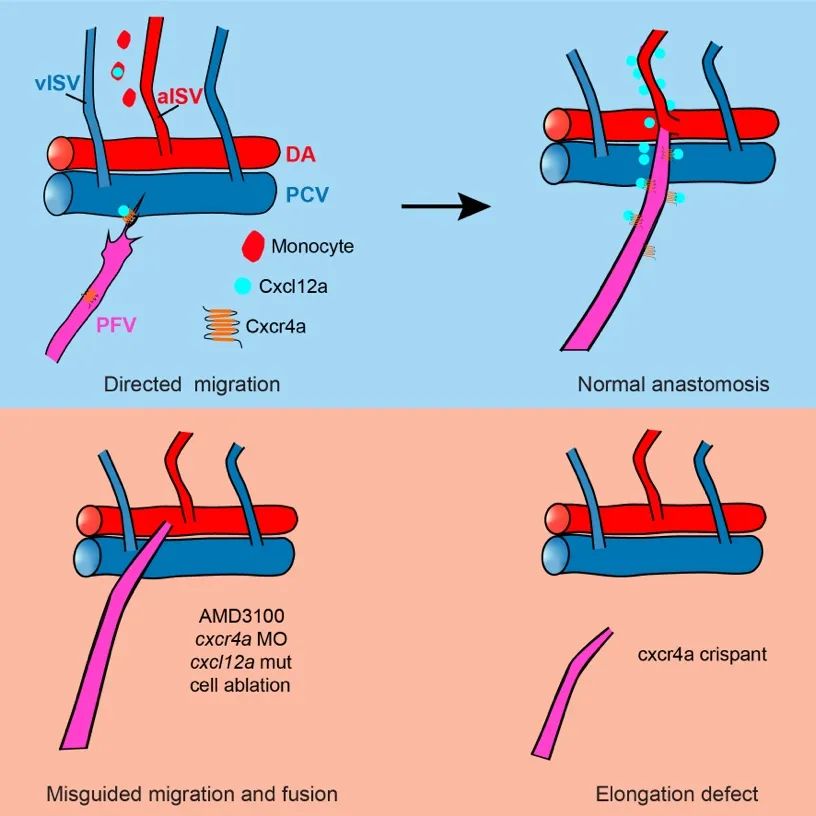
图5. 图片摘要
南通大学生命科学学院卢晓凤博士、附属医院王晓宁博士、研究生李博文为论文第一作者,南通大学生命科学学院刘东教授、段旭初博士为论文通讯作者,南通大学为论文唯一通讯单位。
参考文献:
1. Marcelo, K.L., L.C. Goldie, and K.K. Hirschi, Regulation of endothelial cell differentiation and specification. Circ Res, 2013. 112(9): p. 1272-1287.
2. Potente, M., H. Gerhardt, and P. Carmeliet, Basic and therapeutic aspects of angiogenesis. Cell, 2011. 146(6): p. 873-887.
3. Schuermann, A., C.S. Helker, and W. Herzog, Angiogenesis in zebrafish. Semin Cell Dev Biol, 2014. 31: p. 106-114.
原文链接:
https://www.ahajournals.org/doi/10.1161/ATVBAHA.124.321588


