病例分享 | 精母细胞瘤一例
时间:2025-02-13 12:09:49 热度:37.1℃ 作者:网络
一、病 史
男性,52岁。
发现右侧阴囊肿物4个月,无疼痛,肿物逐渐增大,拟“右侧睾丸肿瘤”入院。
专科检查:
右侧睾丸增大、质硬,无明显压痛,边界清,活动度可,左侧阴囊未扪及肿物。
二、辅助检查
1、超声
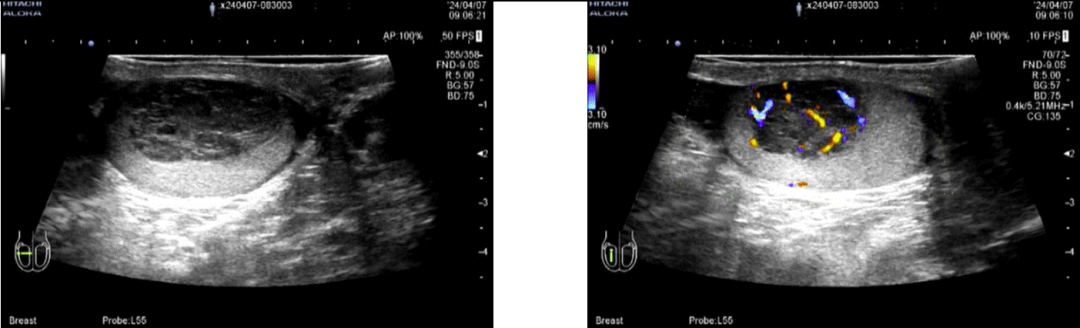
右侧睾丸实质内可见一低回声区,大小约28x25x17mm,边界尚清,内回声不均。CDFI :右侧睾丸实质低回声内可见丰富的血流信号。
超声提示:右侧睾丸实质内实性低回声,性质待定,建议进一步检查。
2、CT
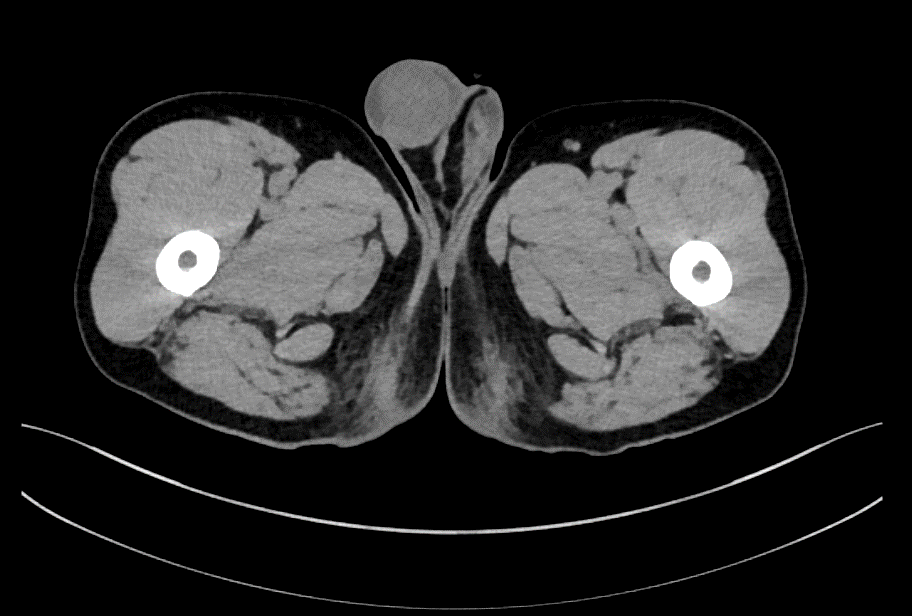
右侧睾丸体积增大,大小约35x29.5mm,其内密度欠均匀,隐约见一类圆形稍高密度影。
诊断意见:右侧睾丸肿瘤性病变。
3、盆腔MRI平扫+增强
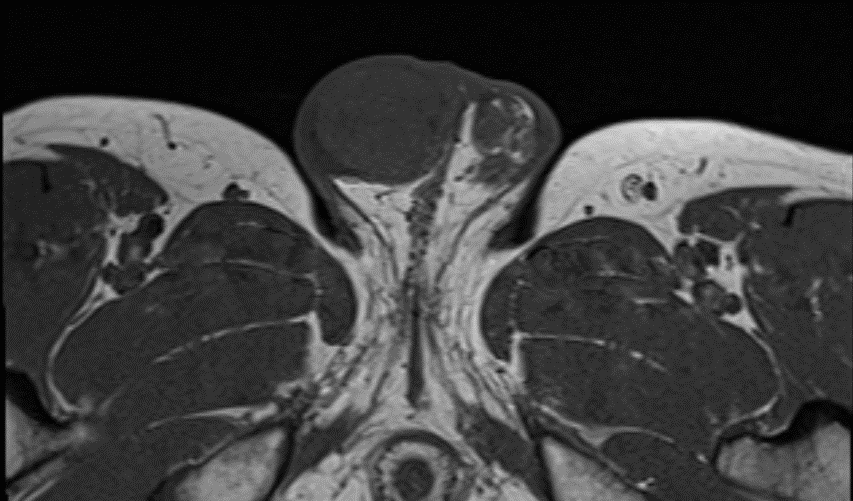
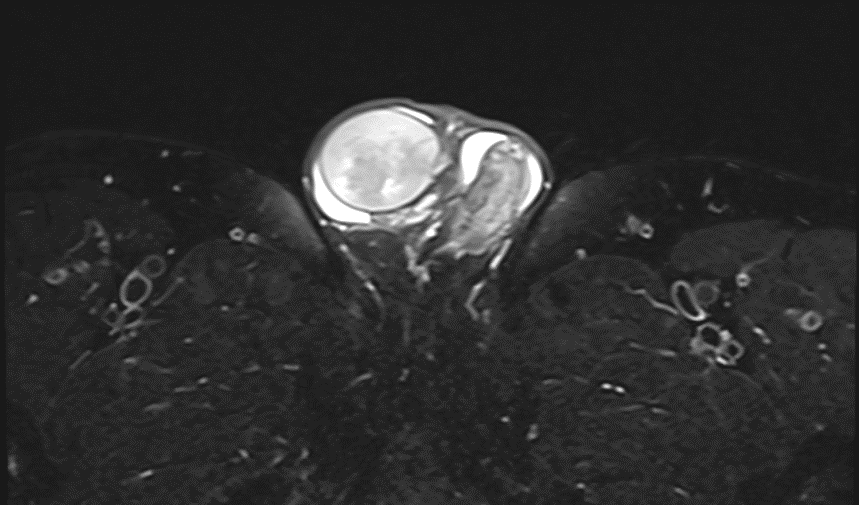
右侧睾丸略显增大,其大小约43x35x27mm,内见病灶,大小约29x26x21mm,包膜较光整。
诊断结论:考虑右侧睾丸生殖细胞肿瘤,以精原细胞瘤可能性大。
4、实验室检查
AFP、CEA及β-hCG均未见明显升高。尿分析及定量检测未见异常。
三、病理检查
01 大体:
睾丸大小45x40x30mm,切面见一灰白色结节,大小25x20x20mm,边界清楚,周围有精索组织。
02 镜下:
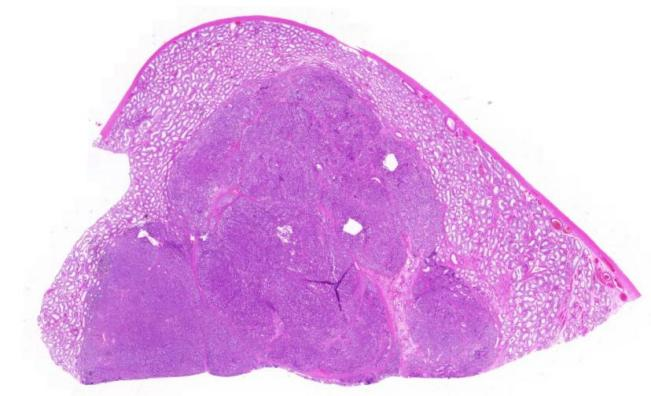
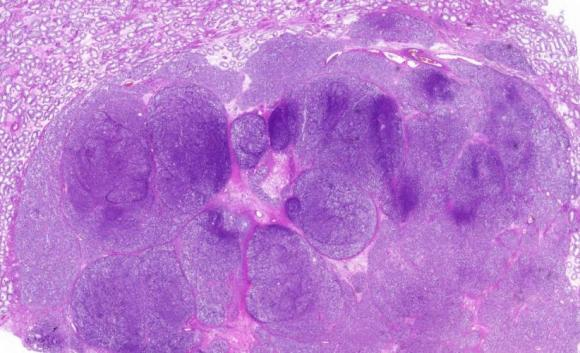
肿物呈结节状,分叶状,边界清楚,膨胀性生长
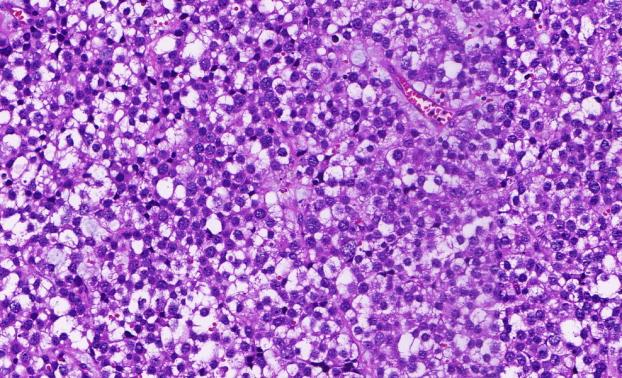
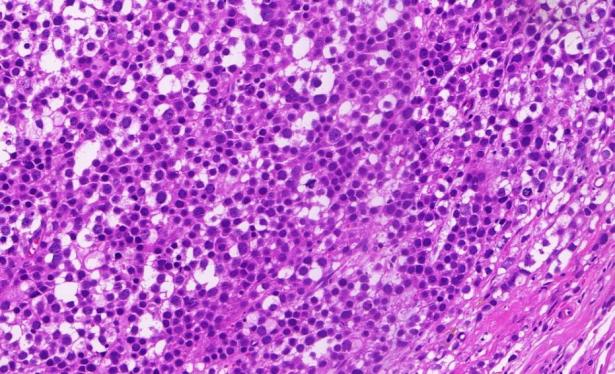
肿瘤细胞胞浆嗜酸性或胞浆丰富透亮,细胞核圆形,大小相对一致,间质小血管增生
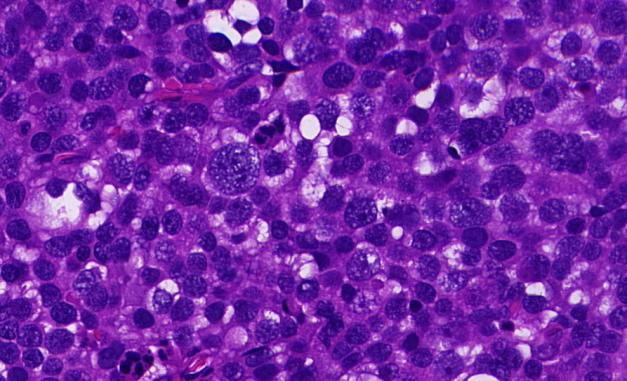
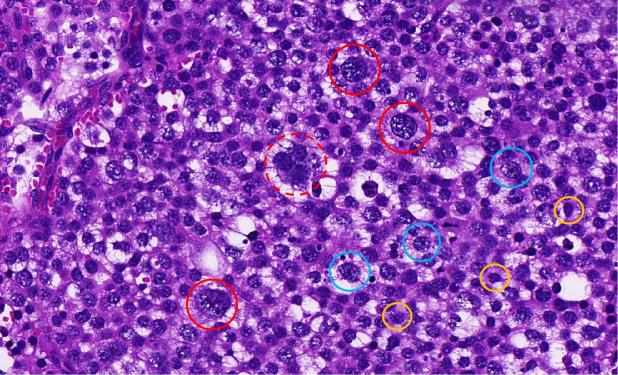
显示典型的大、中、小三种不同的肿瘤细胞,伴大的多核肿瘤细胞,出现肿瘤细胞凋亡
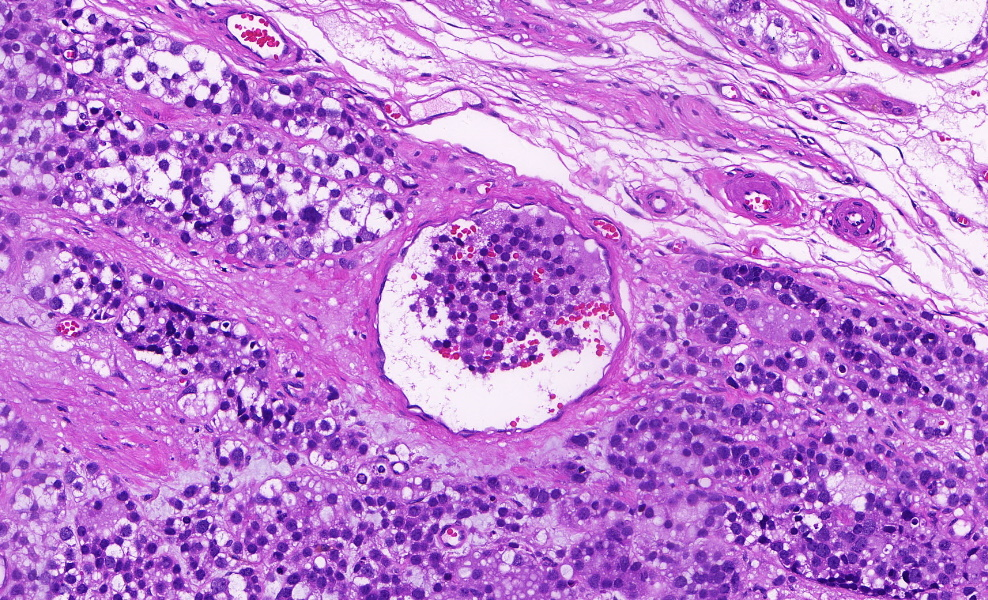
脉管内瘤栓
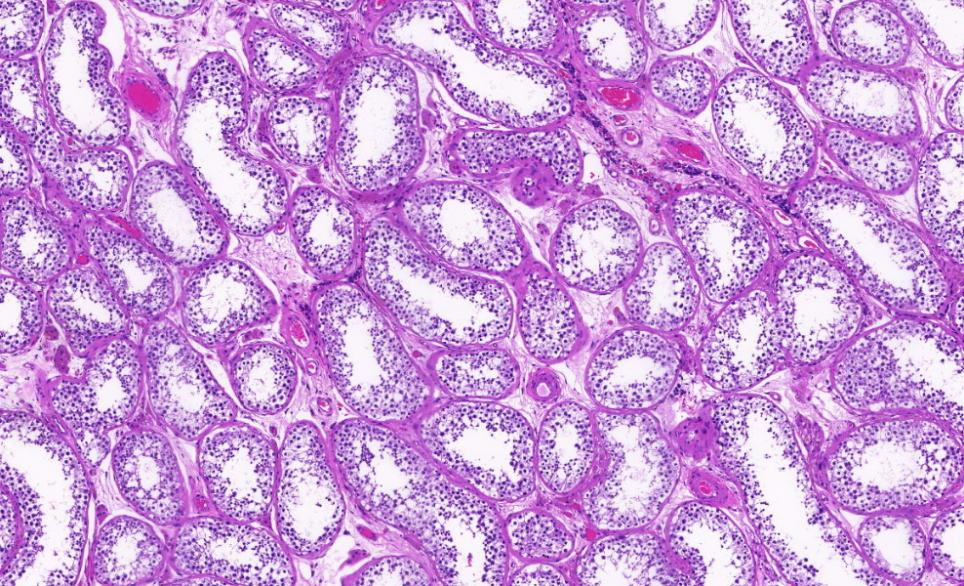
周围生精小管未见病变,未见原位生殖细胞肿瘤及其他异常,生精功能正常
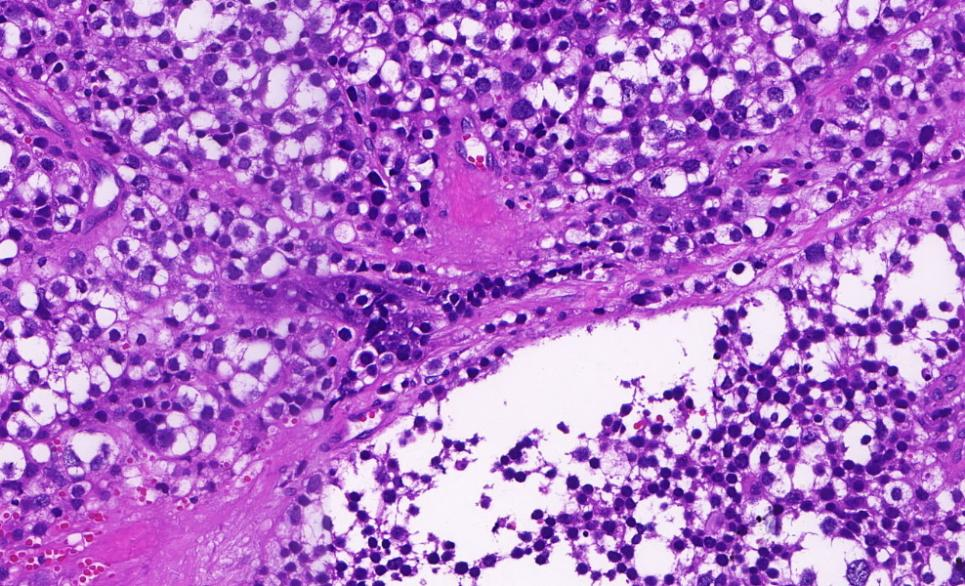
局灶间质淋巴细胞浸润
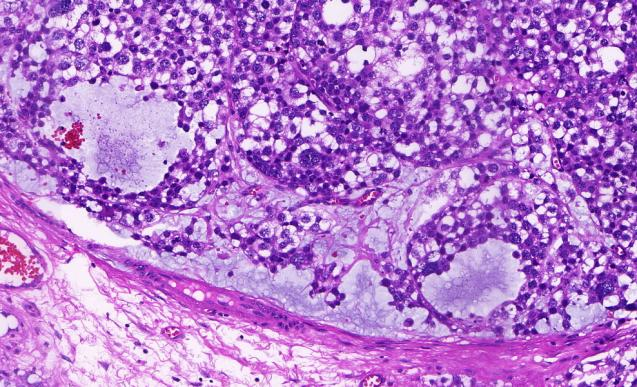
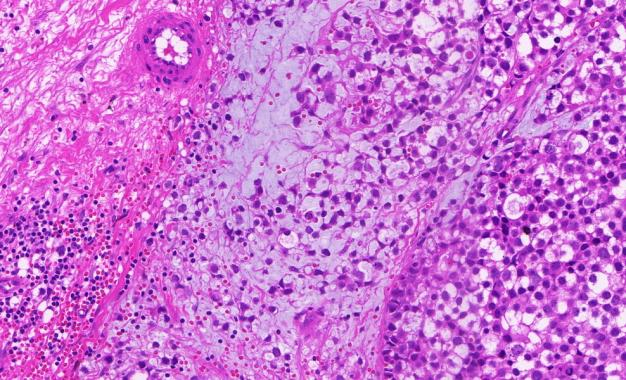
间质黏液水肿,伴微囊假腺样结构形成
镜下形态总结:
肿瘤界限清楚,肿瘤细胞弥漫片状排列,被纤细纤维分隔呈结节状、小叶状;具有大、中、小三种细胞形态,伴大的多核肿瘤细胞及细胞凋亡;间质黏液水肿样,伴有微囊形成;周围缺乏原位生殖细胞肿瘤,无小管萎缩、实质瘢痕、小管结石、坏死或精子发生受损等发育异常特征。
03 免疫组化
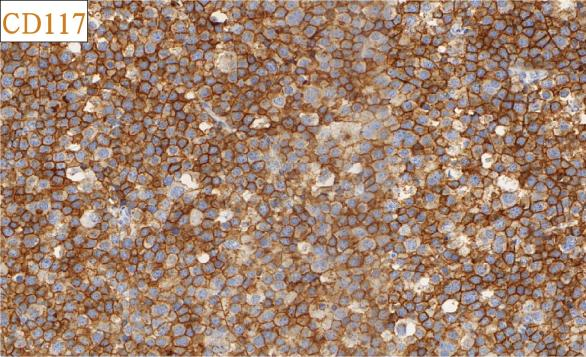
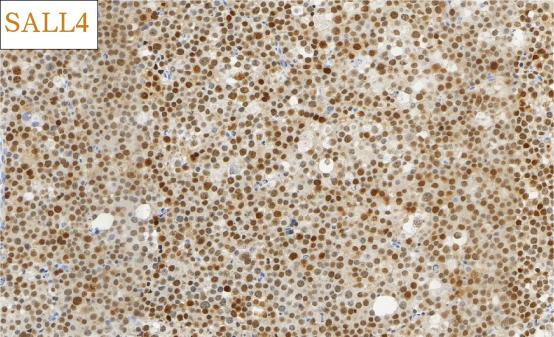
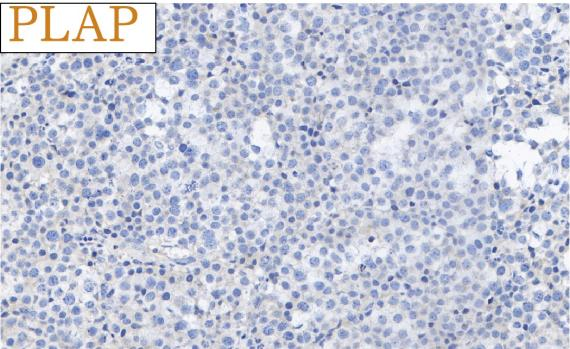
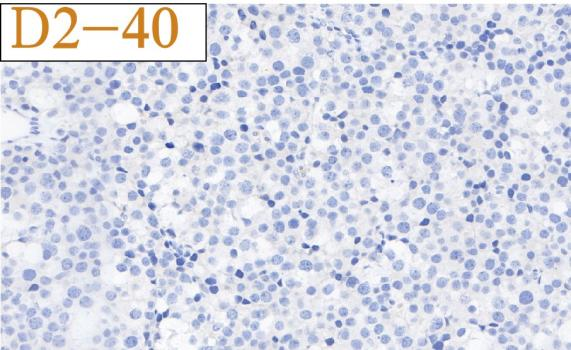
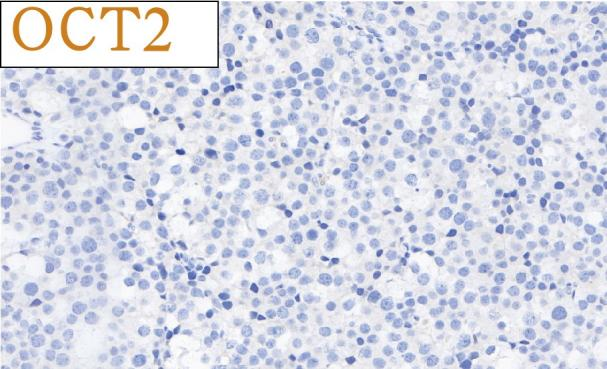
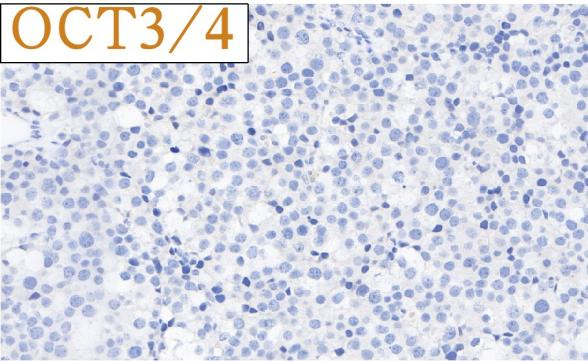
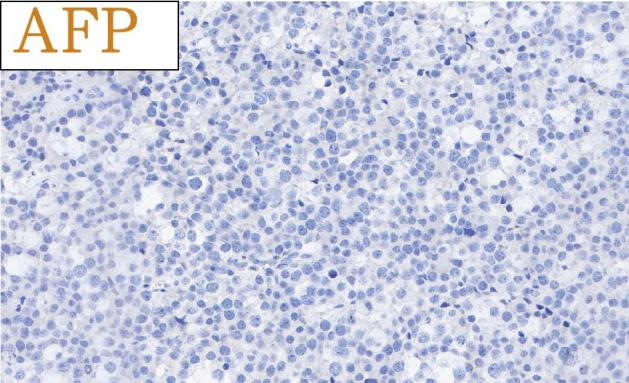
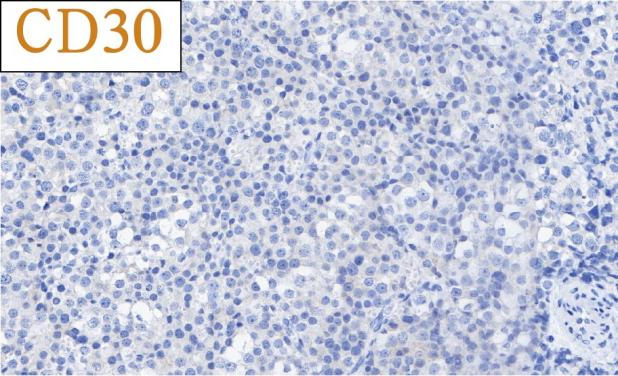
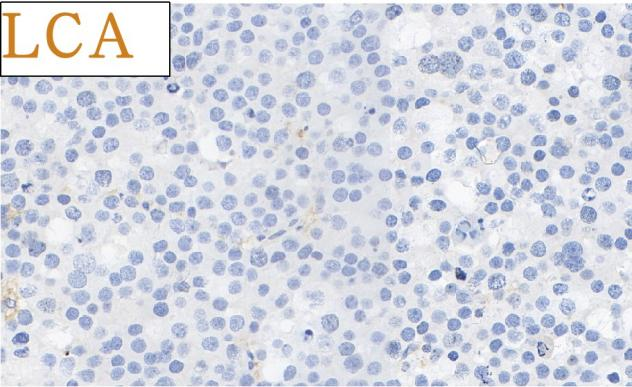
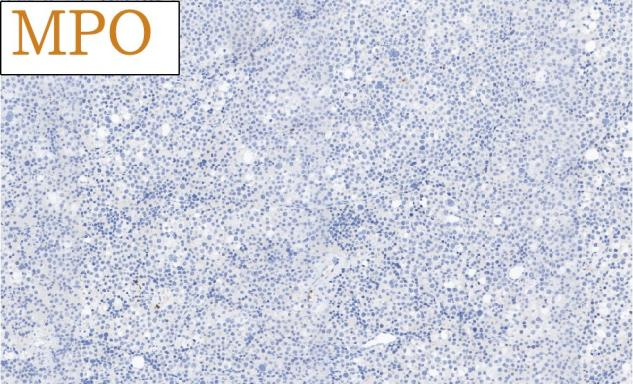
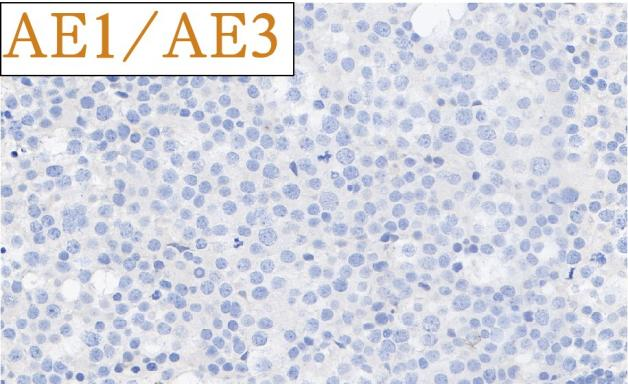
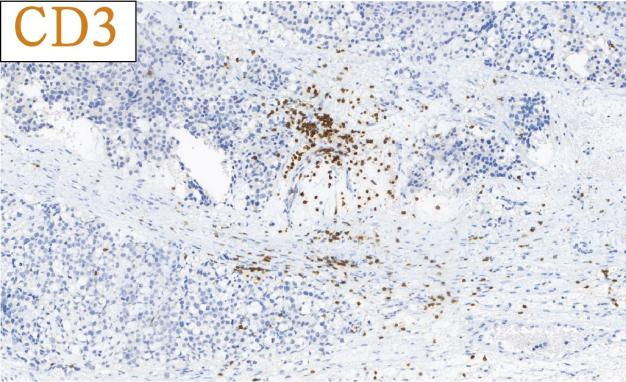
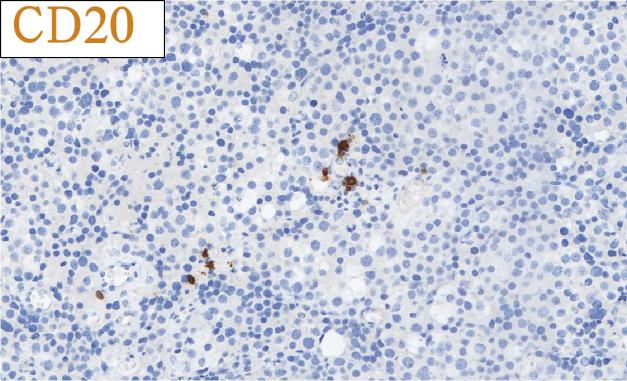
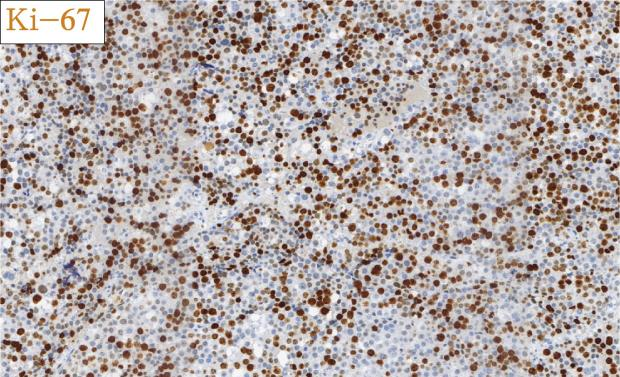
免疫组化结果总结:
肿瘤细胞SALL4、CD117均强阳性、PLAP、OCT3/4、OCT2、CD30、AE1/AE3、LCA、MPO、AFP、D2-40、CD3、CD20均阴性,Ki-67高表达。
诊断:(右侧睾丸)精母细胞瘤。
四、讨论
精母细胞性精原细胞瘤更名为精母细胞瘤的原因主要有以下三点:首先,与其他生殖细胞肿瘤相比,精母细胞瘤有不同的起源:它们起源于更成熟的生殖细胞(可能是在精原细胞和精母细胞之间过渡阶段的减数分裂前生殖细胞),而非起源于原始生殖细胞/性腺细胞。
其次,与精原细胞瘤不同,精母细胞瘤没有12p的扩增,而起源于原位生殖细胞肿瘤的青春期后型生殖细胞肿瘤常见。
第三,精母细胞瘤表现出独特的9号染色体扩增,这在所有原位生殖细胞肿瘤(germ cell neoplasia in situ,GCNIS)相关肿瘤中没有报道,在青春期前畸胎瘤和青春期前卵黄囊瘤中也有报道。
第5版WHO睾丸肿瘤分类中,精母细胞瘤与GCNIS无关。

01 定义
精母细胞瘤起源于青春期后型生殖细胞,肿瘤细胞类似精原细胞或早期初级精母细胞,细胞往往由大、中、小三种细胞组成。曾用名精母细胞性精原细胞瘤,因其发病机制和预后不同于精原细胞瘤,此名不再推荐使用,以免混淆。
ICD-O:9063/3
02 临床表现
该肿瘤相对罕见,约占所有生殖细胞肿瘤的1%,好发于中老年(平均52-59岁),也可发生于年轻男性。与其他生殖细胞肿瘤如Leydig细胞瘤也可同时发生。多表现为无痛性增大肿块,生长相对缓慢,单侧睾丸多见,且右侧多见,9%表现为双侧先后发生。实验室检查肿瘤标志物无升高。
03 大体
精母细胞瘤肿块最大直径3~5cm或更大,呈分叶状、多结节状,切面灰白、灰黄色、出血、水肿、鱼肉样或黏液样改变,可发生囊性变、局灶坏死,可侵犯附睾。肉瘤变区域呈质地稍硬、鱼肉状,多坏死。
04 镜下
肿瘤常呈膨胀性浸润,低倍镜呈多结节状分布,结节间为纤维血管分隔,也可呈弥漫性分布;肿瘤细胞粘附性差,由大、中、小三种不同的细胞形态,它们分别代表精母细胞的不同分化阶段:
①小细胞型,细胞圆形,胞质少,核均质、深染、类似淋巴细胞。
②中等大细胞型,核圆形、外形规整,细颗粒状或丝球状染色体,核仁突出。
③大细胞型,单核或多核,核特征与中等大细胞相类似。
后两种细胞的胞质嗜酸性至嗜碱性着色,或苍白淡染,胞界常不清楚,核分裂(包括非典型)和细胞凋亡常见。少数病例大细胞不常见,以中等大细胞为主。偶尔肿瘤细胞可间变,核仁明显,似胚胎性癌。约6%病例可以肉瘤样变,以横纹肌肉瘤最多见,其次为未分化肉瘤,细胞呈梭形或多形性,易见坏死、核分裂,或以多种成分混合存在。肉瘤分化提示肿瘤预后不良。若以肉瘤成分为主,可误诊为睾丸肉瘤。罕见情况下,精母细胞瘤可完全为生精小管内生长。缺乏淋巴样间质和肉芽肿改变;黏液水肿常见,可形成假腺泡结构,也可囊性变,部分病例可见坏死。间质稀少,纤维纤细,胶原条索包绕肿瘤。周围缺乏GCNIS。肿瘤易侵犯生精小管,可能是肿瘤的快速进展,而不是肿瘤起源于生精小管的 GCNIS 。可见侵犯血管、被膜及附睾。间变亚型以大细胞为主,核多形性伴有显著大核仁,与预后无关,不推荐使用间变型精母细胞瘤术语。
05 免疫组化
肿瘤细胞SALL4、CD117、OCT2、MAGEA4常阳性;CAM5.2可核旁点状着色,SCP1、XPA、GPC3有阳性表达;近期的研究表明精母细胞瘤恒定表达SSX-CT;不表达PLAP、OCT3/4、AFP、hCG、CD30。
06 分子遗传学
肿瘤细胞 DNA含量是二倍体、多倍体或非整倍体,常有1、9、18、20和X染色体获得,7、15、16染色体缺失;FGFR3 和HRAS 基因突变;9号染色体( 包括DMRT1 )扩增和12染色体无异常是较特异的诊断;与隐睾、种族人群和GCNIS均无关。
07 第5版WHO睾丸肿瘤分类精母细胞瘤诊断标准:
必要的诊断标准 精母细胞瘤通常发生在老年患者,大多数患者在50岁或60岁;镜下表现为三种不同的细胞类型,无淋巴细胞浸润或显著的纤维间隔:不表达常见的生殖细胞肿瘤标记物,无GCNIS。
理想的诊断标准 无12p扩增,出现特征性分子改变,包括9号染色体的扩增。
08 鉴别诊断
1)经典型精原细胞瘤:
精母细胞瘤由大、中、小三种细胞组成,淋巴细胞和/或肉芽肿反应少见,且只发生在睾丸,不合并隐睾、其它生殖细胞肿瘤和GCNIS。免疫组化精母细胞瘤SALL4、OCT2、MAGEA4常阳性,不表达PLAP、OCT3/4;精原细胞瘤有GCNIS成分,肿瘤细胞含大量糖原,转移常见,可见纤维反应、淋巴细胞浸润及肉芽肿反应,且PLAP和OCT3/4阳性。
2)、胚胎性癌:精母细胞瘤含间变性成分较多时与胚胎性癌鉴别,但前者细胞核更圆,有灶状的典型形态,缺乏GCNIS,并且缺乏CD30、PLAP、OCT3/4和细胞角蛋白的表达。
3)、淋巴造血系统肿瘤:淋巴造血肿瘤细胞往往弥漫分布,表达淋巴造血肿瘤标记物,不表达SALL4、OCT2、MAGEA4、GPC3等抗体。
09 治疗及预后
临床治疗方式以手术切除睾丸为主,一般无需化疗;肿瘤预后较好,很少发生转移,少数个案报道转移至后腹膜淋巴结;少数病例肿瘤可肉瘤样变,约半数可远处转移,最常转移至肺,预后较差,一般诊断2年内死亡。
参考文献
1.Urinary and Male Genital Tumours (5th ed.)
2.临床病理诊断与鉴别诊断 泌尿及男性生殖系统疾病 2020
3.Secondino S,et al. Spermatocytic Tumor: A Review. Int J Mol Sci, 2023. 24(11).
4.Rosenberg C, Mostert MC,Schut TB. Chromosomal constitution of human spermatocytic seminomas: Comparative genomic hybridization supported by conventional and interphase cytogenetics. Genes Chromosomes Cancer 1998, 23, 286–291.
5.Freitag CE, Sukov WR, Bryce AH,et al. Assessment of isochromosome 12p and 12q abnormalities in germ cell tumors using fluorescence in situ hybridization, single-nucleotide polymorphism array, and next-generation sequencing-mate-pair sequencing. Hum. Pathol. 2021,112, 20–24.
6.Looijenga LH, Hersmus R, Gillis AJM,et al. Genomic and expression profiling of human spermatocytic seminomas: Primary spermatocyte as tumorigenic precursor and DMRT1 as candidate chromosome 9 gene. Cancer Res. 2006, 66, 290–302.
7.Ando T and M Naito. First case of synchronous Leydig cell tumor and spermatocytic tumor in the unilateral testis. Urol Case Rep, 2024. 53: p. 102648.
8.Chawhan PA, C Ahluwalia and S Ahuja.Spermatocytic tumor with extensive lymphovascular invasion in a young male. Urol Case Rep, 2024. 55: p. 102797.


