转移性炎性肌纤维母细胞瘤发生克唑替尼耐药,检出新型PLEC-EML4-ALK“双”融合
时间:2025-02-13 12:20:28 热度:37.1℃ 作者:网络
ALK融合是炎性肌纤维母细胞瘤(IMT)中常见的致癌驱动因素。克唑替尼治疗对融合阳性患者有效,但获得性耐药仍是一个挑战。本文介绍了一例EML4-ALK阳性转移性IMT病例,该病例最初对克唑替尼有反应,但产生了耐药性。在进展病变中检出“双融合”事件——EML4-ALK与PLEC融合产生PLEC-EML4-ALK转录本。双融合与ALK表达增加有关,类似ALK融合扩增——这是肺癌中已知的克唑替尼耐药机制。在转用更有效的ALK抑制剂阿来替尼后,患者表现出显著缓解。因此,双融合的形成代表了一种新型且可靶向的克唑替尼耐药机制。
背 景
炎性肌纤维母细胞瘤(IMT)是一种遗传异质性的、极为罕见的间叶肿瘤。大约 85% 的IMT以基因组重排为特征,导致基因融合,其中最常见的是ALK相关融合。由此产生的融合蛋白作为致癌驱动因素发挥作用,并被酪氨酸激酶抑制剂(TKI)成功靶向。然而,TKI耐药会不可避免地产生。本文报告了一例转移性EML4-ALK阳性IMT成年患者的病例,其肿瘤通过涉及PLEC-EML4-ALK的新型双融合对ALK抑制剂克唑替尼耐药。双融合与ALK mRNA的更高表达相关,类似ALK融合基因扩增,这是非小细胞肺癌(NSCLC)对克唑替尼的已知耐药机制。据研究人员所知,这是首个关于双融合作为靶向治疗耐药机制的报告。
病 例
患者女,60 岁,因数月咳嗽和发烧加重于 2021 年 12 月就诊于当地医院。胸部CT显示右肺上叶有一个大的肿块,通过手术切除治疗。术后组织学检查诊断为IMT,手术切缘阳性,有胸膜侵犯的证据(图1A、B)。手术三个月后,患者再次出现发烧、咳嗽和体重减轻。CT和PET成像证实存在局部复发性疾病以及转移性扩散到回肠、右锁骨上窝和右大腿软组织。为缓解症状,切除了回肠转移瘤,并将患者转诊至美国科罗拉多大学安舒茨医学院。
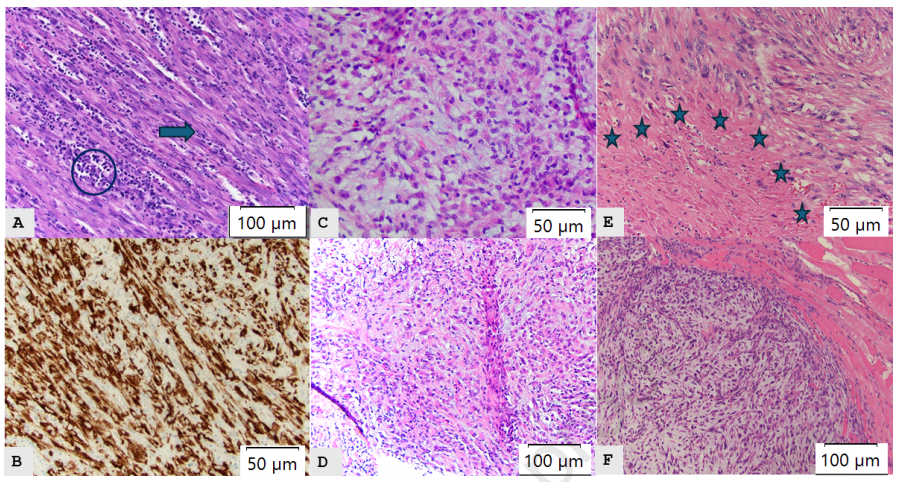

▲图1
(A)RUL肺原发性肿瘤(未接受治疗,H&E 10x),2022年3月,可见肿瘤细胞核增大(箭头)和浸润淋巴细胞和浆细胞(圆圈);(B)肺原发性肿瘤中的ALK免疫组织化学染色(20x);(C、D)右锁骨上窝(克唑替尼耐药)肿块的穿刺活检(分别为H&E 20x和H&E 10x),2023 年 2 月;(E)转移灶切除术右肺尖(H&E 20x),2023年6月,阿来替尼治疗后可见坏死(星号);(F)转移灶切除术右锁骨上窝肿块(H&E 10x),2023年6月
对回肠转移瘤进行了基于RNA的下一代测序(NGS)基因融合检测,发现了EML4-ALK融合(EML4 2号外显子至ALK 20号外显子)。支持该融合的reads显示片段延伸至EML4 1号外显子(图2)。患者开始使用ALK抑制剂克唑替尼(250 mg,每日两次)治疗,临床获益迅速,症状缓解。根据RECIST v1.1标准,肿瘤在所有疾病部位保持稳定,直至完成第 5 个周期治疗;此时患者因右侧锁骨上窝肿块增大,导致吞咽和发声困难而再次就诊。CT证实锁骨上肿块单独出现疾病进展,而所有其它部位保持稳定。
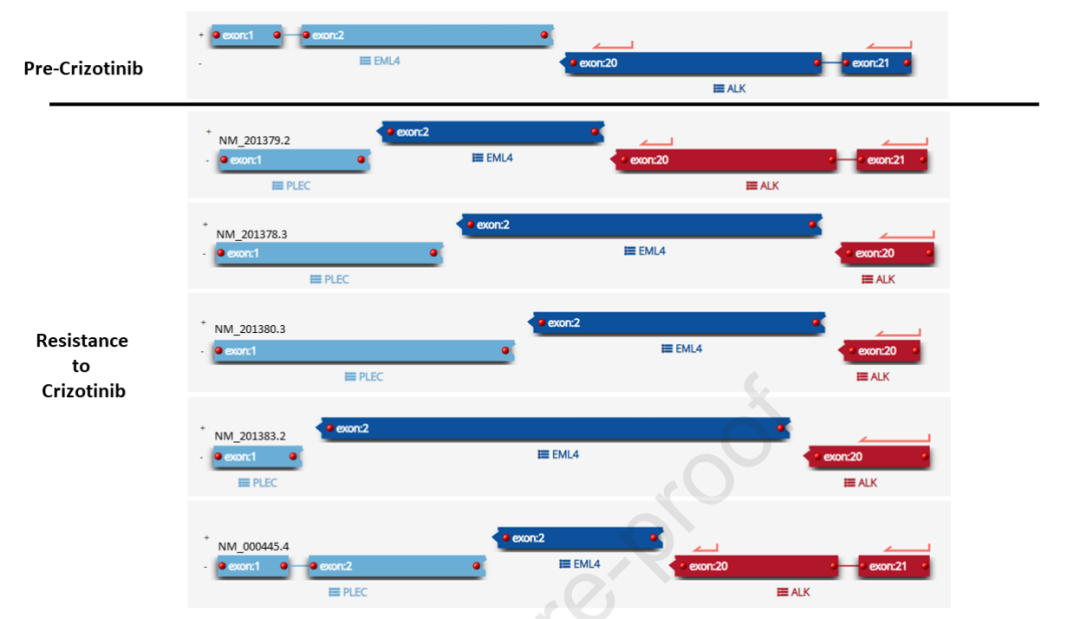

▲图2 基于NGS的基因融合评估
对进展性锁骨上淋巴结病变的活检进行基于NGS的融合检测,检测到PLEC-EML4-ALK“双融合”(PLEC各个区域的多种剪接异构体与EML4 2号外显子融合,预计全部为框内融合,图2)。由于支持克唑替尼前样本中EML4-ALK融合的读数显示EML4 1号外显子与2号外显子的剪接,因此确定此融合事件为新发事件,且与克唑替尼耐药性相关。qRT-PCR显示在克唑替尼耐药样本中ALK表达增加了约 4 倍(数据未显示)。未观察到其它潜在耐药机制,包括额外融合、基因突变或拷贝数变化。病情进展后,停用克唑替尼(治疗 24 周后),开始使用更有效的ALK抑制剂阿来替尼(600 mg,每日两次),临床效果迅速显著。3 个周期后,CT和PET影像证实为部分缓解。患者同时切除了右锁骨上窝肿块和右肺尖肿块。病理评估显示对阿来替尼的反应不同,肺肿块坏死加剧(图1E、F)。在肺肿块中检测到PLEC-EML4-ALK融合。在锁骨上肿块中观察到EML4-ALK,但RNA太碎片化,无法确定这是典型的EML4-ALK还是PLEC-EML4-ALK双融合。锁骨上肿块还检出众所周知的ALK耐药突变p.G1202R。患者术后病情迅速恶化,而阿来替尼治疗仍在继续,但锁骨上肿块出现局部复发,并出现新的脑转移。停用阿来替尼后(治疗 26 周后),开始对脑部病变进行放疗以及服用洛拉替尼(每日 100 mg)治疗。在完成 2 个周期洛拉替尼治疗后,第一次扫描显示病情广泛进展。由于患者身体状况恶化,未接受进一步治疗(洛拉替尼治疗共 15 周),最终在初次诊断 22 个月后死亡(图3)。
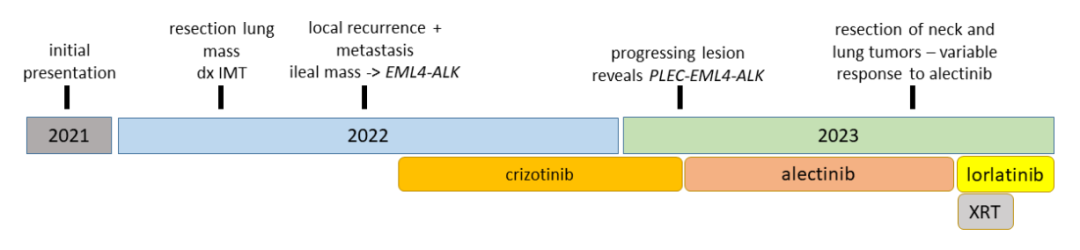

▲图3 临床治疗时间线
讨 论
靶向融合治疗彻底改变了基因融合阳性癌症(包括IMT)患者的治疗。然而,获得性耐药仍是治疗难题。本文介绍的患者罹患侵袭性EML4-ALK阳性IMT,最初对克唑替尼有反应。随后由于新发重排事件对克唑替尼耐药,该事件产生了“双重融合”,导致融合产物表达增加。
ALK融合基因的基因组扩增是NSCLC中对克唑替尼耐药的已知机制。据推测,由此产生的ALK融合蛋白的过度表达降低了克唑替尼结合其靶点的能力,使足够多的融合蛋白未被药物结合,从而驱动增殖信号传导。在NSCLC中,已经证实更有效的ALK抑制剂可以克服扩增介导的耐药性。在这种情况下,双重融合导致ALK融合基因mRNA表达增加大约 4 倍,这可能是因为PLEC启动子的活性比EML4启动子更强。研究人员假设这种表达的增加与ALK融合基因扩增相仿。当患者改用更有效的ALK抑制剂阿来替尼时,临床获益迅速,进一步支持了这一假设。本研究的局限性包括缺乏原发性肿瘤的分子信息、缺少对克唑替尼耐药肿瘤中ALK蛋白表达增加的确认,以及缺乏对耐药机制的转录组和外显子组范围的评估。总之,本案例研究首次报道了ALK“双融合”导致过度表达作为获得性克唑替尼耐药的机制。
我司实体瘤1560基因融合RNA检测(NGS方法学)可检测ALK融合在内超过1560种已知融合和数百个基因相关未知融合,能够满足几乎所有实体瘤患者的靶向用药、预后评估和辅助诊断相关的基因融合变异检测需求。
参考文献:
Alessandra Maleddu, Trista K. Hinz, Margaret A. Black, Dara L. Aisner, Carrie B. Marshall, Anthony D. Elias, Breelyn A. Wilky, Lynn E. Heasley, Kurtis D. Davies, Novel PLEC-EML4-ALK Double Fusion Underlying Crizotinib Resistance in a Metastatic Inflammatory Myofibroblastic Tumor – Case Report,JTO Clinical and Research Reports,https://doi.org/10.1016/j.jtocrr.2025.100791.



