论著|基于机器学习联合血栓弹力图和脑白质病变的非心源性缺血性卒中功能预后预测模型研究
时间:2025-02-02 12:09:27 热度:37.1℃ 作者:网络
摘 要
目的 通过机器学习研究血栓弹力图(thromboelastography,TEG)联合脑白质高信号(white matter hyperintensity,WMH)在预测非心源性急性缺血性卒中(acute ischemic stroke,AIS)患者功能预后的作用和价值。
方法 纳入2022年8月至2024年2月130例非心源性AIS患者,采集患者的一般临床资料、TEG和WMH信息。3个月后使用改良Rankin量表(modified Rankin scale,mRS)随访功能结果,mRS≥2分为预后不良。预测模型按照不同的预测因子范围分为4种特征集合:集合A(一般临床资料+TEG指标 +WMH评分),集合B(一般临床资料+TEG指标),集合C(一般临床资料+ WMH评分),以及集合D(一般临床资料)。针对每种特征集合均使用传统logistic回归模型(logistic regression,LR),以及随机森林(random forests,RF)、神经网络(neural network,NNET)和K-近邻聚类(K-nearest neighbors,KNN)3种机器学习算法,构建预测非心源性AIS患者3个月后功能结果模型,采用Bootstrap重抽样内部验证比较预测模型性能。针对130例患者样本进行模型的训练和测试,并通过0.632+方法修正(optimism correction)模型的曲线下面积(area under the curve,AUC)值及其95%置信区间。
结果 针对LR、NNET和KNN模型,特征集合A的修正AUC值均优于特征集合D(DeLong检验,P<0.05);针对所有模型,特征集合A的修正AUC值高于其他特征集合;针对特征集合A,NNET模型的修正AUC值(0.830)高于其他模型。特征集合A的19个特征中筛选出6个与功能预后有关联的特征:美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分、卒中史、小动脉闭塞亚型、脑室周围白质高信号评分,以及TEG指标最大幅度(maximum amplitude, MA)和纤溶指数LY30。
结论 在一般临床资料基础上联合TEG指标和WMH信息可显著提升预测非心源性AIS患者不良功能预后的准确性。基于机器学习的NNET和KNN算法建立的预测模型具有较高的预测价值。
关键词
非心源性缺血性脑卒中;血栓弹力图;脑白质高信号;预测模型;机器学习;神经网络
急性缺血性卒中(acute ischemic stroke,AIS)是卒中的常见亚型,是导致神经功能障碍和长期残疾的主要原因[1]。建立AIS患者功能预后预测模型可帮助临床医生筛选高风险患者,采取针对性的治疗以提高疗效。白质高信号(white matter hyperintensity,WMH)是白质脱髓鞘的影像学表现,与认知功能障碍相关[2],也是脑小血管病影像特征之一。WMH与高血压、糖尿病、动脉粥样硬化等脑血管病危险因素相关[3-4],并与AIS的功能预后相关[5-7]。凝血功能异常是AIS的重要病因,血栓弹力图(thromboelastography,TEG)综合参数可实现凝血功能定性和定量评估[8],TEG显示AIS患者凝血功能高于健康对照组[9],且与AIS患者的神经功能结果相关[10-11]。实验室指标和神经影像特征在一般临床资料基础上能提供额外的预测AIS患者预后的信息,提升预测准确性[12-13]。本研究在一般临床资料的基础上,基于机器学习探究联合TEG和WMH预测非心源性AIS患者功能预后的作用和价值。
1 对象与方法
1.1 研究对象
收集成都中医药大学附属第三医院(西区)2022年8月至2024年2月的AIS住院患者。纳入标准:①符合《中国急性缺血性脑卒中诊治指南2018》诊断标准;②年龄>18岁;③患者发病到入院抽血时间在72 h内,且在进行抗凝抗血小板治疗前完成抽血并进行TEG检查;④患者入院后7 d内完成MRI检查;⑤按照AIS的Org 10172急性卒中治疗试验(trial of Org 10172 in acute stroke treatment,TOAST)分型,符合大动脉粥样硬化(large artery atherosclerosis,LAA)型或小动脉闭塞(small vessel occlusion,SVO)型。排除标准:①入院后接受静脉溶栓或血管内介入治疗;②有血液疾病或凝血功能障碍;③合并严重肝肾功能障碍或心衰;④病情严重无法完成MRI检查;⑤出院至随访期间未规范行卒中二级预防;⑥随访数据缺失。共纳入147例患者,排除mRS随访数据缺失的患者17例,共130例AIS患者纳入分析。
本研究方案经成都中医药大学附属第三医院(西区)伦理委员会审核批准(伦理号:K-2023-018)。患者均签署了本研究知情同意书。
1.2 一般资料的收集
收集患者的基线资料,包括年龄、性别、既往卒中史、高血压病、糖尿病、高脂血症、高尿酸血症、入院时美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分等。
1.3 院内治疗
患者均接受保守治疗,服用他汀类药物,并根据病情进行阿司匹林或氯吡格雷的单抗治疗,或双抗治疗。
1.4 TEG检测
取患者3 mL静脉全血制备柠檬酸钠抗凝血并混匀。将20 µL凝血触发剂放入反应杯底,向Kaolin试剂容器加1 mL抗凝血并上下颠倒混匀5次。取340 µL混合液加入反应杯,启动测试。TEG检测用Haema T4血栓弹力图测试仪(深圳麦科田生物医疗技术股份有限公司)。
TEG检测的主要指标[8]:①最大幅度(maximum amplitude, MA),血块凝固的最大尺寸,反映血小板的聚集功能,参考值50~70 mm;②夹角(angle),因纤维蛋白原缺乏而减少,反映血块形成的速度;③凝血因子反应时间(R),反映凝血因子活性,为凝血开始至纤维蛋白开始形成时间,参考值4~8 min;④纤溶率(LY30),反映纤溶活性,参考值0~8%;⑤凝血综合指数(coagulation index, CI),综合判断凝血状态,参考值-3~+3。
1.5 卒中TOAST分型
根据MRI,LAA型AIS定义为在脑部影像中发现大脑中动脉或前动脉有明显狭窄或闭塞,且基于磁共振血管成像(MR angiography,MRA)推测是由于动脉粥样硬化所致的患者;SVO型AIS为在MRA序列中大脑半球深部小穿通动脉闭塞,颅内大动脉主干无狭窄或闭塞,在弥散加权成像(diffusion weighted imaging,DWI)序列中显示病变大小2~20 mm[13]。
1.6 WMH影像数据分析
患者行头MRI(3.0 T,西门子公司,德国)检查,包括T1加权成像、T2加权成像、液体衰减反转恢复(fluid-attenuated inversion recovery,FLAIR)、DWI以及表观扩散系数(apparent diffusion coefficient,ADC)序列。白质病变程度采用改良Fazekas量表评级、脑室周围白质高信号(periventricular white matter hyperintensities,PWMH)评分和深部白质高信号(deep white matter hyperintensities,DWMH)评分3个指标进行评价[13]。
Fazekas评级是对大脑整体白质病变程度采用视觉量表进行评估,改良Fazekas量表评级分为0~3级[14]:0级,无病变;1级,斑点样病变;2级,斑块样病变(斑点部分聚集);3级,斑片样病变(病变整合成片)。
PWMH评分标准:无病灶为0分,病灶呈帽状为1分,病灶呈晕圈样、周边光滑为2分,病灶累及深部脑白质、形状不规则且连成片状为3分。DWMH评分标准:无病灶为0分,病灶呈点状为1分,病灶形状不规则或小面积融合为2分,病灶呈大面积融合成片为3分。
上述MRI评估由2位神经科医师独立完成,若出现意见分歧,则再找1位神经影像学专家商议后达成最终决定。
1.7 患者预后数据收集
3个月后,由研究人员对AIS患者电话随访以收集功能预后信息,随访人员不知患者临床信息和治疗情况。使用改良Rankin量表(modified Rankin scale,mRS)对患者进行随访评估,mRS评分0~1分为良好结局,≥2分为不良结局。比对部分门诊复诊患者信息与电话随访信息,mRS评分一致,验证电话随访数据可靠性。患者按功能结果分为mRS<2分组和mRS≥2分组。
1.8 预测模型分析
1.8.1 预测特征变量 预测特征变量分为4种特征集合:集合A(一般临床资料+TEG指标+白质病变影像评分),集合B(一般临床资料+TEG指标),集合C(一般临床资料+白质病变影像评分),以及集合D(一般临床资料)。其中一般临床资料为性别、年龄、入院NIHSS评分、高血压、糖尿病、高脂血症、高尿酸血症、卒中史、卒中TOAST分型以及院内用药情况;TEG指标有MA、R、Angle、LY30和CI;白质病变影像评分有Fazekas评级、PWMH评分和DWMH评分3个指标。
1.8.2 模型构建 使用logistic回归模型(logistic regression,LR),以及随机森林(random forests,RF)、神经网络(neural network,NNET)和K-近邻聚类(K-nearest neighbors,KNN)3种机器学习算法模型,针对不同预测特征集合建立AIS患者发病3个月后功能预测模型。
LR模型和机器学习模型均采用10折交叉验证的最小绝对收缩和选择算子(LASSO回归)进行特征选择。机器学习模型以最优AUC值为目标,采用5折交叉验证的贝叶斯优化(Bayesian-optimization)算法进行模型超参数调优[13],然后训练得到预测模型。
1.8.3 预测模型验证评估 模型的评价采用Bootstrap重采样内部验证[14]。每次从130例患者样本数据集通过有放回重采样生成130例样本作为训练集,剩余49例未被采样的患者样本作为验证集,一共进行100次。为减少AUC评估值与真实值的偏差,采用0.632+方法对AUC值进行修正(optimism correction)[15],并通过修正AUC值分布的2.5%、97.5%分位数计算修正AUC值的95%置信区间(confidence interval,CI)[16]。统计分析模型在验证集的平均最佳界值(cutoff)、特异度、准确率、召回率和F1值。模型构建和验证流程如图1所示。沙普利可加性解释(shapley additive explanations,SHAP)算法对构建的最优模型进行可解释性分析。
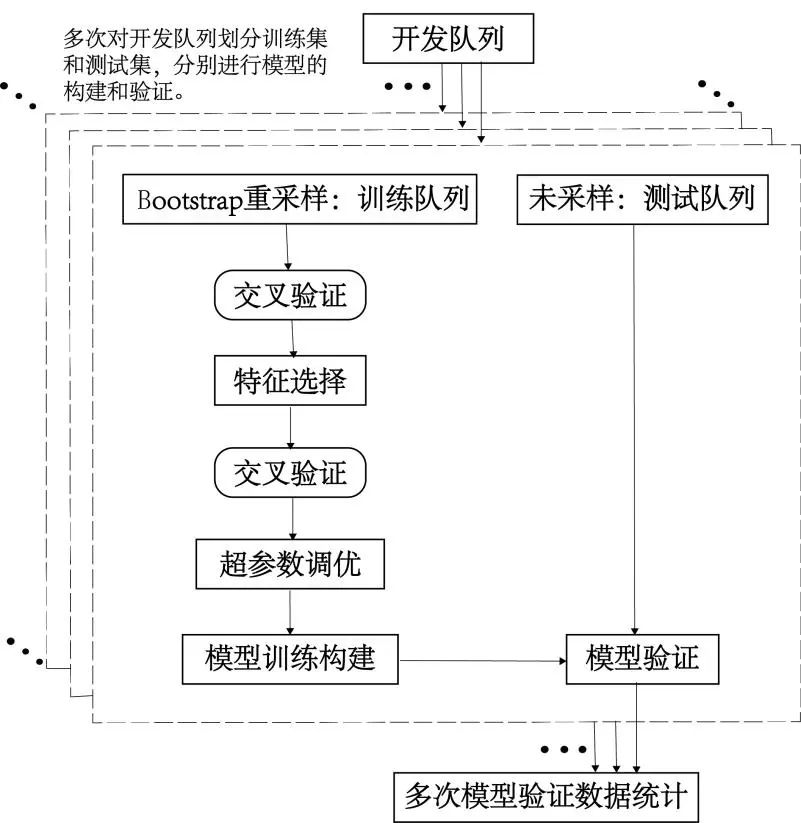
图1 预测模型构建和验证流程图Fig.1 Prediction model construction and validation flowchart
1.9 统计学方法
使用R语言(版本4.2.1)进行统计分析。连续变量年龄、Angle、LY30、CI以及分级变量NIHSS评分、Fazekas评级、PWMH评分、DWMH评分采用M(QL,QU)描述,并采用Kruskal-Wallis H检验比较差异;计数变量性别、高血压、高尿酸血症、糖尿病、高脂血症、卒中史、TOAST分型、院内用药方式采用χ2检验比较差异;连续变量MA和R符合正态分布,采用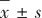 描述,采用单因素方差分析比较差异。AUC值差异比较采用DeLong检验。
描述,采用单因素方差分析比较差异。AUC值差异比较采用DeLong检验。
采用R语言(版本4.2.1)进行预测模型的建立和验证。采用randomforest、nnet和kknn程序包作为机器学习的算法引擎。采用tidymodels程序包实现模型的超参数调优、训练以及验证。采用kernelshap和shapviz程序包实现模型的SHAP值和解释性分析。
2 结果
2.1 患者按功能结果分组的一般临床资料比较
纳入130例AIS患者,中位数年龄67.0(58.0, 75.0)岁,其中男性81例(62.31%)。3个月后mRS<2分组患者87例(66.92%),mRS≥2分组患者43例(33.08%)。两组患者入院NIHSS评分、卒中史、Fazekas等级、PWMH评分、DWMH评分以及TEG指标MA、Angle和CI组间差异具有统计学意义(均P<0.05)。见表1。
表1 3个月后不同神经功能结果分组的急性缺血性卒中患者临床资料比较Tab.1 Comparison of clinical data of acute ischemic stroke patients with different neurological function outcomes after three months
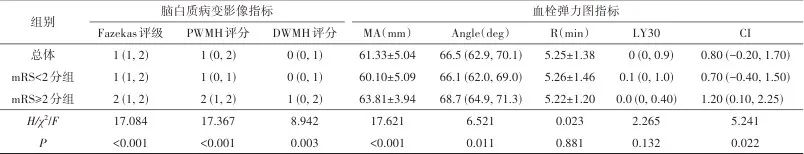
注:mRS,改良Rankin量表;NIHSS,美国国立卫生研究院卒中量表;TOAST,Org 10172急性卒中治疗试验;PWMH,脑室周围白质高信号;DWMH,深部白质高信号;MA,最大幅度;Angle,夹角;R,凝血因子反应时间;LY30,纤溶率;CI,凝血综合指数。非正态分布连续变量采用M(QL,QU)描述,计数变量采用例数(构成比)描述,符合正态分布连续变量采用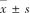 描述。
描述。
2.2 模型的验证和性能比较
所有模型测试集的AUC值符合正态分布。集合A的修正AUC值水平高于集合D(DeLong检验,P<0.05)的模型有LR模型[0.815(95%CI:0.700~0.890)vs. 0.716(95%CI:0.579~0.808)]、NNET模型[0.830(95%CI:0.731~0.894)vs. 0.717(95%CI:0.602~0.808)]和KNN模型[0.817(95%CI:0.713~0.885)vs. 0.677(95%CI:0.525~0.782)]。同时针对集合A,NNET模型的修正AUC值水平最高,NNET和KNN模型修正AUC值高于传统LR模型。见表2、3与图2。
表2 模型修正AUC值及其95%CI对比Tab.2 Comparison table of corrected AUC values and their 95% CI
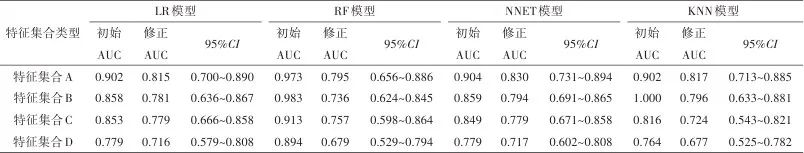
注:初始AUC值为训练集和验证集均为130患者样本的AUC值。
表3 基于不同特征集合模型的修正AUC值差异比较Tab.3 Significant comparison of AUC values for models based on different feature sets
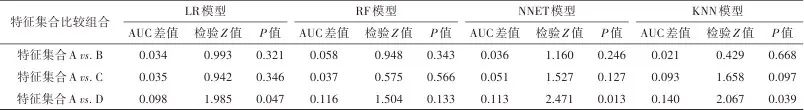
注:AUC值为修正值,差异性比较采用DeLong检验。
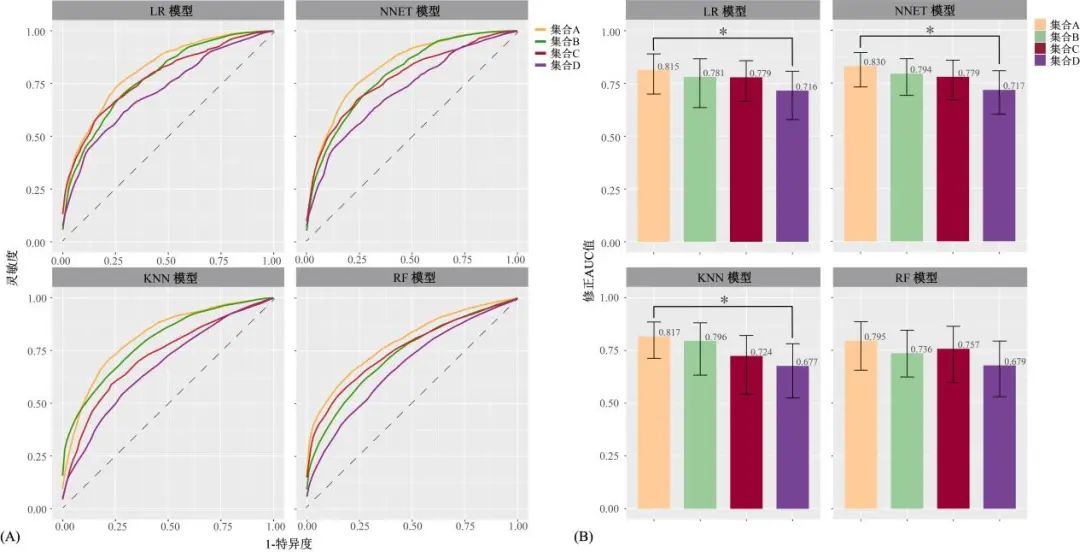
图2 基于不同特征集合模型的修正ROC曲线和修正AUC值及其95%CI对比图 (A)基于不同特征集合模型的修正ROC曲线对比;(B)基于不同特征集合模型的修正AUC值及其95%CI对比。*为DeLong检验AUC值差异有统计学意义(P<0.05)。Fig.2 Comparison chart of corrected ROC curves and corrected AUC values and their 95% CI for models based on different feature sets
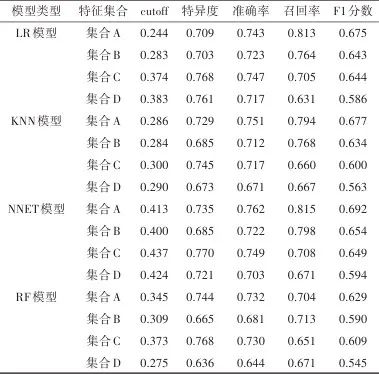
针对所有算法模型在验证集的性能,特征集合A的平均准确率、召回率和F1分数均优于特征集合D,特征集合A的F1分数均优于其他特征集合。见表4。
表4 模型测试集平均性能指标对比Tab.4 Comparison of average performance indicators of model test sets
2.3 最优模型构建和模型解释性分析
针对最优NNET算法和特征集合A,以130例患者样本构建不良功能预后(mRS评分≥2分)预测模型。通过10折交叉验证的LASSO回归进行预测特征筛选,见图3,19个特征中筛选出与预后不良相关,有重要预测价值的6个预测因子分别为NIHSS评分、卒中史、小动脉闭塞亚型、PWMH评分,以及TEG指标MA和LY30。
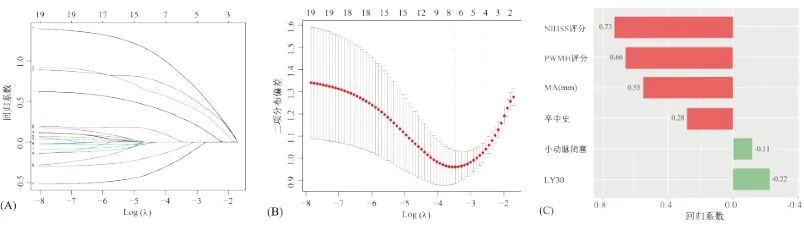
图3 基于10折交叉验证的LASSO回归的特征选择示意图 (A)回归系数路径图;(B)交叉验证曲线,最小二项分布偏差值对应的特征数量为6;(C)被筛选特征的LASSO回归系数。
Fig.3 Feature selection schematic diagram of LASSO regression based on 10-fold cross-validation
使用模型SHAP值分析对各特征量对模型决策的贡献度进行分析,贡献度前3的特征量分别为入院NIHSS评分、PWMH和MA。见图4。
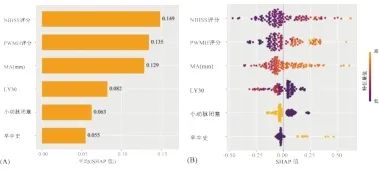
图4 NNET模型的SHAP值可解释性分析 (A)特征量平均SHAP绝对值,表征特征在模型预测时的效能;(B)特征量SHAP值散点图,如图中PWMH评分较高的SHAP值主要分布在正值区域,即PWMH评分与不良结果正相关。
Fig.4 Interpretability analysis of SHAP values of NNET model
3 讨论
本研究基于机器学习与传统 LR模型,结合TEG和WMH,建立并验证非心源性AIS患者功能预后模型。本研究采用能分别代表集成学习(ensemble learning)、基于实例的学习(instance-based learning)和深度学习(deep learning)3种机器学习算法大类的RF、KNN和NNET模型。模型用Bootstrap内部验证进行评估,小样本情况下评估性能优于传统交叉验证[17-18]。结果表明,联合TEG指标和WMH评分可提升非心源性AIS患者预后预测性能,NNET模型优于其他模型。
近年来,机器学习辅助疾病诊断等研究成为热点[19]。传统logistic回归模型适用于线性分类,机器学习可应对非线性问题、数据噪声和缺失值。一项meta研究表明机器学习算法预测准确度优于LR模型[20]。特征选择是机器学习重要步骤,可有效提升模型的算法效率和预测准确性。本研究通过10折LASSO回归筛选出6个与患者功能预后相关联的预测特征:NIHSS评分、卒中史、小动脉闭塞亚型、PWMH评分,以及TEG指标MA和LY30。SHAP值分析评估了各特征在模型决策过程中的重要性。
本研究结果表明WMH和TEG测得的凝血功能与患者功能预后相关,能提供重要预测信息,与以往的研究结果基本一致。WMH主要损害长程纤维功能[21],而长程纤维功能损伤介导了WMH对语言功能结果的负面影响[22],与AIS患者语言功能和神经功能结果相关[5, 23-24]。WMH可能通过破坏白质纤维束影响神经恢复的潜力[5]。潜在的病理生理途径可能包括降低脑血管反应性[25]、较差的侧支血供及低灌注[26]、神经元网络功能障碍、神经元连接性减少和血脑屏障破坏[5]。此外,WMH与不稳定斑块相关[27-28],可能增加不良事件风险。本研究发现PWMH评分预测效能相对DWMH评分更敏感。研究表明DWMH与较高的体质指数以及缺氧/缺血损伤相关,但与动脉压无关,而PWMH可能与较高的动脉压以及炎症代谢成分有关[13,29],这可能提示更严重的血管损伤和病变,增加了不良事件风险。
同时高凝是AIS的重要病因之一,在AIS患者中观察到TEG参数呈现高凝状态[30],并且凝血功能与病情的严重程度相关[31]。代表血小板活性的MA与血管内皮损伤[32]和颈部不稳定斑块[33]相关,其值较高增加了病情恶化和复发的风险。AIS患者R值低于健康对照组[9],与患者早期功能恶化和功能结果相关[11],但有研究[34]与本研究一致,未发现R值与AIS患者功能预后相关。目前少有关于TEG指标LY30与AIS神经功能预后相关性的研究,本研究模型的解释性分析表明LY30值与不良预后负相关,这可能是由于凝血和纤溶功能失衡是血栓形成的危险因素,增加AIS恶化和复发的风险[35]。既往研究表明AIS患者血浆的纤溶酶原激活物抑制剂(plasminogen activator inhibitor type 1,PAI-1)水平显著高于对照组和脑出血组[35-36]。在相似病因的动脉粥样硬化性心血管疾病患者中,MA、LY30与临床预后结果关系密切[37]。
本研究结果也表明NIHSS评分、TOAST分型和卒中史是AIS预后相关的重要预测因子。既往研究表明反映患者病情严重程度的NIHSS评分与AIS患者功能结果相关[13]。而有卒中史的患者可能由于既往的神经功能损伤而功能恢复受到影响,与不良预后相关[10, 12]。既往研究表明LAA型有更高的并发症和早期功能恶化风险[38],同时LAA型常见于岛叶受损患者,交感神经调节功能增加,副交感神经功能降低,增加了不良预后的风险[39]。
本研究局限和不足:没有区分卒中亚型进行分析,没有评估各预测特征对不同卒中亚型功能结果预测效能的差异;没有评估卒中发生的不同部位和区域(如是否存在良好侧支代偿)对功能结果的影响;此外,本研究样本量较少,且未进行外部验证,需进一步引入更多机器学习算法,以及卒中亚型和部位的影响等多种因素,采用大数据、多中心研究进行外部验证。
参考文献:
1. TSAO C W, ADAY A W, ALMARZOOQ Z I, et al. Heart disease and stroke statistics-2023 update: A report from the American Heart Association[J]. Circulation, 2023, 147(8): e93-e621.
2. FILLEY C M, FIELDS R D. White matter and cognition: Making the connection[J]. J Neurophysiol, 2016, 116(5): 2093-2104.
3. WARDLAW J M, SMITH C, DICHGANS M. Small vessel disease: mechanisms and clinical implications[J]. Lancet Neurol, 2019, 18(7): 684-696.
4. WANG Y, CAI X, LI H, et al. Association of intracranial atherosclerosis with cerebral small vessel disease in a community-based population[J]. Eur J Neurol, 2023, 30(9): 2700-2712.
5. BONKHOFF A K, HONG S, BRETZNER M, et al. Association of stroke lesion pattern and white matter hyperintensity burden with stroke severity and outcome[J]. Neurology, 2022, 99(13): e1364-e1379.
6. LEONARDS C O, IPSEN N, MALZAHN U, et al. White matter lesion severity in mild acute ischemic stroke patients and functional outcome after 1 year[J]. Stroke, 2012, 43(11): 3046-3051.
7. LUIJTEN S P R, BOS D, COMPAGNE K C J, et al. Association of white matter lesions and outcome after endovascular stroke treatment[J]. Neurology, 2021, 96(3): e333-e342.
8. WHITTON T P, HEALY W J. Review of thromboelastography (TEG): Medical and surgical applications[J]. Ther Adv Pulm Crit Care Med, 2023, 18: 29768675231208426.
9. LIU Z, CHAI E, CHEN H, et al. Comparison of thrombelastography (TEG) in patients with acute cerebral hemorrhage and cerebral infarction[J]. Med Sci Monit, 2018, 24: 6466-6471.
10. YAO X, DONG Q, SONG Y, et al. Thrombelastography maximal clot strength could predict one-year functional outcome in patients with ischemic stroke[J]. Cerebrovasc Dis, 2014, 38(3): 182-190.
11. RYU J C, BAE J H, HA S H, et al. Hypercoagulability on thromboelastography can predict the functional outcomes in patients with acute ischemic stroke[J]. Thromb Haemost, 2023, 123(12): 1180-1186.
12. 上官艺, 王孟, 王春娟, 等. 基于机器学习的缺血性卒中功能预后预测模型研究[J]. 中国卒中杂志, 2021, 16(9): 895-900.
13. WANG X, LYU J, MENG Z, et al. Small vessel disease burden predicts functional outcomes in patients with acute ischemic stroke using machine learning[J]. CNS Neurosci Ther, 2023, 29(4): 1024-1033.
14. 王俊峰, 章仲恒, 周支瑞, 等. 临床预测模型:模型的验证[J]. 中国循证心血管医学杂志, 2019, 11(2): 141-144.
15. SAHINER B, CHAN H P, HADJIISKI L. Classifier performance prediction for computer-aided diagnosis using a limited dataset[J]. Med Phys, 2008, 35(4): 1559-1570.
16. NOMA H, SHINOZAKI T, IBA K, et al. Confidence intervals of prediction accuracy measures for multivariable prediction models based on the bootstrap-based optimism correction methods[J]. Stat Med, 2021, 40(26): 5691-5701.
17. STEYERBERG E W, HARRELL F E JR, BORSBOOM G J, et al. Internal validation of predictive models: Efficiency of some procedures for logistic regression analysis[J]. J Clin Epidemiol, 2001, 54(8): 774-781.
18. COLEY R Y, LIAO Q, SIMON N, et al. Empirical evaluation of internal validation methods for prediction in large-scale clinical data with rare-event outcomes: A case study in suicide risk prediction[J]. BMC Med Res Methodol, 2023, 23(1): 33.
19. 周嫱, 柏娜, 刘生刚, 等. 基于生物信息学和机器学习方法探索缺血性脑卒中关键风险基因[J]. 中国神经精神疾病杂志, 2022, 48(9): 525-532.
20. LI X, CHEN Z, JIAO H, et al. Machine learning in the prediction of post-stroke cognitive impairment: A systematic review and meta-analysis[J]. Front Neurol, 2023, 14: 1211733.
21. QUANDT F, FISCHER F, SCHRÖDER J, et al. Higher white matter hyperintensity lesion load is associated with reduced long-range functional connectivity[J]. Brain Commun, 2020, 2(2): fcaa111.
22. WILMSKOETTER J, MAREBWA B, BASILAKOS A, et al. Long-range fibre damage in small vessel brain disease affects aphasia severity[J]. Brain, 2019, 142(10): 3190-3201.
23. WRIGHT A, TIPPETT D, SAXENA S, et al. Leukoaraiosis is independently associated with naming outcome in poststroke aphasia[J]. Neurology, 2018, 91(6): e526-e532.
24. VARKANITSA M, PEñALOZA C, CHARIDIMOU A, et al. White matter hyperintensities predict response to language treatment in poststroke aphasia[J]. Neurorehabil Neural Repair, 2020, 34(10): 945-953.
25. SAM K, PELTENBURG B, CONKLIN J, et al. Cerebrovascular reactivity and white matter integrity[J]. Neurology, 2016, 87(22): 2333-2339.
26. MARSTRAND J R, GARDE E, ROSTRUP E, et al. Cerebral perfusion and cerebrovascular reactivity are reduced in white matter hyperintensities[J]. Stroke, 2002, 33(4): 972-976.
27. MORONI F, AMMIRATI E, MAGNONI M, et al. Carotid atherosclerosis, silent ischemic brain damage and brain atrophy: A systematic review and meta-analysis[J]. Int J Cardiol, 2016, 223: 681-687.
28. LEE S J, KIM J S, CHUNG S W, et al. White matter hyperintensities (WMH) are associated with intracranial atherosclerosis rather than extracranial atherosclerosis[J]. Arch Gerontol Geriatr, 2011, 53(2): e129-e132.
29. CHANG T C, CHEN Y C, HUANG Y C, et al. Systemic oxidative stress and cognitive function in Parkinson’s disease with different PWMH or DWMH lesions[J]. BMC Neurol, 2021, 21(1): 16.
30. ELLIOTT A, WETZEL J, ROPER T, et al. Thromboelastography in patients with acute ischemic stroke[J]. Int J Stroke, 2015, 10(2): 194-201.
31. WIŚNIEWSKI A, KARCZMARSKA-WóDZKA A, SIKORA J, et al. Hypercoagulability as measured by thrombelastography may be associated with the size of acute ischemic infarct-A pilot study[J]. Diagnostics (Basel), 2021, 11(4): 712.
32. LORDAN R, TSOUPRAS A, ZABETAKIS I. Investigation of platelet aggregation in atherosclerosis[J]. Methods Mol Biol, 2022, 2419: 333-347.
33. LI J, WU H, HAO Y, et al. Unstable carotid plaque is associated with coagulation function and platelet activity evaluated by thrombelastography[J]. J Stroke Cerebrovasc Dis, 2019, 28(11): 104336.
34. 张玉峰, 陈兵, 井峰. 血栓弹力图在脑梗死预后中的价值[J]. 中国康复理论与实践, 2019, 25(4): 460-464.
35. LINDGREN A, LINDOFF C, NORRVING B, et al. Tissue plasminogen activator and plasminogen activator inhibitor-1 in stroke patients[J]. Stroke, 1996, 27(6): 1066-1071.
36. AKHTER M S, BISWAS A, ABDULLAH S M, et al. The role of PAI-1 4G/5G promoter polymorphism and its levels in the development of ischemic stroke in young Indian population[J]. Clin Appl Thromb Hemost, 2017, 23(8): 1071-1076.
37. LEE S H, KIM H K, AHN J H, et al. Prognostic impact of hypercoagulability and impaired fibrinolysis in acute myocardial infarction[J]. Eur Heart J, 2023, 44(19): 1718-1728.
38. GRAU A J, WEIMAR C, BUGGLE F, et al. Risk factors, outcome, and treatment in subtypes of ischemic stroke: The German stroke data bank[J]. Stroke, 2001, 32(11): 2559-2566.
39. CHEN P L, KUO T B, YANG C C. Parasympathetic activity correlates with early outcome in patients with large artery atherosclerotic stroke[J]. J Neurol Sci, 2012, 314(1-2): 57-61.
【引用格式】夏敏,黄国祥,王建力,等. 基于机器学习联合血栓弹力图和脑白质病变的非心源性缺血性卒中功能预后预测模型研究[J]. 中国神经精神疾病杂志,2024,50(12):726-734.
【Cite this article】XIA M,HUANG G X,WANG J L ,et al.Research on functional prognosis prediction model of non-cardiac ischemic stroke based on machine learning, thromboelastography and white matter lesions[J]. Chin J Nervous Mental Dis,2024,50(12):726-734.
DOI:10.3969/j.issn.1002-0152.2024.12.004


