老年认知功能障碍患者营养风险预测模型的建立
时间:2025-02-02 12:09:26 热度:37.1℃ 作者:网络
认知功能障碍根据严重程度,可以分为轻度认知功能障碍(mild cognitive impairment,MCI)和痴呆,痴呆的核心是获得性认知功能的损伤,导致患者的学习、生活、工作和社会交往能力显著下降[1]。一项纵向队列研究表明[2],营养不良是导致认知功能减退的一个危险因素。相较于认知功能正常的患者,轻度认知损害和阿尔茨海默病(Alzheimer disease,AD)患者有更高的营养不良发生率[3-7]。因此,认知功能障碍患者营养风险的早期筛查非常重要,可以指导临床医师给予患者合理、及时的干预措施。诊断营养不良的第一步是使用有效的工具进行营养筛查,目前尚无统一的诊断标准,现临床上普遍使用营养风险筛查2002(nutritional risk screening 2002,NRS2002)、微型营养评价(mini-nutritional assessment,MNA)作为住院患者的营养筛查工具。由于老年人是一个特殊的群体,许多筛查方式不适用,迄今为止,暂未有适用于筛查认知障碍患者营养风险的金标准。本研究中使用的营养评估工具是NRS2002、控制营养状况评分(controlling nutritional status score,CONUT)[8]、老年营养风险指数(geriatric nutritional risk index,GNRI)[4]。CONUT与GNRI是近年来出现的客观性营养筛查工具,具有简易、低成本、较全面等优势,已经广泛应用于其他疾病营养筛查,并与国内外认可的营养筛查工具进行有效性比较,结果受到肯定。本研究初步尝试建立老年认知功能障碍患者的营养风险预测模型,期望可以作为有效工具协助评估认知功能障碍患者住院期间的营养状态,为进一步完善预后评估及营养治疗方案调整提供理论依据。
1 对象与方法
1.2 研究方法
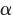 =0.05。
=0.05。2 结果
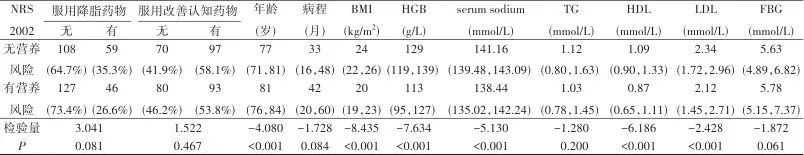
注:BMI,体质指数;ADL,日常生活能力评定;HGB,血红蛋白;serum sodium,血清钠;TG,甘油三酯;HDL,高密度脂蛋白;LDL,低密度脂蛋白;FBG,空腹血糖。
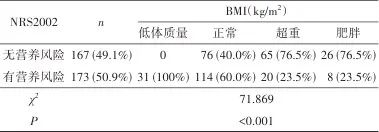
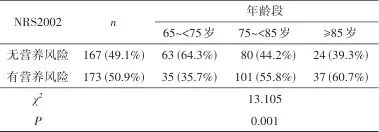
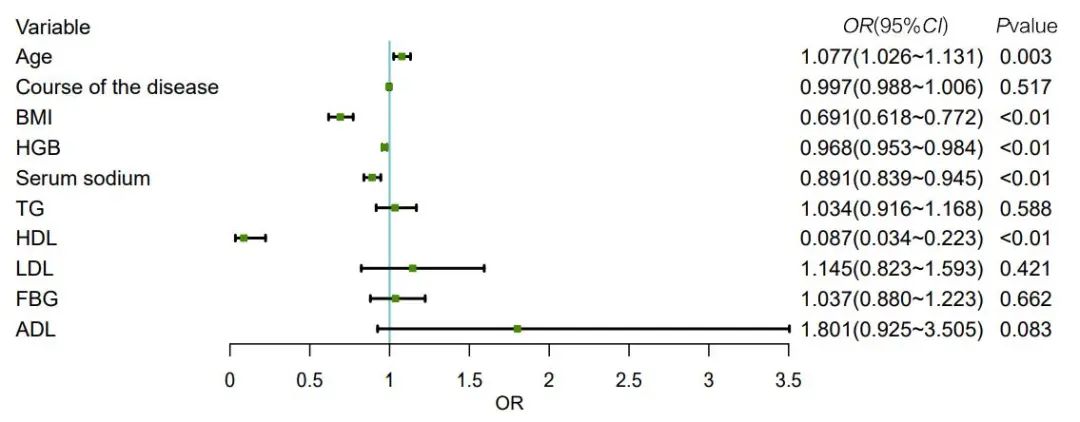
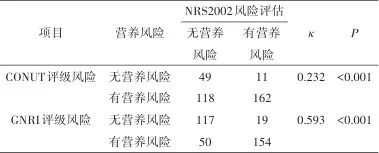
2.6 老年认知功能障碍患者营养风险预测模型的建立
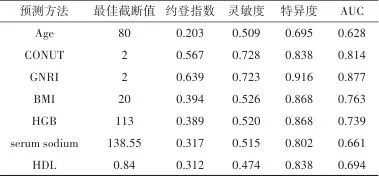
注:Age,年龄;CONUT,控制营养状况评分;GNRI,老年营养风险指数;BMI,体质指数;HGB,血红蛋白;serum sodium,血清钠;HDL,高密度脂蛋白。
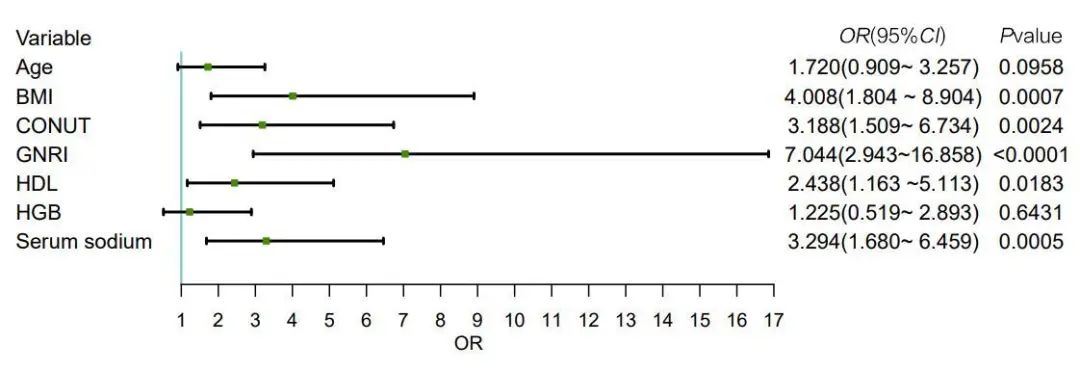
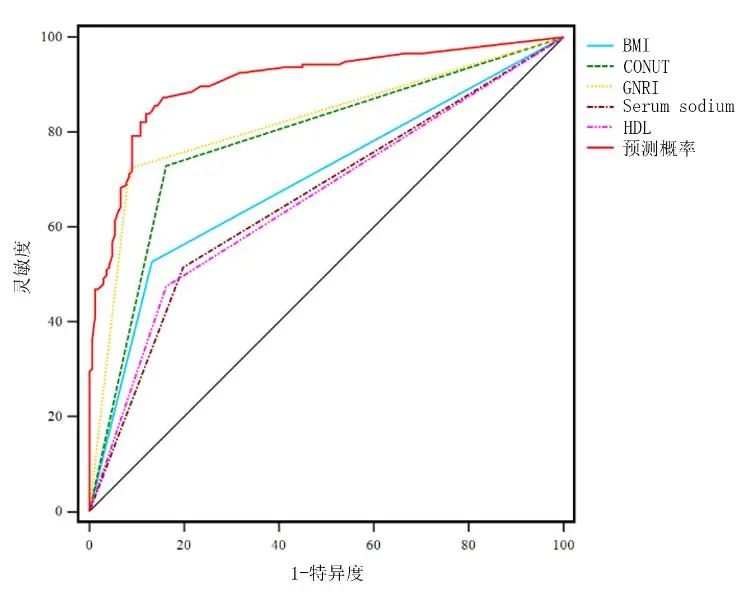

3 讨论

1. 陈晓春, 张杰文, 贾建平, 等. 2018中国痴呆与认知障碍诊治指南(一): 痴呆及其分类诊断标准[J]. 中华医学杂志, 2018, 98(13): 965-970.
2. KÖHLER C A, MAGALHAES T F, OLIVEIRA J M, et al. Neuropsychiatric disturbances in mild cognitive impairment (MCI): A systematic review of population-based studies[J]. Curr Alzheimer Res, 2016, 13(10): 1066-1082.
3. KIMURA A, SUGIMOTO T, KITAMORI K, et al. Malnutrition is associated with behavioral and psychiatric symptoms of dementia in older women with mild cognitive impairment and early-stage Alzheimer’s disease[J]. Nutrients, 2019, 11(8): 1951.
4. XIONG J, WANG M, ZHANG Y, et al. Association of geriatric nutritional risk index with mortality in hemodialysis patients: A meta-analysis of cohort studies[J]. Kidney Blood Press Res, 2018, 43(6): 1878-1889.
5. SAGHAFI-ASL M, VAGHEF-MEHRABANY E, KARAMZAD N, et al. Geriatric nutritional risk index as a simple tool for assessment of malnutrition among geriatrics in Northwest of Iran: Comparison with mini nutritional assessment[J]. Aging Clin Exp Res, 2018, 30(9): 1117-1125.
6. LARA-PULIDO A, GUEVARA-CRUZ M. Malnutrition and associated factors in elderly hospitalized[J]. Nutr Hosp, 2012, 27(2): 652-655.
7. 陈志朋, 刘雪梅, 周晓花, 等. 老年脑卒中患者营养风险指数对30天非计划再入院的预测价值[J].神经疾病与精神卫生,2023, 23(11): 780-786.
8. IGNACIO DE ULÍBARRI J, GONZÁLEZ-MADROÑO A, DE VILLAR N G, et al. CONUT: A tool for controlling nutritional status. First validation in a hospital population[J]. Nutr Hosp, 2005, 20(1): 38-45.
9. KONDRUP J, ALLISON S P, ELIA M, et al. ESPEN guidelines for nutrition screening 2002[J]. Clin Nutr, 2003, 22(4): 415-421.
10. 陈旭娇, 严静, 王建业, 等. 中国老年综合评估技术应用专家共识[J]. 中华老年病研究电子杂志, 2017, 4(2): 1-6.
11. MANTZOROU M, VADIKOLIAS K, PAVLIDOU E, et al. Nutritional status is associated with the degree of cognitive impairment and depressive symptoms in a Greek elderly population[J]. Nutr Neurosci, 2020, 23(3): 201-209.
12. 中华医学会肠外肠内营养学分会老年营养支持学组, 韦军民, 陈伟, 等. 老年患者肠外肠内营养支持中国专家共识[J]. 中华老年医学杂志, 2013, 32(9): 913-929.
13. BIANCHI V E, HERRERA P F, LAURA R. Effect of nutrition on neurodegenerative diseases. A systematic review[J]. Nutr Neurosci, 2021, 24(10): 810-834.
14. COVA I, CLERICI F, MAGGIORE L, et al. Body mass index predicts progression of mild cognitive impairment to dementia[J]. Dement Geriatr Cogn Disord, 2016, 41(3-4): 172-180.
15. HANSON L C, ERSEK M, LIN F C, et al. Outcomes of feeding problems in advanced dementia in a nursing home population[J]. J Am Geriatr Soc, 2013, 61(10): 1692-1697.
16. GIBBS J, CULL W, HENDERSON W, et al. Preoperative serum albumin level as a predictor of operative mortality and morbidity: results from the National VA Surgical Risk Study[J]. Arch Surg, 1999, 134(1): 36-42.
17. REUBEN D B, IX J H, GREENDALE G A, et al. The predictive value of combined hypoalbuminemia and hypocholesterolemia in high functioning community-dwelling older persons: Macarthur studies of successful aging[J]. J Am Geriatr Soc, 1999, 47(4): 402-406.
18. SHRONTS E P. Basic concepts of immunology and its application to clinical nutrition[J]. Nutr Clin Pract, 1993, 8(4): 177-183.
19. CABRÉ M, FERREIRO C, ARUS M, et al. Evaluation of CONUT for clinical malnutrition detection and short-term prognostic assessment in hospitalized elderly people[J]. J Nutr Health Aging, 2015, 19(7): 729-733.
20. ABD-EL-GAWAD W M, ABOU-HASHEM R M, EL MARAGHY M O, et al. The validity of geriatric nutrition risk index: Simple tool for prediction of nutritional-related complication of hospitalized elderly patients. Comparison with mini nutritional assessment[J]. Clin Nutr, 2014, 33(6): 1108-1116.
21. SUN B, ZHAO Y, LU W, et al. The relationship of malnutrition with cognitive function in the older Chinese population: Evidence from the Chinese longitudinal healthy longevity survey study[J]. Front Aging Neurosci, 2021, 13: 766159.
22. HAO X, LI D, ZHANG N. Geriatric Nutritional Risk Index as a predictor for mortality: A meta-analysis of observational studies[J]. Nutr Res, 2019, 71: 8-20.
23. XIE H, TANG S, WEI L, et al. Geriatric nutritional risk index as a predictor of complications and long-term outcomes in patients with gastrointestinal malignancy: A systematic review and meta-analysis[J]. Cancer Cell Int, 2020, 20(1): 530.
24. ZHAO Q, ZHANG T Y, CHENG Y J, et al. Impacts of geriatric nutritional risk index on prognosis of patients with non-ST-segment elevation acute coronary syndrome: Results from an observational cohort study in China[J]. Nutr Metab Cardiovasc Dis, 2020, 30(10): 1685-1696.
25. FUJISAWA H, SUGIMURA Y, TAKAGI H, et al. Chronic hyponatremia causes neurologic and psychologic impairments[J]. J Am Soc Nephrol, 2016, 27(3): 766-780.
26. GOSCH M, JOOSTEN-GSTREIN B, HEPPNER H J, et al. Hyponatremia in geriatric inhospital patients: Effects on results of a comprehensive geriatric assessment[J]. Gerontology, 2012, 58(5): 430-440.
27. JIANG Q, LEE C Y, MANDREKAR S, et al. ApoE promotes the proteolytic degradation of Abeta[J]. Neuron, 2008, 58(5): 681-693.
28. REITZ C, TANG M X, SCHUPF N, et al. Association of higher levels of high-density lipoprotein cholesterol in elderly individuals and lower risk of late-onset Alzheimer disease[J]. Arch Neurol, 2010, 67(12): 1491-1497.
29. KOCH M, JENSEN M K. HDL-cholesterol and apolipoproteins in relation to dementia[J]. Curr Opin Lipidol, 2016, 27(1): 76-87.
【引用格式】王倩,苗海军,陈巍,等. 老年认知功能障碍患者营养风险预测模型的建立[J]. 中国神经精神疾病杂志,2024,50(12):711-718.
【Cite this article】WANG Q,MIAO H J,CHEN W,et al.Establishment of a nutritional risk prediction model for elderly patients with cognitive impairment[J]. Chin J Nervous Mental Dis,2024,50(12):711-718.
DOI:10.3969/j.issn.1002-0152.2024.12.002
声明:本文作者享有本文著作权,《中国神经精神疾病杂志》专有本文出版权和信息网络传播权,转载请注明作者与出处。部分图转自网络。


