Circ Res 封面文章:浙江大学韩佩东团队发现Vps4a介导的心肌细胞膜修复是抵御心脏损伤的重要机制
时间:2025-02-02 12:08:17 热度:37.1℃ 作者:网络
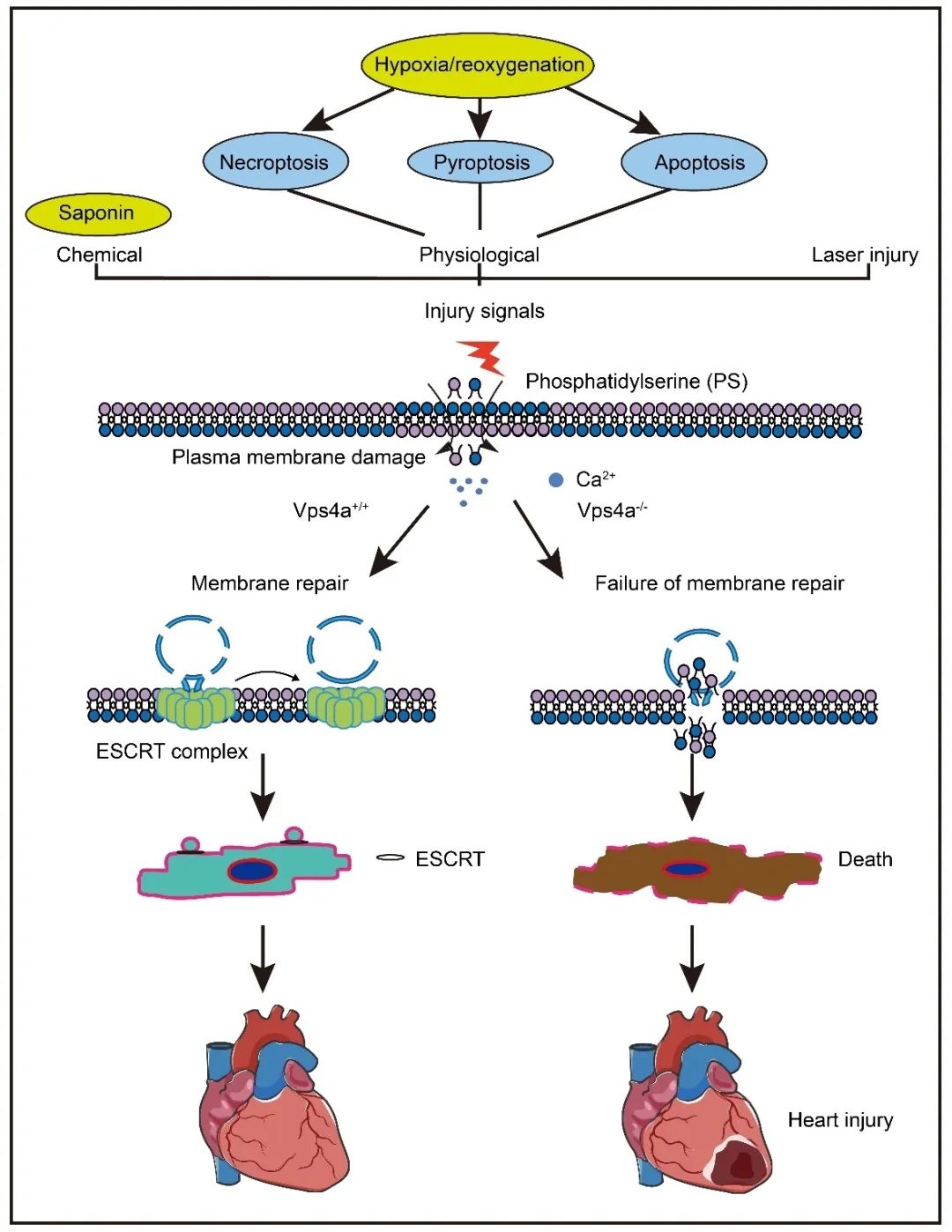
急性心梗是威胁人类健康的重大疾病。冠状动脉介入治疗在挽救急性心梗患者生命中发挥了重要作用。但是介入治疗往往伴随着心脏再灌注损伤,进而提升了患者发生心衰的风险。因此,靶向心脏缺血-再灌注(Ischemia/reperfusion)损伤,具有重要的科学价值和社会意义。之前的研究发现,心脏损伤会激活多种细胞死亡方式,包括程序性坏死、焦亡、凋亡、铁死亡等。干预心肌细胞死亡也被认为是减轻心脏损伤的重要策略。但是,在心脏中是否存在统一的、内源性的机制来抵御这些不同类型的细胞死亡,是领域内长期以来尚未解决的问题。
2025年1月31日,浙江大学韩佩东研究团队在Circulation Research发表了题为“Vps4a Mediates a Unified Membrane Repair Machinery to Attenuate Ischemia/Reperfusion Injury”的封面文章,发现心肌细胞膜的破损和重塑是多种细胞死亡方式中统一存在的机制,而提升Vps4a介导的心肌细胞膜修复能力会显著降低细胞死亡率进而发挥心脏保护作用。

研究人员首先构建了心脏缺血-再灌注动物模型,以及药物诱导的心肌细胞不同死亡方式模型,通过透射电镜和Annexin V染料标记实验,发现细胞膜的局部破损是心肌细胞发生应激反应时广泛存在的现象。在细胞膜动态重塑过程中,可以观察到Vps4a聚集到损伤的部位。Vps4a是一种AAA-ATPase,属于转运必需内体分选复合物(Endosomal Sorting Complex Required for Transport, ESCRT)家族的关键组分,在监测真核细胞质膜完整性上发挥了关键性的作用。但是,其在心肌细胞中的功能尚不清楚。
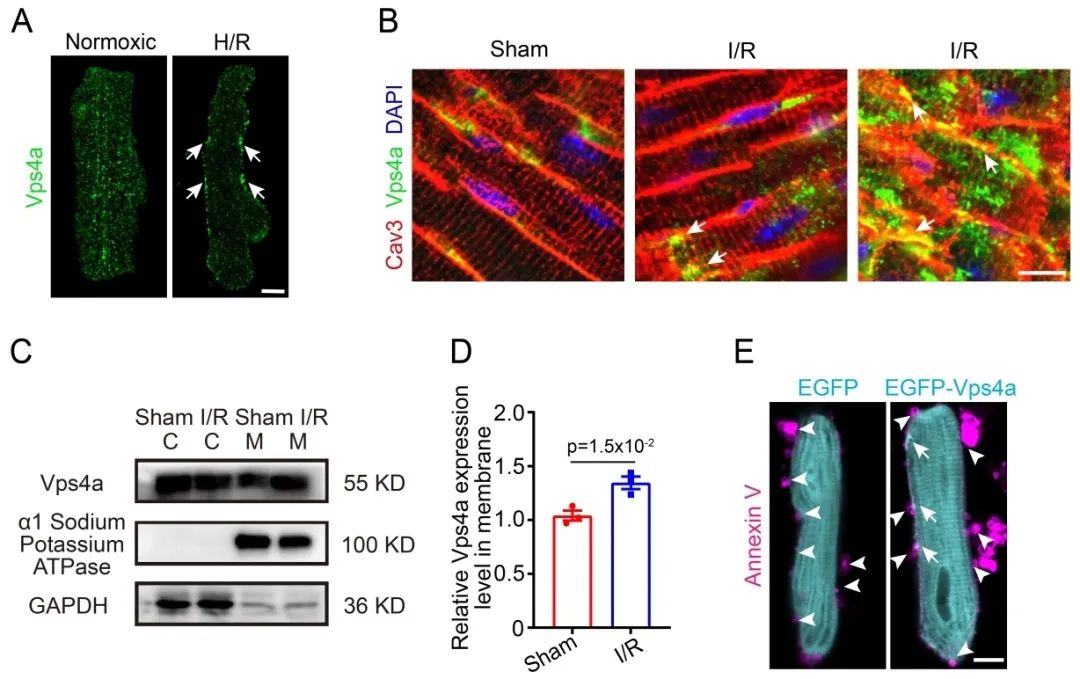
通过构建心肌细胞特异性Vps4a敲除模型,发现Vps4a的缺失并不影响心脏的发育和成熟过程。但是在心脏缺血-再灌注损伤的情况下,Vps4a的缺失引起了细胞膜修复功能的降低,进而导致细胞死亡率明显增加。反之,心肌细胞特异性过表达Vps4a则增强了心脏对损伤的抵抗性。由于Vps4a广泛参与了细胞质膜和内膜的动态重塑过程,为了明确Vps4a基因敲除后在应激状态下心肌细胞死亡率增加是膜修复功能障碍的直接后果,作者构建了Ripk3和Vps4a双基因敲除小鼠。Ripk3是程序性坏死过程中在质膜形成孔洞的关键组分。实验结果发现Ripk3和Vps4a双基因敲除能够显著减少质膜损伤和细胞死亡,进一步证明Vps4a介导的心脏保护是通过修复受损质膜来实现的。
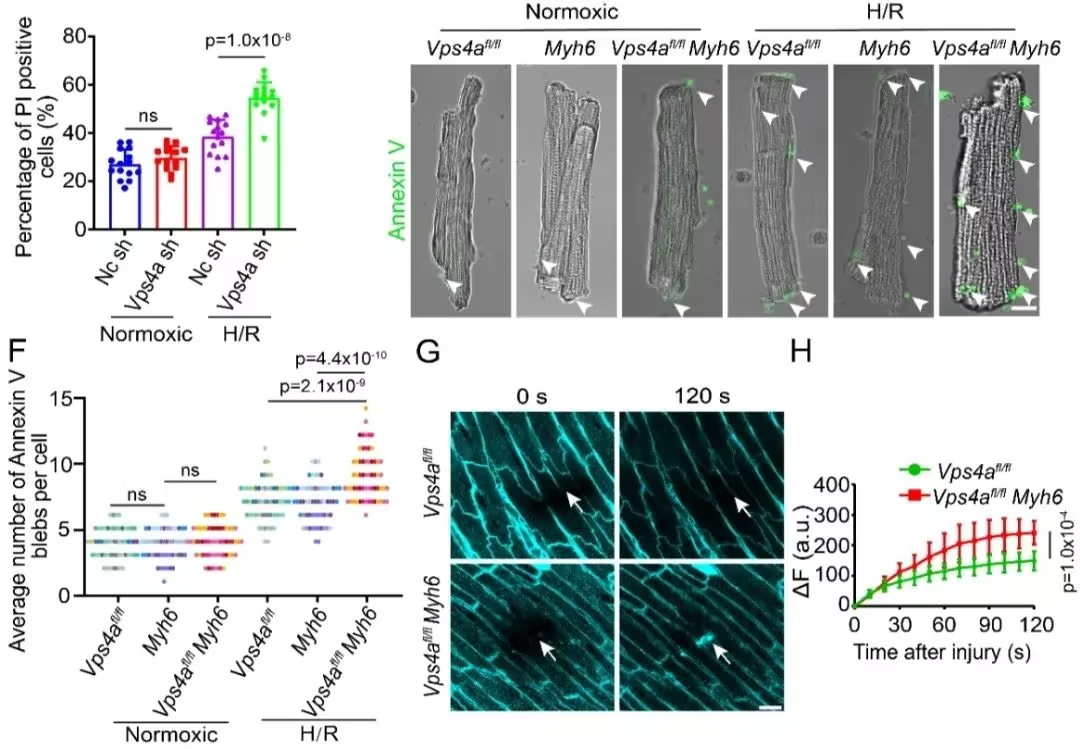
在真核细胞中,质膜破损后钙离子内流是激活膜修复的关键性触发信号。通过对钙离子响应蛋白的筛选,发现Alix介导了心肌细胞中钙信号的转导过程。然后Alix进一步招募Ist1和Vps4a到损伤部位。这个信号传递过程与包括骨骼肌在内的其它细胞不同,揭示了心肌细胞中存在一套独特的膜修复系统来抵御损伤。最后,运用长时程活细胞成像,作者发现Vps4a被招募到细胞膜损伤部位后,将破损的细胞膜封闭,并将破损的质膜剪切并排出细胞外,从而完成细胞膜的修复以降低细胞对外界环境的通透性。这个过程需要Vps4a的ATPase活性以及ATP供能。而突变Vps4a的酶活位点,以及降低细胞中ATP含量,都影响了质膜的修复过程。总之,该研究揭示了心肌细胞中存在着一种统一的、内源性的机制来抵御不同类型的细胞死亡,该发现为降低心梗治疗过程中的细胞死亡提供了一种潜在的策略。
浙江大学韩佩东研究员为本文通讯作者。浙江大学国际健康研究院博士后黄孝志、浙江大学医学院博士生张佳音为文章共同第一作者。该研究获得国家重点研发计划、国家自然科学基金项目资助。韩佩东研究员长期关注心脏发育和疾病研究,近年来以通讯作者在Circulation Research 2025、Circulation 2024、Elife 2024、J Mol Cell Cardiol 2024等期刊发表研究工作。
原文链接:
https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.124.325290


