最新Science!治理肺动脉高压
时间:2025-01-27 12:08:25 热度:37.1℃ 作者:网络
溶酶体如何调节肺动脉高压尚不完整
血管炎症调节血管疾病状态下内皮细胞(EC)的完整性和功能,包括动脉粥样硬化、高血压、中风和脓毒症。在肺内,内皮炎症是急性肺损伤、病原体介导的过程和肺动脉高压(肺动脉高压)的一个特征。肺动脉高压是一种致命的、神秘的、慢性进行性疾病,其特征是血管重塑和不明确的分子起源。最近的关注和争论集中在EC炎症是控制疾病严重程度的一个致病因素,而不是一个旁观者。然而,二者的相互作用仍不清楚。
溶酶体生物学和羟甾醇过程与内皮炎症和肺动脉高压存在联系
在这项研究中,匹兹堡大学Stephen Y. Chan课题组发现内皮细胞核受体共激活因子7 (NCOA7)缺乏通过溶酶体失调产生氧甾醇和胆汁酸信号,促进内皮病理表型。这种氧甾醇特征与与人类肺动脉高压死亡率相关的等离子体代谢物特征重叠。缺乏内皮细胞NCOA7或暴露于炎性胆汁酸的小鼠出现恶化的肺动脉高压。NCOA7缺乏的遗传易感性是由单核苷酸多态性rs11154337驱动的,这改变了内皮细胞的免疫激活,并与人类肺动脉高压的死亡率有关。NCOA7激活剂逆转内皮免疫激活和啮齿动物肺动脉高压。因此,作者建立了一种遗传和代谢模式,将溶酶体生物学和羟甾醇过程与内皮炎症和肺动脉高压联系起来。相关工作以“Lysosomal dysfunction and inflammatory sterol metabolism in pulmonary arterial hypertension”为题发表在Science。

【文章要点】
一、NCOA7在细胞、动物和人类肺动脉高压病例中的趋同炎症调节
本研究探讨了溶酶体功能障碍和氧化类固醇以及胆汁酸生成之间的关系,并试图确定触发内皮细胞(EC)功能障碍和肺动脉高压(PAH)的因素如何调控溶酶体行为。基于对人肺动脉内皮细胞(PAEC)的转录组学分析,发现炎症因子IL-1β可上调溶酶体调控基因和V-ATPase亚基的表达,同时诱导NCOA7 full和NCOA7 short两种异构体表达增加。在IL-6转基因PAH小鼠模型和人PAH肺组织中,NCOA7在肺血管内皮和肌成纤维层中表达明显增加,尤其在内皮细胞中。进一步机制分析表明,炎症性转录因子NF-κB的RelA/p65亚基可结合NCOA7启动子区域,调控其转录表达。作者提出,NCOA7可能作为一种调节性因子,在炎症条件下发挥保护作用,抑制内皮细胞免疫激活,从而缓解PAH的发展。总的来说,这项研究阐明了溶酶体功能调控在PAH发病机制中的重要性,并发现NCOA7可能是一个潜在的治疗靶点。
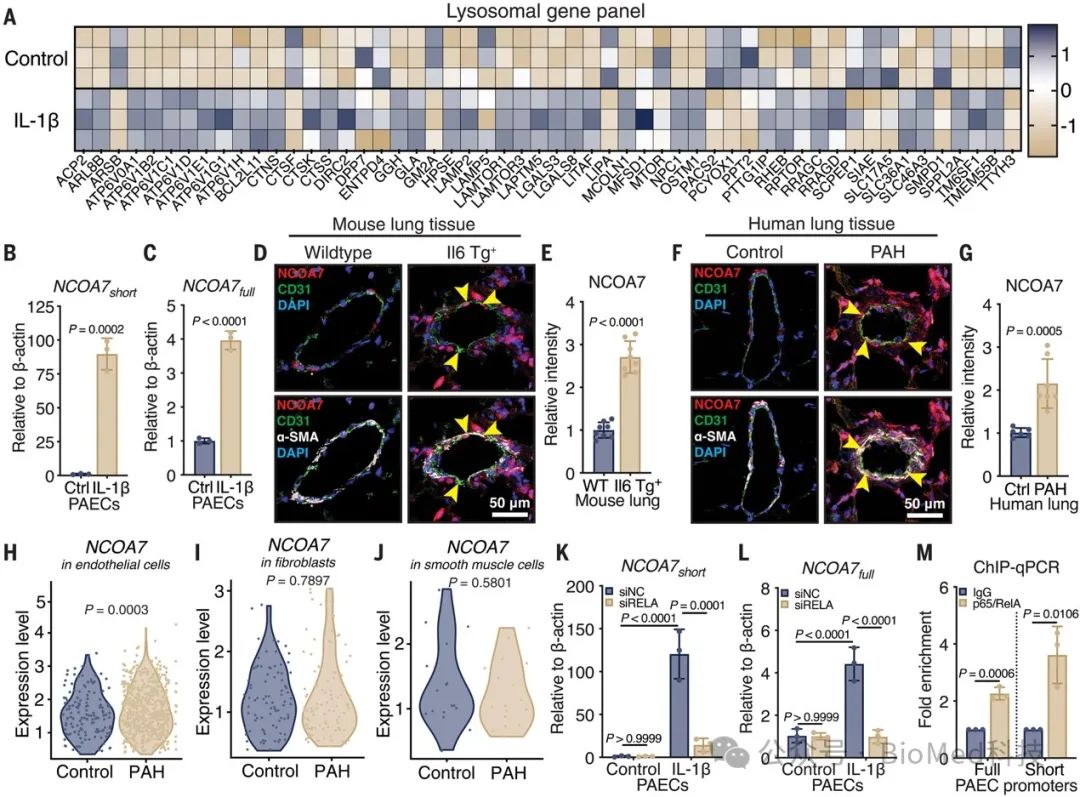
图1 NCOA7在细胞、动物和人类肺动脉高压病例中的趋同炎症调节
二、NCOA7缺乏重编程甾醇代谢,上调氧化甾醇和胆汁酸
转录组分析发现,NCOA7缺失导致人肺动脉内皮细胞(PAEC)中与胆固醇合成相关的生物过程被抑制。NCOA7缺失降低了低密度脂蛋白受体(LDLR)的表达,并抑制了细胞对胆固醇的摄取,导致胞内总胆固醇水平升高。但对于胆固醇后续合成中间体的水平没有影响,表明NCOA7主要通过调节胆固醇的lipoprotein介导的利用过程。NCOA7缺失上调了胆固醇25-羟化酶(CH25H)的表达,增加了25-羟胆固醇、27-羟胆固醇等多种羟化型胆固醇(氧化型胆固醇)的产生。这些氧化型胆固醇可作为胆固醇的溶解性代谢产物,并进一步转化为一系列胆酸衍生物,这些代谢产物在NCOA7缺失的PAEC中也显著增加。上述结果表明,NCOA7在调节PAEC中胆固醇代谢稳态平衡中起关键作用,通过影响胆固醇的利用、氧化以及后续胆酸代谢等过程。综上所述,NCOA7缺失导致的溶酶体功能障碍会引起内皮细胞中胆固醇代谢失衡,产生大量氧化型胆固醇和胆酸衍生物,这可能是NCOA7在肺动脉高压发病机制中发挥作用的重要途径之一。
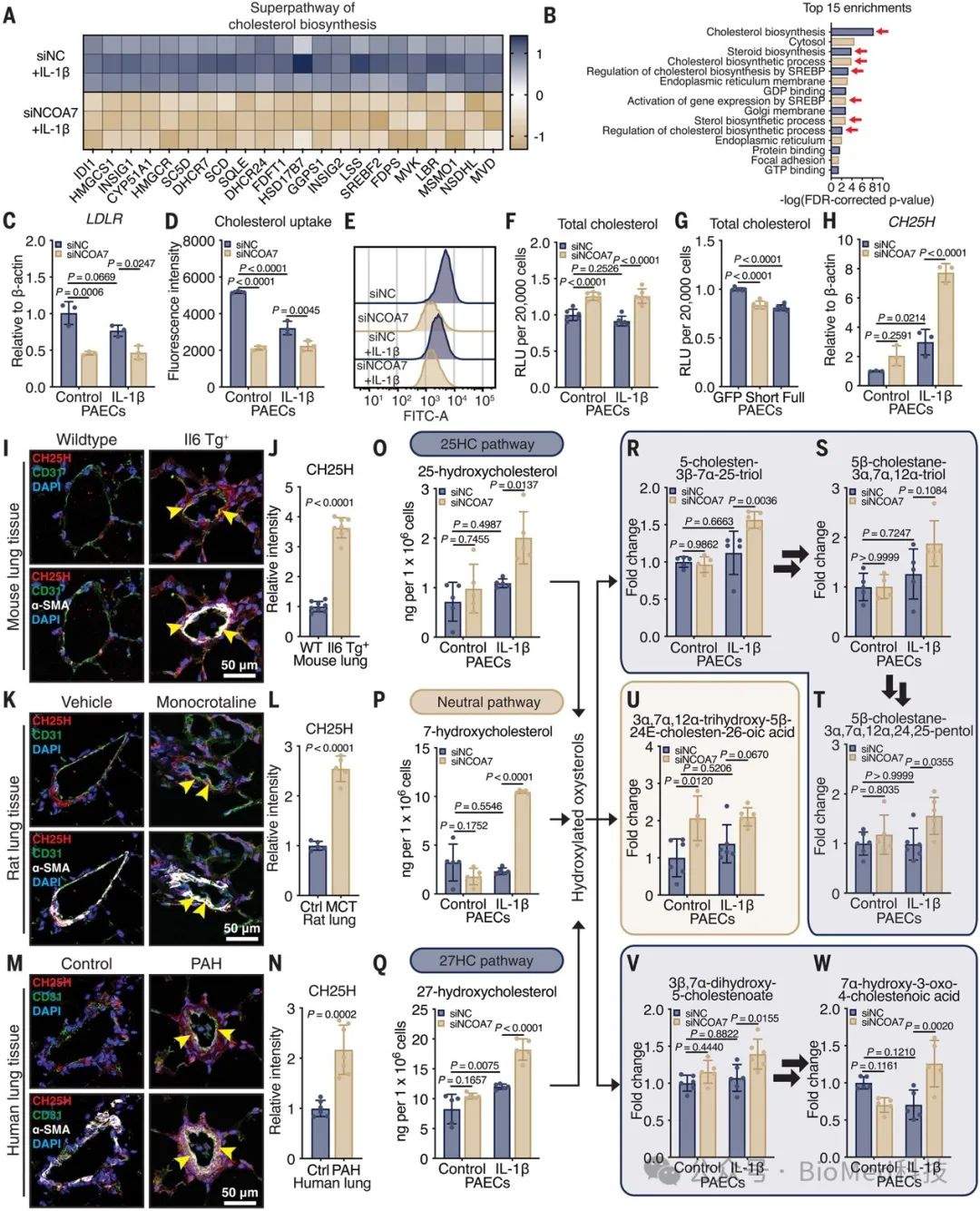
图2 NCOA7缺乏重编程甾醇代谢,上调氧化甾醇和胆汁酸
三、Ncoa7的遗传缺失和7HOCA的经气管输送使体内肺动脉高压恶化
在IL-6转基因PAH小鼠模型中,全身性缺失Ncoa7基因导致肺动脉小动脉内皮表达CH25H升高,引发炎症因子VCAM1上调和单核细胞浸润,加重血管重塑。这些变化伴随着血浆中7HOCA等氧化胆固醇衍生物水平升高,与PAH严重程度相关的生物标志物谱系特征一致。全身性Ncoa7缺失也导致右心室功能指标(Fulton指数、RVFAC)恶化和肺动脉压升高,表现为PAH症状加重。采用靶向内皮的基因沉默技术,证实Ncoa7特异性缺失于内皮细胞足以引发上述免疫活化和血管重塑表型,确立了NCOA7在内皮细胞中的关键作用。直接应用7HOCA也可诱导类似的内皮炎症和PAH表型,进一步证明NCOA7通过调控氧化胆固醇代谢来调节内皮功能的重要性。综上所述,本文提供了NCOA7在内皮细胞中调控胆固醇代谢稳态,从而影响免疫反应和PAH发展的证据。
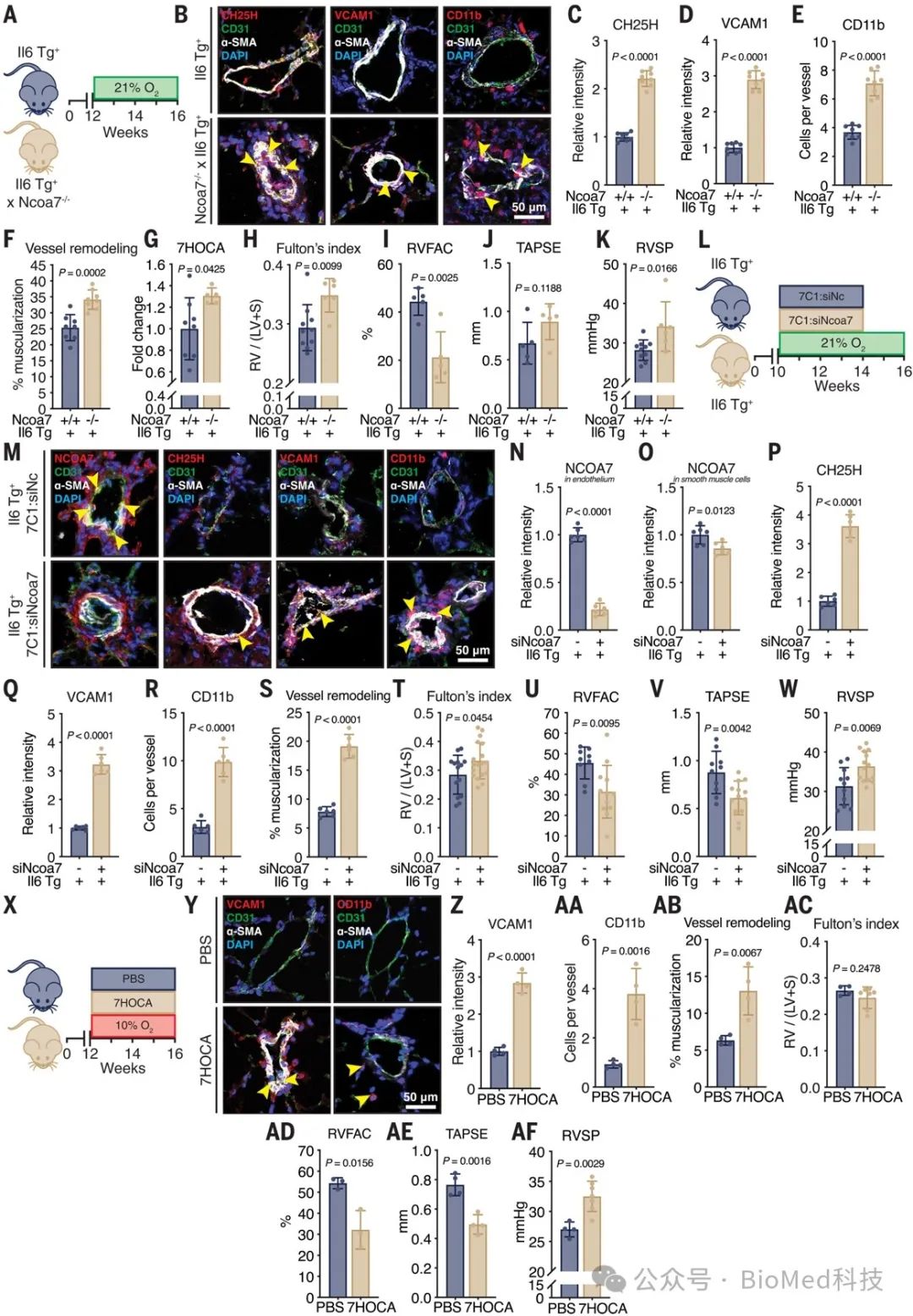
图3 Ncoa7的遗传缺失和7HOCA的经气管输送使体内肺动脉高压恶化
四、SNP rs11154337的G等位基因可阻止溶酶体脂质积累并减弱免疫激活
在两个独立的PAH病人队列的分析显示,rs11154337 G等位基因携带者在6分钟步行距离更长、总体生存期更长,提示该等位基因具有保护作用。通过CRISPR-Cas9技术构建同源细胞系,作者发现rs11154337 G等位基因可上调NCOA7的表达,尤其是短型isoform,并增强NCOA7与V-ATPase亚基ATP6V1B2的结合,从而提高溶酶体酸化。相比C/C等位基因型,G等位基因携带的内皮细胞表现出更好的溶酶体功能,其胆固醇和羟化型胆固醇水平较低,免疫活化指标VCAM1也较低。这些结果表明,rs11154337 G等位基因通过促进NCOA7表达和溶酶体功能,抑制氧化型胆固醇的产生,从而减弱内皮细胞的免疫活化,从而在PAH发病过程中发挥保护作用。综上所述,这一SNP位点及其对应的NCOA7信号通路可能是PAH发病的关键调控机制之一。
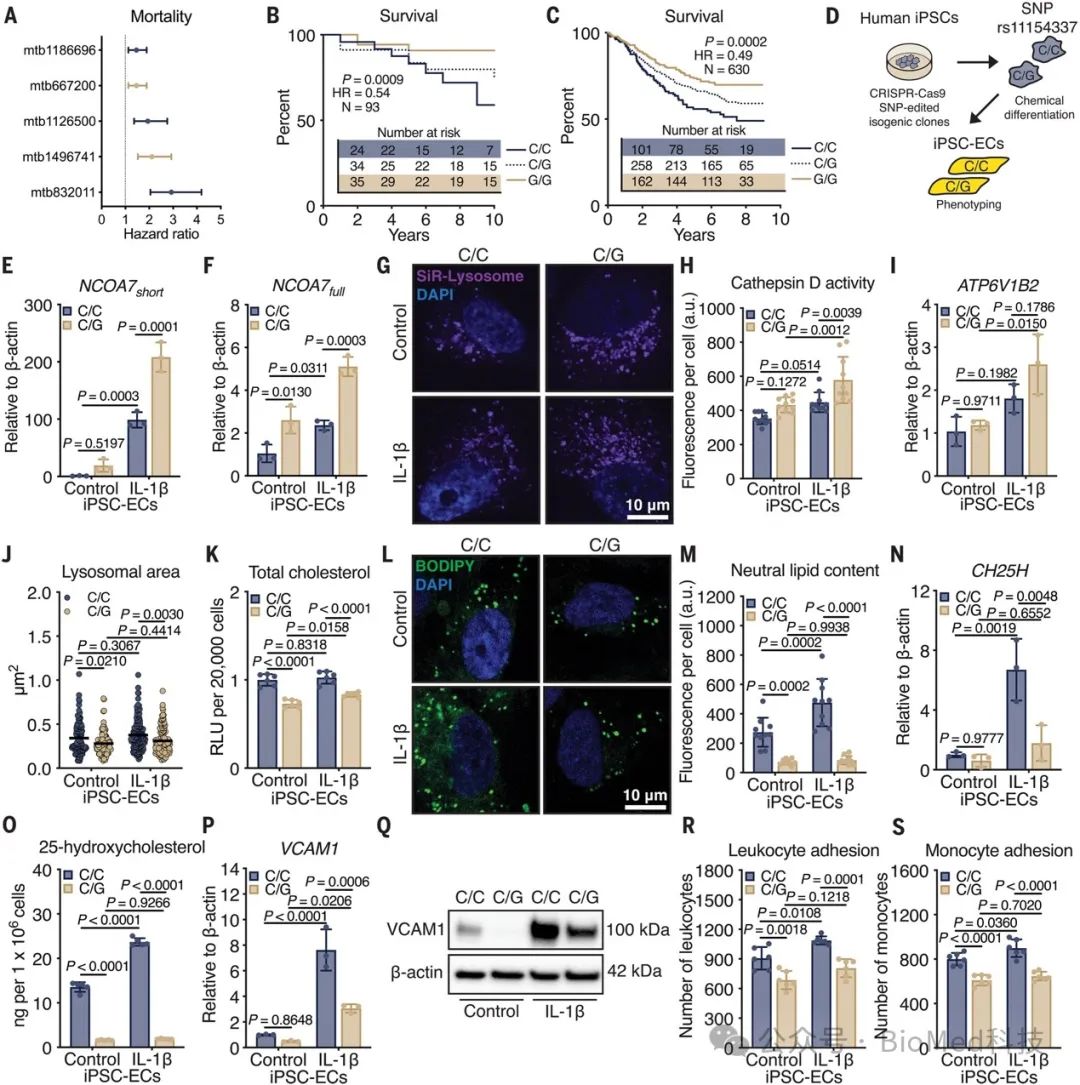
图4 SNP rs11154337的G等位基因可阻止溶酶体脂质积累并减弱免疫激活
五、计算模型确定958ami是一种NCOA7激活剂,可消除内皮免疫激活和肺动脉高压
作者通过计算机辅助药物设计的方法,发现了一种小分子化合物958ami,能够激活NCOA7并发挥治疗性作用。基于NCOA7蛋白结构的模拟、药效团建模和虚拟筛选,作者识别到了一个潜在的NCOA7激活剂958。进一步分子动力学模拟分析发现,通过在958的结构中引入氨基取代羟基,可进一步优化其与NCOA7的结合亲和力,得到化合物958ami。在细胞水平上,958ami能够促进NCOA7与其结合蛋白ATP6V1B2的互作,增强溶酶体酸化,从而抑制炎症因子IL-1β诱导的胆固醇25-羟化酶表达和内皮细胞免疫活化。在单克隆肺动脉高压(PAH)大鼠模型中,958ami治疗可降低肺血管内皮中CH25H和VCAM1的表达,减少单核细胞浸润,从而缓解血管重塑和右心室功能障碍等PAH表型。上述结果表明,958ami通过激活NCOA7信号途径,改善溶酶体功能和胆固醇代谢,从而抑制炎症性内皮细胞激活,最终对已建立的PAH模型产生治疗作用。
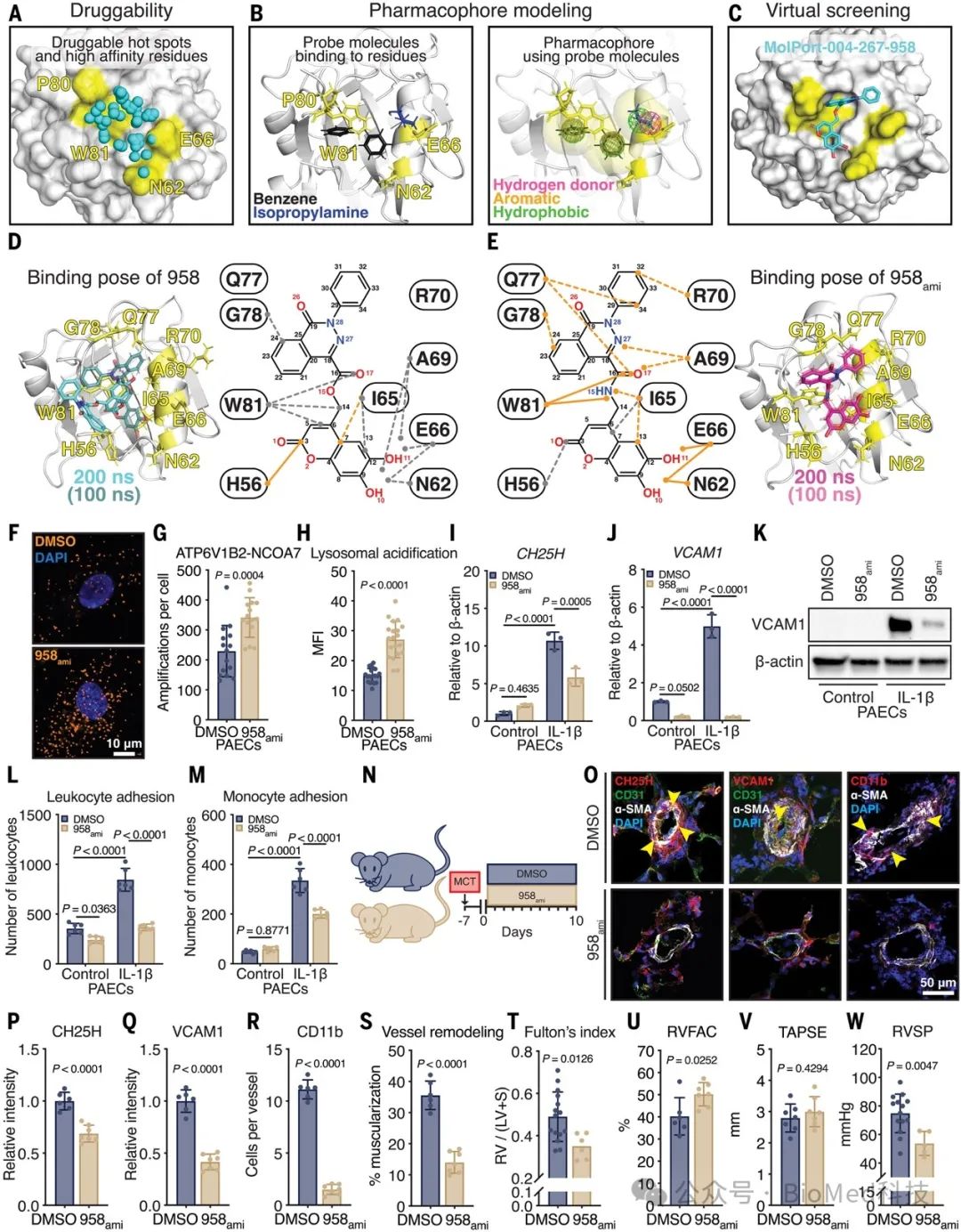
图5 计算模型确定958ami是一种NCOA7激活剂,可消除内皮免疫激活和肺动脉高压
【结论与展望】
NCOA7在ECs中发挥抑制炎症的作用,通过维持溶酶体酸化来限制氧化型胆固醇和胆酸的产生。NCOA7缺失则导致溶酶体功能障碍,引发大量促炎性代谢物累积,加重EC免疫活化和PAH表型。在PAH患者队列中,NCOA7基因内含子SNP rs11154337 G等位基因与较长的6分钟步行距离和生存期相关,机制与其上调NCOA7表达、改善溶酶体功能和氧化胆固醇代谢有关。通过计算机辅助药物设计,作者研发出一种NCOA7激动剂958ami,能够恢复溶酶体酸化,抑制氧化胆固醇生成和EC免疫活化,从而在PAH大鼠模型中显示出治疗作用。总之,该研究阐明了NCOA7-溶酶体-氧化胆固醇信号通路在PAH发病机制中的关键作用,为基于此的新型诊断和治疗策略提供了重要基础。
原文链接:
https://www.science.org/doi/10.1126/science.adn7277


