好文推荐 | 高原认知障碍患者血清蛋白组学研究
时间:2025-01-23 12:10:26 热度:37.1℃ 作者:网络
摘要
目的 明确高海拔人群和平原人群中与认知障碍相关的差异蛋白。比较分析差异蛋白的生物功能及信号通路。方法 选取平原组(400 m)及高海拔组(3 960 m)人群各30例,对所有研究对象进行一般信息采集,以蒙特利尔认知评估(MoCA)量表对受试者进行认知功能评估,对各组人群进行血液标本采集、离心、以tims TOF Pro质谱仪检测受试者血清中蛋白水平,最后采用SPSS 25.0软件进行统计学分析,明确蛋白组学与认知障碍的相关性。结果 (1)对平原组和高海拔组进行MoCA量表测试,结果显示高海拔组MoCA分值明显低于平原组,表明高海拔组存在明显认知损伤,主要表现在视空间与执行能力、注意力、延迟记忆、定向力方面。(2)对受试者进行血清样本的蛋白组学分析后,发现存在169种差异蛋白,上调蛋白84种,下调蛋白85种,其中与认知障碍相关的蛋白有39种。(3)对差异蛋白进行富集分析后,发现这些差异蛋白分别参与多种信号通路和代谢途径调控。结论 (1)高海拔暴露人群存在明显认知功能损伤。(2)高海拔人群与平原人群相比,存在与认知功能相关的差异表达蛋白。
高原地区低氧低压的环境特性可引发脑部代谢功能异常,血管调节机制紊乱,进而对神经系统结构的完整性和正常生理机能造成直接损害。海马组织对缺氧最为敏感,进而对记忆力、判断力、执行能力等认知功能产生一定影响,其中,认知功能的受损给个体的学习、日常生活及工作带来了显著的困扰。认知功能包括记忆力、注意力、执行力、语言能力、空间定向力、思维能力以及行为、情感等多个方面。认知障碍涉及这些维度中的学习、记忆、思维及判断能力相关的高级脑功能处理过程发生异常,从而引起学习、记忆功能严重受损,同时伴有失语或失用等改变的病理过程,主要由阿尔茨海默病、脑血管病、头部外伤等疾病引起,目前对于认知障碍的病因研究尚未十分明了。如今,随着现代科技水平的不断发展,蛋白质组学技术在临床医学研究领域得到广泛应用,蛋白组学一词,融合自蛋白质与基因组概念,表示“基因组编码的全部蛋白质集合”,涵盖从单一细胞到整个生物体表达的所有蛋白质的研究范畴。蛋白质组学致力于探究细胞内所有蛋白质的表达情况,包括蛋白质的数量、表达水平、更新速率,其序列信息及翻译后修饰,还有蛋白质间、蛋白质与其他分子在细胞内、膜上及细胞外的相互作用机制。基于质谱的定量蛋白质组学技术常用于寻找各种疾病的生物学标志物,例如不同类型的癌症或神经系统疾病,以及不同类型的组织或体液,例如血液、尿液或脑脊液。以此了解疾病背后的生物学过程、在未来诊疗过程中提供个性化治疗,以及能够为新药的开发提供科学依据。
1 资料与方法
1.1 研究对象
采用随机抽样的方法,选取平原组(400 m)及高海拔组(3 960 m)人群各30例,对所有研究对象进行一般信息采集,以蒙特利尔认知评估(MoCA)量表对受试者进行认知功能评估,对各组人群进行血液标本采集、离心、以tims TOF Pro质谱仪检测受试者血清中蛋白水平。纳入标准:(1)年龄18~80岁;(2)能够理解提问并积极配合完成认知量表;(3)未服用影响认知功能药物的患者;(4)签署知情同意书。排除标准:(1)因存在失明、失聪、重度语言障碍等而不能配合认知功能检查者;(2)已诊断为痴呆或曾有脑炎、头部创伤、甲状腺功能异常等可能导致认知损伤的患者;(3)患有呼吸衰竭、肝肾功能严重不全、急性心衰、急性感染期、颅内肿瘤、头部外伤等疾病者。
1.2 资料收集
研究对象的资料通过问卷法进行调查收集。(1)社会人口学变量(性别、年龄)、MoCA分值和既往史(糖尿病、高血压、高血脂);(2)认知评估标准及方法:受试者均完成蒙特利尔认知评估(MoCA)量表。
1.3 质量控制
为确保质量,认知功能调研问卷由同一名调查人员负责向所有受试者发放。在正式调研启动之前,对调查人员进行标准化培训。问卷内容在广泛征求专家建议并综合考虑实际情况后进行了修订和优化。调研完成后,对所有问卷进行了复核审查,以防止遗漏或错误填写。
1.4 统计学分析
采用SPSS 25.0软件进行统计学分析,对于计量资料用(x±s)表示,首先给予正态性检验,若所有组别均符合正态分布且方差齐性,则两组比较采用t检验进行组间统计分析;如果不服从正态分布,组间比较Kruskal-Wallis秩和检验。对于计量资料,其结果以比率或百分比的形式呈现,组间对比采用χ²检验进行分析,设定显著性水平α=0.05。以P<0.05为差异有统计学意义。
2 结 果
2.1 研究对象的一般资料比较
研究对象一般资料对比发现,性别、既往史(糖尿病、高血压、高血脂),以P>0.05为差异无统计学意义,具有可比性。年龄与MoCA分值P<0.05,差异有统计学意义。平原组平均年龄大于高海拔组,但MoCA分值仍高于高海拔组,说明高海拔可能会对认知造成损伤(见表1)。
2.2 MoCA量表各项分值比较
对研究对象MoCA量表各项分值进行比较发现,在视空间与执行能力、注意力、延迟记忆与定向力组间比较差异具有统计学意义(P<0.05)(见表2)。
2.3 蛋白组学研究
本研究采用了一系列先进技术,包括蛋白质提取、酶促分解、高效液相色谱分级(旨在构建数据库)、液相色谱-质谱联用分析技术,以及生物信息学数据处理方法,对样本进行了定量蛋白质组学的深入研究。
2.3.1 差异蛋白的筛选
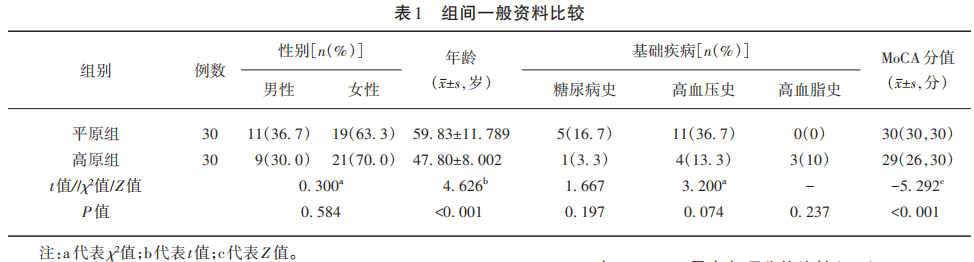
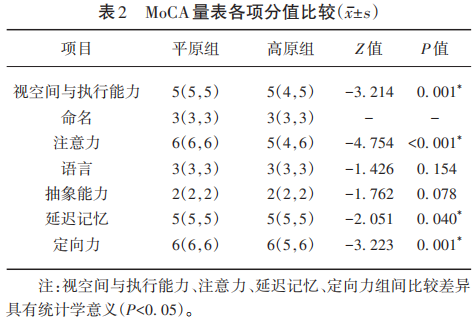
通过分析,鉴定到的肽段数为13 910个,鉴定到的特异肽段数为12 963个,鉴定到的蛋白数为1 932个,鉴定到的可定量比较的蛋白数为1 905个。设定差异表达量变化超过1.5倍为显著上调界限,低于1/1.5倍则为显著下调界限。上调的差异蛋白数为84个,下调的差异蛋白数为85个(见图1)。对上调及下调的top5蛋白绘制火山图进行描述(见图2)。
2.3.2 差异蛋白的功能分类
(1)差异表达蛋白的GO功能注释:对组间差异蛋白进行GO(gene ontology)功能注释,包括生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)3部分内容,以获取蛋白质的相关生物功能信息。在BP中,参与蛋白数目最多的是生物过程调控、解剖结构发育、多细胞生物发育、有机物代谢过程;在CC中,参与蛋白数目最多的是细胞内解剖结构、细胞质、细胞器、细胞外区域;在MF中,参与蛋白数目最多的是蛋白结合、离子结合、水解酶活性、有机环化物结合。(2)差异表达蛋白KEGG功能注释:针对组间差异表达蛋白实行KEGG(kyoto encyclopedia of genes and genomes)功能分析,具体涵盖细胞过程(cellular processes)、环境信息处理(environmental information processing)、遗传信息处理(genetic information processing)、人类疾病相关(human diseases)、新陈代谢过程(metabolism)、生物体系统(organismal systems)进行功能分类,在细胞过程中,参与蛋白数目最多的是细胞的生长与死亡、运输与分解代谢;在环境信息处理中,参与蛋白数目最多的是信号转导;在遗传信息处理中,参与蛋白数目最多的是(蛋白质的)折叠、分类与降解;在人类疾病中,参与蛋白数目最多的是病毒性传染疾病、细菌性传染疾病;在新陈代谢中,参与蛋白数目最多的是全局和总览图谱、碳水化合物代谢;在生物体系统中,参与蛋白数目最多的是免疫系统、消化系统、内分泌系统。
2.3.3 差异蛋白的功能富集分析
(1)差异蛋白GO功能富集分析:对组间差异表达蛋白进行GO功能富集分析,功能富集前5位的BP是TRAIL的生产调节、蛋白质聚糖分解代谢过程、正向调节TRAIL的产生、硫酸乙酰肝素蛋白多糖的分解代谢过程、T细胞能量的调节;功能富集前5位的CC是MHC Ⅰb类蛋白复合物、MHC Ⅰ类蛋白复合物、胰岛素响应隔间、COP Ⅰ蛋白包裹的胞膜膜、COP Ⅰ有被囊泡;功能富集前5位的MF是TAP2结合、TAP1结合、溶质:钠同向转运体活性、钠:碳酸氢盐同向转运体活性、NEDD-8特异性蛋白酶活性。(2)差异蛋白KEGG通路富集分析:对组间差异表达蛋白进行KEGG通路富集分析发现,通路主要富集在催乳素信号通路、人类免疫缺陷病毒Ⅰ型感染通路、卡波西肉瘤相关疱疹病毒感染通路、细胞衰老通路、移植物抗宿主病通路等代谢通路中。
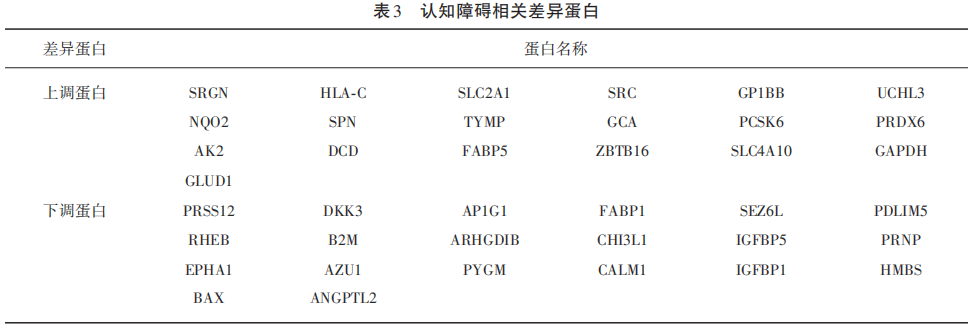
2.3.4 认知障碍相关差异蛋白
对差异表达倍数为1.5倍时的差异蛋白进行筛选,发现与认知障碍相关的差异蛋白有39种,其中上调蛋白19种,下调蛋白20种(见表3)。
2.3.5 认知障碍相关差异蛋白通路
通过对认知障碍相关蛋白进行相关通路的寻找,得到以下结果(见表4)。

3 讨 论
认知功能障碍的表现形式多种多样,在临床上常见于阿尔茨海默病(Alzheimer disease,AD),AD的主要临床表现是记忆力和其他认知领域的进行性损害,如语言、注意力、执行功能和视空间能力受损,导致日常生活能力下降,通常伴有神经精神症状。客观认知和功能受损是通过神经心理学测试的方法来进行评估的,涉及多个认知领域的标准化测试。本研究使用MoCA量表来进行神经心理学测试,首先进行组间一般信息比较,以P>0.05为差异无统计学意义,组间具有可比性。然后对两组受试者进行MoCA量表测试,高原组人群MoCA分值明显低于平原组,说明高原环境确实对认知功能造成一定程度的损伤,对MoCA量表各项分值进行比较,发现在视空间与执行能力、注意力、延迟记忆、定向力组间比较差异具有统计学意义。
液相色谱与串联质谱联用技术(LC-MS/MS技术),是一种兼具液相色谱(liquid chromatography,LC)物理分离特性和质谱(mass spectrometry,MS)解析力的分析化学手段。该技术能实现对蛋白质的高灵敏度、高精确度及高选择性的定性与定量测定,其应用日益成熟,并在蛋白质组学研究中得到广泛采纳与运用。本研究运用LC-MS/MS技术,深入探讨了认知障碍相关的蛋白质组学特征,对比分析了高原组与平原组间的差异蛋白质表达,并对这些差异蛋白进行了详细的生物信息学解析。此举有助于揭示认知相关疾病的特定机理,发现认知功能障碍的早期生物标志,为认知功能领域的深入研究奠定了坚实基础。
本研究根据海拔分为高海拔组和平原组,获取血清后进行蛋白提取、胰蛋白酶酶切成肽段后进行蛋白组学分析。与平原组相比,高海拔组存在明显的差异表达蛋白,对差异表达蛋白进行生物信息学分析,在生物过程(biological process,BP)中,参与蛋白数目最多的是生物过程调控、解剖结构发育、多细胞生物发育、有机物代谢过程;在细胞组件(cellular component,CC)中,参与蛋白数目最多的是细胞内解剖结构、细胞质、细胞器、细胞外区域;在分子功能(molecular function,MF)中,参与蛋白数目最多的是蛋白结合、离子结合、水解酶活性、有机环化物结合。在细胞过程中,参与蛋白数目最多的是细胞的生长与死亡、运输与分解代谢;在环境信息处理中,参与蛋白数目最多的是信号转导;在遗传信息处理中,参与蛋白数目最多的是(蛋白质的)折叠、分类与降解;在人类疾病中,参与蛋白数目最多的是病毒性传染疾病、细菌性传染疾病;在新陈代谢中,参与蛋白数目最多的是全局和总览图谱、碳水化合物代谢;在生物体系统中,参与蛋白数目最多的是免疫系统、消化系统、内分泌系统等。
对于认知障碍相关蛋白的研究领域,当前关注的焦点集中于AD的典型组织病理特征,即脑内β淀粉样蛋白(Aβ)沉积与神经元纤维缠结现象,而后者主要归因于Tau蛋白的异常过度磷酸化。Aβ的过度沉积可增强脑内毒性作用,进而可能诱发严重的认知功能损害。有研究表明,血浆Aβ1-42水平与老年患者认知障碍的严重程度呈现明显负相关,因此,血浆水平Aβ1-42可作为评估认知障碍严重程度的指标。相较于正常人,AD患者脑内的Tau蛋白总体水平显著上升,具体表现为正常形态的Tau蛋白数目下降,而异常磷酸化程度增高的Tau蛋白数量则明显增加。Tau蛋白的异常过度磷酸化能直接导致AD患者神经元或轴突的凋亡,故而,p-Tau被视为AD早期诊断的一个潜在生物标志物。除此之外,神经丝轻链蛋白(NFL)在神经元轴突部位高表达,发挥着维持轴突形态稳定,保证神经元信号传导的功能。正常生理条件下轴突释放少量的NFL,但在病理条件下NFL释放量显著增加。因此,NFL是公认的神经轴突损伤和神经变性的标志物。较高水平的NFL存在于多种神经系统疾病中,如阿尔茨海默病(AD)、帕金森病(Parkinson disease,PD)、额颞叶痴呆(frontotemporal lobar dementia,FTD)、亨廷顿病(Huntington disease,HD)、肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)等,血液中的NFL水平都会上升。邓长林等研究表明,检测血清NFL水平可以作为AD及VD早期诊断和判断病情严重程度的外周血生物标志物。也有研究指出,较高的血浆NFL水平和MMSE评分相结合是5年内从MCI进展为AD痴呆的强有力的预测因子。
对于高原低氧环境下认知障碍的蛋白组学研究,目前还较匮乏。高原环境下,缺氧诱导因子(HIF-1α)作为细胞应对低氧环境的主要调控因子,其在机体缺氧状态下被激活。HIF-1α可调控一系列与缺氧适应性反应相关的细胞因子表达,包括红细胞生成、血管生成、糖代谢与能量转换、细胞存活、凋亡及其活性等多个层面,以维持组织和细胞在缺氧环境下的内稳态,实现缺氧适应。因此,HIF-1α在高原环境导致的认知障碍中扮演着关键角色。
Shao等对短期低氧条件下的小鼠海马功能进行相关蛋白组学研究,结果表明,在低氧刺激下,小鼠的认知能力和运动能力发生损伤,整体蛋白质组学分析显示缺氧使516个蛋白的表达受到影响,其中71.1%的蛋白表达上调,28.5%的蛋白表达下调。通过该研究发现线粒体功能发生改变,表现为NADH脱氢酶(泛醌)1α亚复合物4(NDUFA4)表达降低,同时伴随活性氧生成增加,进一步导致神经元受损。因此,短期缺氧对小鼠认知和行为能力的损伤主要是由于神经元功能的改变,可能主要表现为线粒体功能障碍。
本研究发现,高海拔人群与平原人群相比较,存在明显认知功能损伤。进行蛋白组学分析后发现,存在明显的差异表达蛋白。对差异表达蛋白进行检索,进一步寻找认知障碍相关的差异表达蛋白,发现上调蛋白19种,下调蛋白20种。其机制目前尚不清楚,有待进一步研究。
参考文献
[1]马薛欣雨,杨晓娟,杨志福,等. 高原暴露下认知功能障碍的研究进展[J]. 中国实用神经疾病杂志,2021,24(21):1924-1932.
[2]李鹏飞,石华香,郭家彬,等. 高原环境低氧对认知功能的影响及其防护研究进展[J]. 中国药理学与毒理学杂志,2022,36(6):401-409.
[3]吉维忠,吴世政. 高原低氧环境诱导认知功能损害研究现况[J]. 中国高原医学与生物学杂志,2019,40(3):189-193.
[4]仇容,陈增良. 蛋白质组学及其在常见肿瘤研究中的应用进展[J]. 国外医学(肿瘤学分册),2004,31(9):646-648.
[5]Bharucha T,Gangadharan B,Kumar A,et al. Mass spectrometry-based proteomic techniques to identify cerebrospinal fluid biomarkers for diagnosing suspected central nervous system infections. A systematic review[J]. J Infect,2019,79(5):407-418.
[6]Thomas S,Hao L,Ricke WA,et al. Biomarker discovery in mass spectrometry-based urinary proteomics[J]. Proteomics Clin Appl,2016,10(4):358-370.
[7]Kowalczyk T,Ciborowski M,Kisluk J,et al. Mass spectrometry based proteomics and metabolomics in personalized oncology[J]. Biochim Biophys Acta Mol Basis Dis,2020,1866(5):165690.
[8]王炜,王鲁宁. “蒙特利尔认知评估量表” 在轻度认知损伤患者筛查中的应用[J]. 中华内科杂志,2007,46(5):414-416.
[9]Weintraub S,Wicklund AH,Salmon DP. The neuropsychological profile of Alzheimer disease[J]. Cold Spring Harb Perspect Med,2012,2(4):a006171.
[10]Garcia-Escobar G,Manero RM,Fernández-Lebrero A,et al. Blood biomarkers of Alzheimer’s disease and cognition:a literature review[J]. Biomolecules,2024,14(1):93.
[11]王祥雪. 衰老相关蛋白组学与磷酸化蛋白组学分析及血浆标志物研究[D]. 济南:山东大学,2023.
[12]王建枝,魏泽兰,王群,等. τ蛋白磷酸化位点与其促微管组装及与微管结合活性的体外分析[J]. 中国医学科学院学报,2000,22(2):120-123.
[13]Karran E,Mercken M,De Strooper B. The amyloid cascade hypothesis for Alzheimer’s disease:an appraisal for the development of therapeutics[J]. Nat Rev Drug Discov,2011,10(9):698-712.
[14]尹倩然,郝敬波,卢海龙,等. 血p-Tau181、Aβ1-42与老年阿尔茨海默病病人认知关系的研究[J]. 实用老年医学,2021(7):741-743.
[15]Yang CC,Chiu MJ,Chen TF,et al. Assay of plasma phosphorylated tau protein (threonine 181) and total tau protein in early-stage Alzheimer’s disease[J]. J Alzheimers Dis,2018,61(4):1323-1332.
[16]Pais MV,Forlenza OV,Diniz BS. Plasma biomarkers of Alzheimer’s disease:a review of available assays,recent developments,and implications for clinical practice[J]. J Alzheimers Dis Rep,2023,7(1):355-380.
[17]Petzold A. Neurofilament phosphoforms:surrogate markers for axonal injury,degeneration and loss[J]. J Neurol Sci,2005,233(1-2):183-198.
[18]Ashton NJ,Janelidze S,Al Khleifat A,et al. A multicentre validation study of the diagnostic value of plasma neurofilament light[J]. Nat Commun,2021,12(1):3400.
[19]邓长林,白向东. 血清神经丝轻链蛋白与认知障碍的相关性研究[J]. 宁夏医学杂志,2024,46(6):495-498,553.
[20]Darmanthé N,Tabatabaei-Jafari H,Cherbuin N,et al. Combination of plasma neurofilament light chain and mini-mental state examination score predicts progression from mild cognitive impairment to Alzheimer’s disease within 5 years[J]. J Alzheimers Dis,2021,82(3):951-964.
[21]Shao Q,Liu J,Li G,et al. Proteomic analysis reveals that mitochondria dominate the hippocampal hypoxic response in mice[J]. Int J Mol Sci,2022,23(22):14094.
[22]王丹,赵承军,陈桂生.NIM811对Na2S2O4引起小鼠HT22细胞缺氧/复氧损伤的保护作用的研究[J].中风与神经疾病杂志,2022,39(2):100-103.


