PNAS和NAR天津医科大学张锴、翟贵金等报道组蛋白乳酸化、β-羟基丁酰化的阅读器及其调控机制
时间:2024-12-10 06:00:39 热度:37.1℃ 作者:网络
2024年12月5日,天津医科大学张锴教授课题组在Proc. Natl. Acad. Sci. U. S. A. 杂志在线发表了题为“DPF2 reads histone lactylation to drive transcription and tumorigenesis”的研究论文。该研究报道了DPF2作为组蛋白乳酸化修饰的阅读器蛋白,通过识别组蛋白H3K14la调控基因转录,促进肿瘤进展的分子机制。

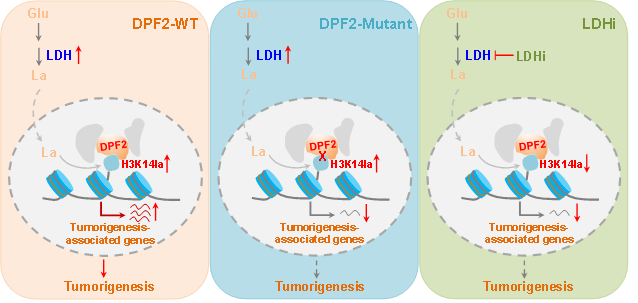
DPF2识别组蛋白H3K14la调控转录及肿瘤进程的分子机制(PNAS, 2024, e2421496121)
赖氨酸乳酸化(Kla)是近年来发现的一种新型的组蛋白酰基化修饰,参与转录、代谢等重要生命活动,在肿瘤、免疫等方面发挥着重要的调控作用。然而,组蛋白Kla如何调控这些过程尚不十分清楚,在一定程度上是由于其特异性识别蛋白(阅读器)还有待探索。
该项研究中,作者首先通过GEPIA对宫颈癌患者样本中糖代谢相关酶LDH及PKM等进行了分析,发现其表达量在宫颈癌患者中均显著上调,且与预后呈明显负相关,提示宫颈癌细胞发生了代谢重编程,乳酸产生增多,并促进了肿瘤进展。通过组蛋白乳酸化修饰分析,发现H3K14la上调最为显著;且LDH活性受到抑制后,细胞增殖明显下降。作者推测肿瘤细胞可能通过上调H3K14la并招募其识别蛋白调控基因转录及肿瘤行为。作者采用课题组前期发展的基于自组装技术的多价态光亲和富集策略(Anal. Chem., 2018),构建了组蛋白乳酸化探针并通过LC-MS分析,鉴定了H3K14la的潜在结合蛋白;从中筛选出DPF2对H3K14la可能具有特异性识别。
为了探究DPF2与H3K14la分子识别机制,作者通过生化实验、分子对接等证实了DPF2与H3K14la的结合,并揭示了介导其结合的关键氨基酸位点。接下来通过免疫荧光实验发现DPF2与H3K14la在细胞中存在共定位,而突变DPF2关键结合位点后,共定位显著下降。为进一步探究DPF2与H3K14la结合所介导的生物学功能,作者利用CUT&Tag、RNA-Seq分析发现,DPF2与H3K14la在基因TSSs区域具有较明显的富集,并调控癌基因的转录;另外,细胞增殖等实验也显示H3K14la与DPF2识别后通过调控癌基因转录,进而影响肿瘤细胞行为。
综上所述,该研究揭示了宫颈癌细胞发生代谢重编程,乳酸水平升高,组蛋白H3K14la显著上调,进而通过招募其识别蛋白DPF2特异调控相关癌基因的转录,影响肿瘤进程的分子机制。该研究发现了DPF2是组蛋白乳酸化修饰的阅读器蛋白,为组蛋白乳酸化如何调控肿瘤行为提供了新的视角。
天津医科大学基础医学院翟贵金博士和博士研究生牛紫萍、硕士研究生蒋梓昕为共同第一作者,张锴教授为通讯作者。
原文链接:
https://www.pnas.org/doi/10.1073/pnas.2421496121
翟贵金博士和张锴教授近期还在Nucleic Acids Res. 杂志以“NAR Breakthrough Article”及封面文章发表了题为“ENL reads histone β-hydroxybutyrylation to modulate gene transcription”的研究论文,该研究通过化学蛋白质组学方法发现了组蛋白β-羟基丁酰化修饰阅读器蛋白ENL,通过识别组蛋白H3K9bhb调控基因转录,进而促进肝癌进展。
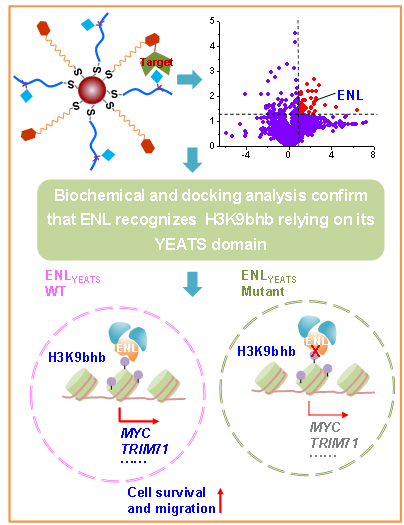

ENL识别组蛋白H3K9bhb调控基因转录的分子机制(NAR, 2024, 10029)
赖氨酸β-羟基丁酰化(Kbhb)与酮体代谢、基因转录等密切联系。近来的多项研究表明,组蛋白H3K9bhb能够特异调控相关基因转录并影响肿瘤进程;然而,其如何特异调控基因转录尚不十分清楚。在该研究中,作者采用多价态光亲和探针和基于质谱的化学蛋白质组学技术对H3K9bhb识别蛋白进行了鉴定和筛选,并结合生物信息学分析发现ENL为其潜在识别蛋白。接下来,通过生化和分子生物学实验,以及CUT&Tag、RNA-Seq等分析发现组蛋白H3K9bhb招募ENL,从而特异调控相关癌基因(如MYC)的转录,进而影响肝癌形成。
综上所述,该研究揭示了ENL为组蛋白H3K9bhb的识别蛋白,其通过特异识别组蛋白Kbhb进而调控相关基因转录,为理解组蛋白β-羟基丁酰化如何调控肿瘤行为提供了新视角。
天津医科大学基础医学院陈晨博士、陈聪博士及硕士研究生王爱源、蒋梓昕为共同第一作者,张锴教授和翟贵金博士为共同通讯作者。该研究得到国家自然科学基金和天津医科大学基础医学中心卓越计划的支持。
原文链接:
https://academic.oup.com/nar/article/52/17/10029/7693435?searchresult=1


