同济大学/吉美瑞生团队《自然·通讯》:揭示气道基底层来源前体细胞通过再上皮化修复肺组织的机制
时间:2025-02-09 12:09:31 热度:37.1℃ 作者:网络
特发性肺纤维化(IPF)是一种慢性、进行性、纤维化性间质性肺疾病。IPF患者的肺脏通常表现为肺部上皮组织不可逆损伤与修复障碍,并伴随肺泡结构的塌陷。相反,受损的肺部结构会被过度增生的成纤维细胞和炎症细胞取代,最终导致肺功能的急剧恶化。近年来,受损上皮组织的修复过程被广泛认为是IPF治疗的关键环节。尽管现有的抗纤维化药物能够延缓疾病进程,但由于这些药物无法恢复肺泡区域上皮的完整性,因此难以逆转肺功能的损伤。因此,全球研究者们正积极探索基于干细胞的新型再生医学方法,以实现受损肺组织的功能性修复,进而为IPF患者提供新的治疗选择。然而关于成体肺组织干细胞/前体细胞 (stem/progenitor cell)修复受损肺组织的分子和细胞学机制,目前尚不十分明确。
2025年2月,同济大学医学院左为教授、吉美瑞生超级器官研发中心张婷博士团队与同济大学医学院附属东方医院呼吸与危重症科郭忠良教授团队合作,在国际顶级刊物Nature子刊《自然 通讯》(Nature Communications)杂志在线发表题为“Cloned airway basal progenitor cells to repair fibrotic lung through re-epithelialization”的研究工作。该工作聚焦气道基底层来源肺前体细胞(P63阳性细胞)在肺泡区的命运与功能,揭示了克隆的肺前体细胞可通过完成受损肺泡区域的再上皮化(re-epithelialization)来修复肺纤维化损伤,为IPF等重大呼吸系统疾病的干细胞治疗提供了坚实的理论基础。

研究团队首先通过小鼠和灵长类动物模型,证实内源性肺前体细胞(P63⁺ KRT5⁺)在纤维化肺损伤后会迁移至肺泡区。为克服患者临床样本异质性难题,研究团队与海尔生物合作开发了自动化细胞培养系统,基于CT影像定位患者肺部健康区域,从3-5级支气管刷检样本中成功分离44例人源气道基底前体细胞(包括健康供体及IPF、慢性阻塞性肺疾病、支气管扩张症患者)。通过大规模的Bulk转录组测序,团队揭示了从患者健康区域分离的前体细胞并未表现出先前报道的疾病相关促纤维化和促炎基因,表明这些细胞并非致病性细胞,且相对保持正常功能。
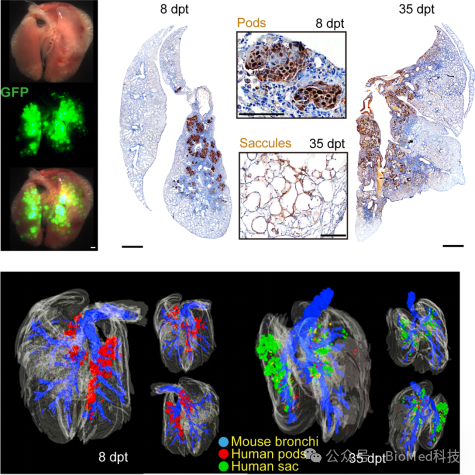
图1. 人源肺前体细胞移植后形成与原气道相通的气囊结构
随后,研究团队把分离的人源肺前体细胞进行GFP绿色荧光蛋白标记后,移植到博来霉素诱导的肺纤维化模型小鼠的受损肺脏中,探究其时空动态分化特征。在移植8天后,在小鼠肺脏受损的肺泡区域观察到大面积外源性人源细胞的整合,并且这些定植的细胞呈现出立方体的豆荚样结构。在移植35天后,定植的细胞发生了显著的转变,呈现出扁平的形态,并在肺泡区域形成肺泡样的气囊样 (saccular) 结构;通过3D重构对定植细胞的空间位置进行解析,研究团队发现,移植的前体细胞形成的气囊在结构上与小鼠支气管相连,形成了功能性新生气道。上述的结果表明,移植的人源肺前体细胞可以大面积定植在肺脏受损的肺泡区域,有效地使受损的肺泡区域功能性再上皮化(图1)。
研究团队对移植35天的“人鼠嵌合肺”进行高分辨率空间转录组学和病理学分析,结果显示这种再上皮化可以显著减少细胞定植区域附近的纤维化和炎症水平,有效阻挡纤维化进程和免疫浸润,改善小鼠的血气交换功能和生存率。进一步通过将移植8天和移植35天的细胞通过流式分选出来进行单细胞转录组测序,结果显示移植的人肺前体细胞在小鼠体内随时间进程逐渐丧失了P63的表达,进而在气道区域可以分化形成Club细胞和纤毛细胞,而在肺泡区域分化形成表达CLDN4等紧密连接蛋白的气囊细胞,重建上皮屏障。肺泡区域内一小部分细胞可以进一步分化为CLIC5+/AQP5+双阳性细胞,表达紧密连接蛋白CLDN3(图2)。
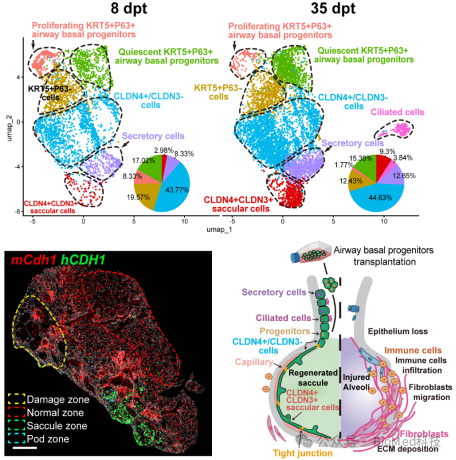
图2. 多组学测序揭示人源肺前体细胞在肺泡区域的屏障功能和分化命运
有趣的是,研究团队还从其他哺乳动物(犬、猪、山羊)和鸟类(鸽子)肺脏中克隆了P63+肺前体细胞。这些多物种来源的前体细胞同样能够在小鼠肺内再生气囊结构,并且与这些物种天然的肺泡结构具有高度相似性。通过这种方式,研究团队在人类历史上首次构建了鸟类和哺乳动物的嵌合体。上述研究表明,基于肺前体细胞的肺再上皮化过程可能是四足动物进化过程中的一种保守机制。团队还发现山羊的肺前体细胞具备异常强大的肺泡再上皮化修复能力,可以完全“治愈”肺纤维化的小鼠。这些数据为异种肺前体细胞移植的研究奠定了坚实的基础 (图3)。
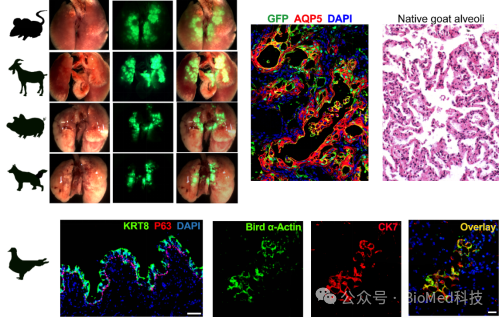
图3. 从哺乳动物和鸟类中克隆P63+ 肺前体细胞用于异种移植
综上,本研究首次揭示了P63+气道基底层来源肺前体细胞在肺泡区域内的分化命运和修复功能,移植的前体细胞通过分化为表达紧密连接的气囊结构,从而重新建立上皮屏障。这种再上皮化能够作为一种“创可贴”修复手段,促进肺部再生和修复,为结构损伤性重大呼吸系统疾病的干细胞治疗提供了坚实的理论基础。目前,吉美瑞生团队正在开展基于P63+肺前体细胞新药(REGEND001)的全国多中心临床研究,并已成功完成针对相关适应症的探索, 包括慢性阻塞性肺疾病(Wang, et.al., Science Transl Med. 2024)、 支气管扩张症 (Yan, et.al., Cell Reports Medicine. 2024) 和IPF (Zhang, et.al., eLife. 2025)。
左为教授、张婷博士、郭忠良教授为本论文的共同通讯作者,同济大学医学院博士生赵宇、周悦青与张惟番为本文的共同第一作者。本研究获国家生物药技术创新中心“揭榜挂帅”项目、国家重点研发计划“干细胞研究与器官修复”专项及吉美瑞生公司资助。
原文链接:
https://www.nature.com/articles/s41467-025-56501-w


