【Nature子刊】CAR-T相关CRS和ICANS的管理策略
时间:2025-02-08 12:11:19 热度:37.1℃ 作者:网络
CAR-T毒性
CAR-T细胞疗法在治疗某些血液治疗的治疗中取得了显著进展,如弥漫性大B细胞淋巴瘤(DLBCL)、急性B细胞淋巴母细胞白血病(B-ALL)和多发性骨髓瘤等。然而CAR-T也与显著的免疫相关不良事件相关,包括细胞因子释放综合征(CRS)和免疫效应细胞相关的神经毒性综合征(ICANS),这些事件可能导致显著的发病率甚至死亡。当前的管理策略,如使用托珠单抗(IL-6受体阻断剂)和皮质类固醇,在预防毒性进展方面仍需改进。
《nature reviews drug discovery》近日发表综述,总结了CRS和ICANS的治疗现状,并综述了T细胞和骨髓细胞固有的药物靶点和细胞工程化策略,以开发更安全的CAR-T细胞,旨在在保持疗效的同时减轻相关毒性。

CRS和ICANS的病理生理学
CRS是由CAR-T细胞、单核细胞和组织驻留髓系细胞的激活和增殖引发的,导致产生炎症细胞因子,如IL-6、IL-1和TNF。这种细胞因子风暴可导致内皮细胞激活、血管通透性增加和毛细血管渗漏综合征。ICANS与内皮细胞激活导致的血脑屏障松动有关,允许细胞因子和CAR-T细胞进入大脑,导致神经系统症状。ICANS多与CRS并发或在CRS之后发生,但也可能在无CRS的情况下发生。
当前治疗策略
CRS和ICANS的标准治疗一般为使用托珠单抗治疗中至重度(2-4级)病例,以及在托珠单抗无效或病情严重时使用皮质类固醇。托珠单抗通过静脉给药,半衰期长,能有效快速缓解大多数患者的CRS。然而关于托珠单抗的最佳给药时机存在争议,一些研究表明早期使用托珠单抗治疗1级CRS可以防止病情进展到更高级别。也有研究表明预防性使用托珠单抗可降低重度CRS且不影响CAR-T疗效。
ASTCT、EBMT和ASCO指南建议考虑使用托珠单抗治疗对退热药难治或持续3天以上的1级CRS,允许根据个体危险因素自由调整治疗。NCCN的指南有一定差别,根据相关临床试验的数据,根据具体CAR-T细胞产品给出了具体建议。
皮质类固醇(如地塞米松)用于治疗重度CRS和ICANS,因其强大的免疫抑制作用。然而高剂量的皮质类固醇可能会耗尽CAR-T细胞,减少抗肿瘤反应。短疗程的皮质类固醇似乎是安全的,不会显著影响CAR-T细胞的疗效。
预防性使用皮质类固醇预防CRS和ICANS方面,NCCN指南建议对接受axi-cel治疗的患者考虑预防性皮质类固醇,但EBMT和ASCO都不推荐预防性使用。预防性皮质类固醇没有额外获益。
其他药物策略
由托珠单抗和皮质类固醇组成的标准策略存在局限性,特别是皮质类固醇之外缺乏对ICANS的有效治疗,导致了对替代治疗药物的探索,控制CAR-T细胞炎症毒性的关键信号通路、细胞因子轴和可能的治疗干预措施总结见下图。
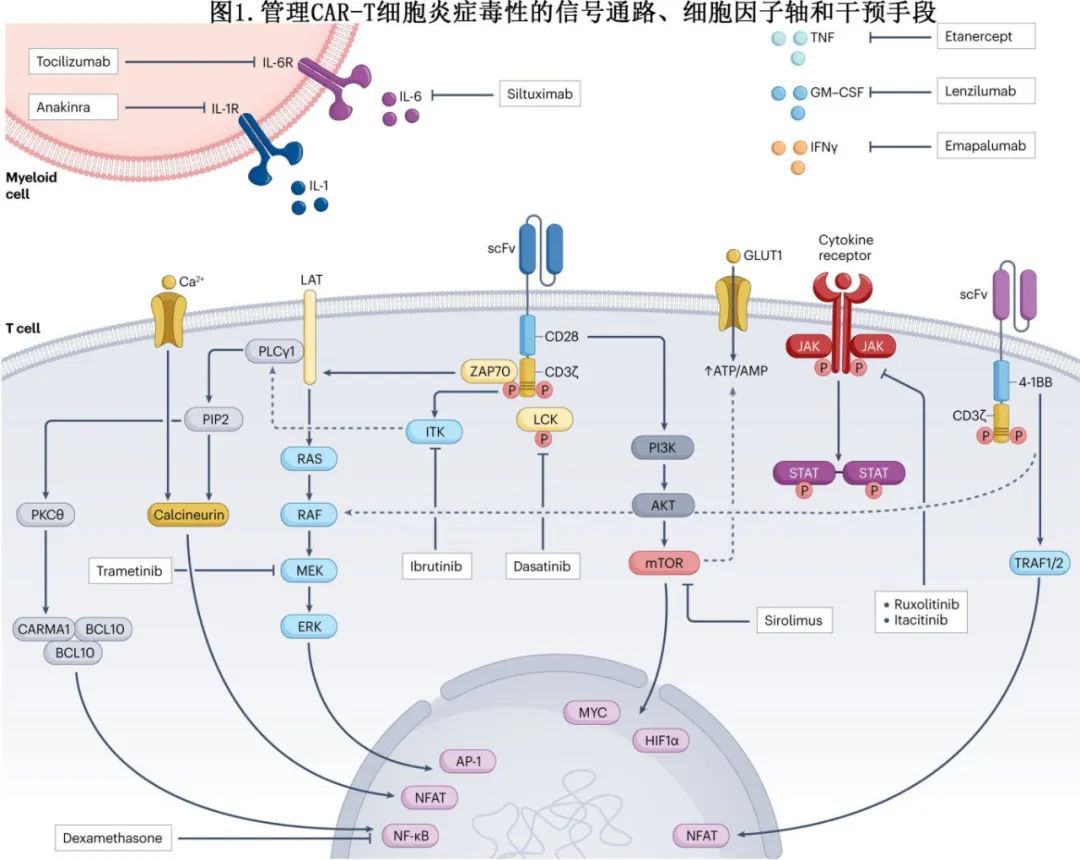
anakinra(IL-1受体拮抗剂):anakinra通过阻断IL-1信号传导显示出减少CRS和ICANS的潜力。早期和高剂量使用anakinra与降低治疗相关死亡率相关。ASTCT共识指南也推荐anakinra用于IEC-HS的一线治疗,无论是否伴有皮质类固醇。预防性给药在ICANS预防中也可发挥作用。未来的临床试验需要更精确地评估治疗的最佳剂量、时间和持续时间。
司妥昔单抗(抗IL-6单克隆抗体):司妥昔单抗直接抑制IL-6,在CAR-T和双抗中具有治疗和预防CRS和ICANS的效果。它在减少细胞因子水平和改善临床结局方面显示出潜力。
emapalumab(抗IFNγ单克隆抗体):emapalumab靶向IFNγ,后者在巨噬细胞激活中起作用,并与重度CRS和ICANS相关。尽管临床数据有限,但在难治性病例中使用emapalumab的报告结果令人鼓舞。
etanercept(TNF抑制剂):依那西普在少数CRS病例中使用,可成功降低细胞因子水平和临床症状。由于缺乏证据,共识指南不推荐使用etanercept或其他TNF抑制剂治疗严重难治性CRS和/或ICANS。此外存在感染风险。
Lenzilumab(靶向GM–CSF):lenzilumab可阻断GM-CSF,减少T细胞和髓性脑浸润,并在B-ALL异基因移植小鼠模型中阻止CRS和ICANS。目前无法用于临床,也没有靶向GM-CSF的临床试验。
此外,ASCO指南还推荐抗IL-6r治疗和大剂量皮质类固醇难治的4级CRS或ICANS进行淋巴细胞化疗(如环磷酰胺)和抗胸腺细胞球蛋白治疗,以及难治性神经毒性给予鞘内皮质类固醇和甲氨蝶呤治疗。NCCN组还建议静脉注射免疫球蛋白(IVIG)和体外细胞因子吸附联合持续肾替代疗法(CRRT)治疗严重难治性CRS。包括靶向TNF、GM-CSF和IFNγ的药物也有获益的报道。在常规实践中使用这些药物的证据并不充分,临床试验正在进行中。
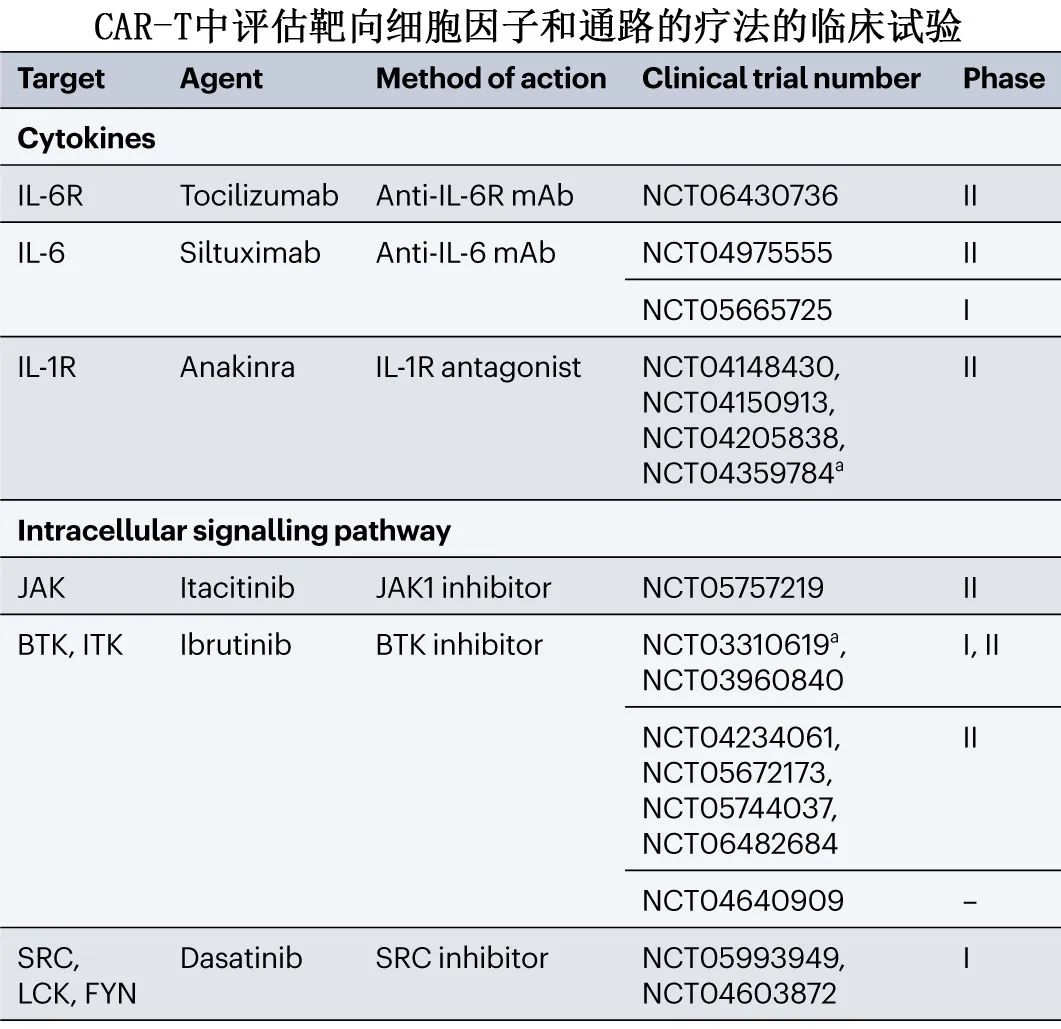
靶向治疗
通过靶向CAR-T细胞激活和细胞因子产生的细胞内信号通路,可能在不影响抗肿瘤效果的情况下减轻毒性。正在研究的一些通路和药物包括:
JAK抑制剂(如芦可替尼、itacitinib):这些药物抑制JAK-STAT通路,该通路对于细胞因子信号传导至关重要,小分子药物靶向JAK-STAT通路已被确定为缓解CRS和ICANS的潜在治疗路径。芦可替尼已在难治性CRS病例中使用,取得了积极效果。itacitinib正在预防性使用的临床试验中评估,但可能引起长期血细胞减少。JAK抑制剂具有明显的减轻炎症毒性而不影响抗肿瘤疗效的潜力,但需要进一步的临床评估以更好地了解其毒性特征,主要是血细胞减少和感染。
BTK抑制剂(如伊布替尼):伊布替尼在减少细胞因子产生和增强CAR-T细胞疗效方面显示出潜力,已在临床试验中得到证实。
SRC激酶抑制剂(如达沙替尼):达沙替尼作为CAR-T细胞的药理学“关闭开关”进行了研究,可减少细胞因子产生和增殖,同时允许可逆的功能控制。
MAP激酶抑制剂:MEK1/2抑制剂(MEKi)抑制MAP激酶通路,使T细胞重编程,延迟细胞分裂、增殖、分化和增加干性。临床前研究表明,在CAR-T细胞制备过程中使用trametinib或在CAR-T输注后给药,可以改善小鼠体内异基因移植模型的抗肿瘤反应,并减少衰竭表型。尚无将MEK抑制的概念转移到CAR-T临床治疗中。
靶向代谢通路
T细胞通过细胞表面抗原受体、共刺激受体和细胞因子的连接在静止和激活状态之间切换,诱导主要的代谢重新布线以支持功能状态。幼稚T细胞和记忆T细胞处于分解代谢状态,利用线粒体中的脂肪酸氧化(FAO)和氧化磷酸化(OXPHOS)产生ATP。T细胞激活需要广泛的细胞重编程来满足新的代谢需求,从而使细胞质量、增殖和效应细胞功能(如细胞因子的产生)的发展翻倍。这是通过向有氧糖酵解的转换介导的,有氧糖酵解允许快速生产快速细胞生长所必需的生物合成前体。在有效的抗原参与和共同刺激后,PI3K-AKT-mTOR信号通路通过上调葡萄糖转运蛋白1 (GLUT1)刺激糖酵解,增强糖酵解酶的活性,并增加细胞内氨基酸运输。糖酵解第一步后产生的葡萄糖6-磷酸被分流到戊糖磷酸途径,产生脂肪酸生产所必需的核苷酸前体、氨基酸前体和NADPH分子。刺激糖酵解已被证明通过增强IFNγ的产生来增加效应T细胞的活性,相反,抑制糖酵解会减少促炎细胞因子的产生
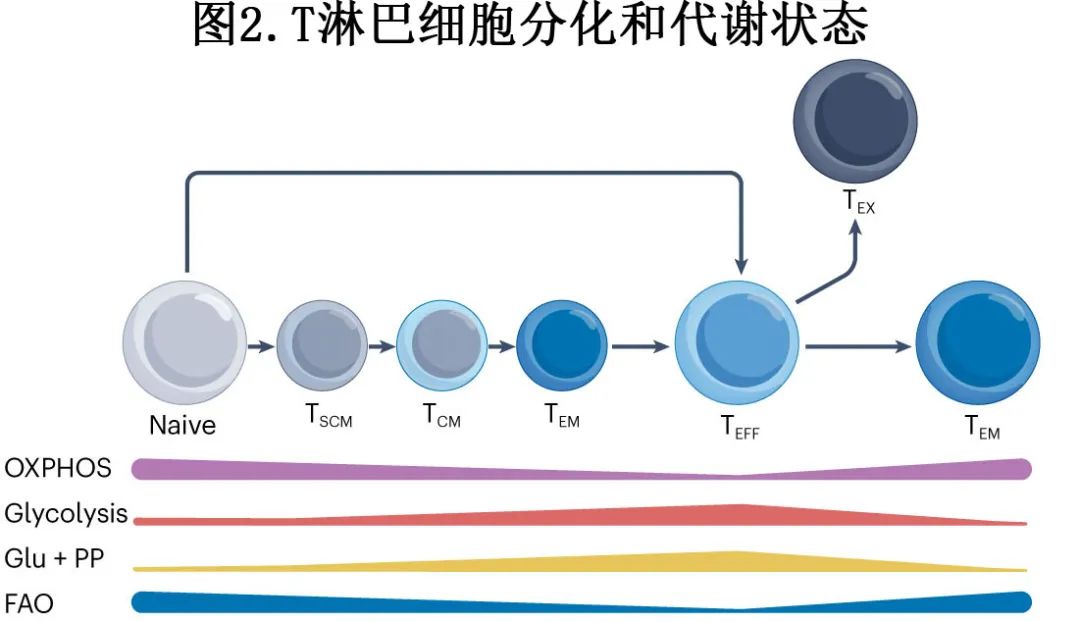
PI3K–AKT–mTOR抑制剂:在临床前模型中,mTOR、JAK、SRC和MEK抑制剂在药物筛选中被鉴定为成功抑制T细胞增殖,并以剂量依赖的方式消除抗CD19 T细胞双特异性抗体治疗引发的细胞因子。mTOR和JAK抑制剂在体外抗肿瘤活性和T细胞活化方面保持不变。在人源化小鼠淋巴瘤模型中,西罗莫司在抑制细胞因子(IL-6、IL-2和TNF)产生方面与地塞米松相当,但未显著影响抗CD19双特异性抗体的功效或减少T细胞浸润。芦可替尼显著抑制IL-6的生成(P<0.001),但不抑制IL-2、TNF或IFNγ的生成,对体内抗肿瘤反应的干扰最小。这些结果需要在人体临床试验中进行评估。
额外通路:进一步调节T细胞代谢状态的治疗策略有可能转化为临床CAR-T细胞领域。使用二甲双胍和其他方法进行代谢重编程值得探索,例如使用过氧化物酶体增殖物激活受体-γ (PPARγ)激动剂增加线粒体呼吸能力和FAO,抑制线粒体丙酮酸载体(MPC)以阻止线粒体丙酮酸代谢,用异柠檬酸脱氢酶2 (IDH2)抑制剂调节还原性羧化,用糖原合成酶激酶3β (GSK3β)抑制剂诱导Wnt -β-catenin途径,或者直接靶向转录因子如BATF来阻止T细胞分化。下图概述了正在研究的调节CAR-T细胞表型的其他治疗靶点。
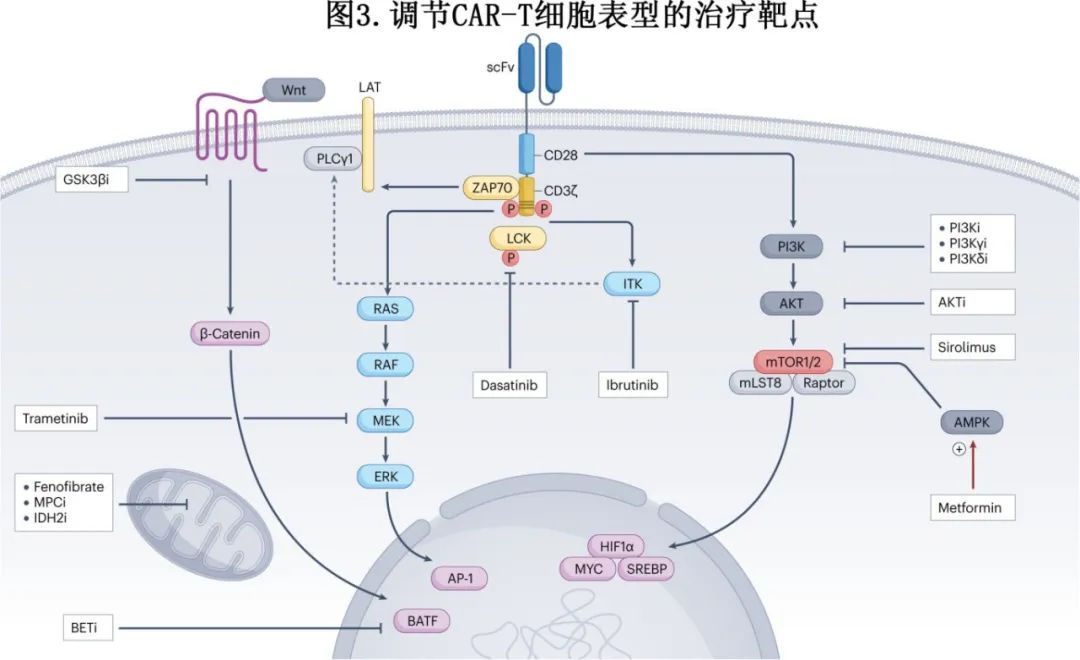
替代CAR设计
虽然临床采用已建立的药理学药物,具有明确的安全性,应该优先用于管理已建立的CAR-T细胞疗法,以改善炎症毒性管理,但未来的治疗路径也受到细胞工程化策略的影响,提高CAR-T细胞安全性和有效性的工程化策略如下。
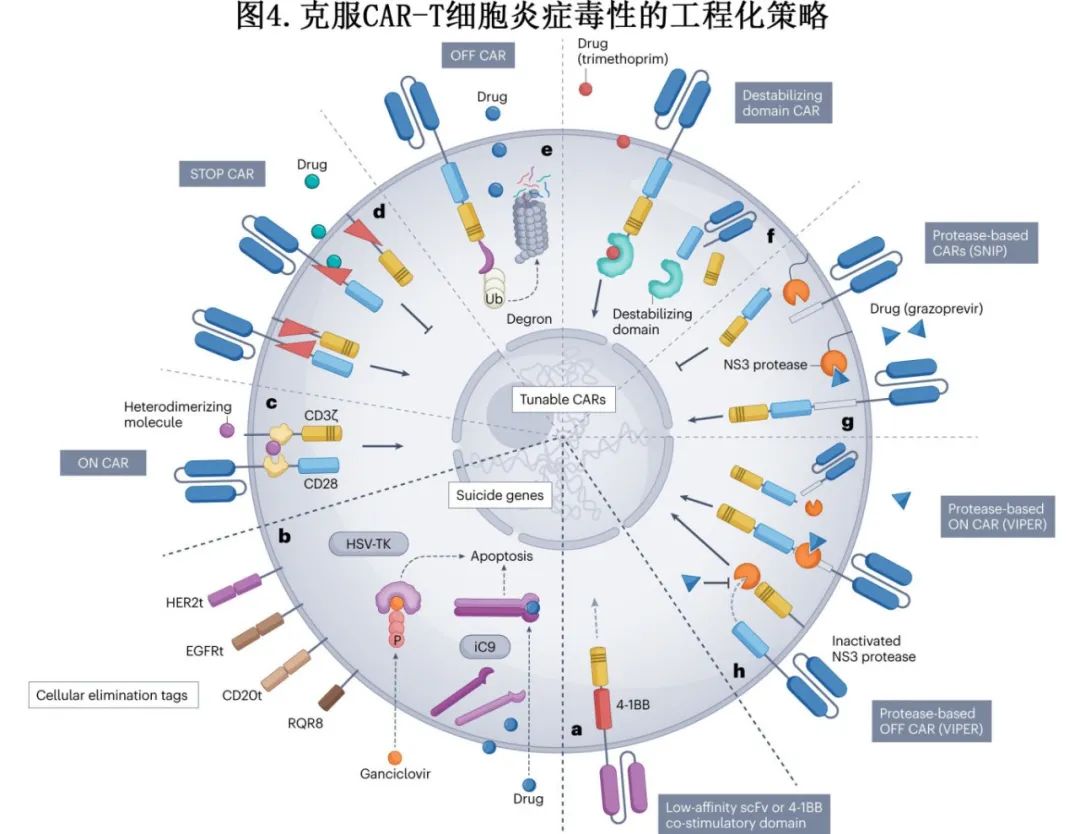
调节CAR信号传导:通过改变共刺激域、铰链区、CD3ζ链序列、抗原识别域的亲和力或转基因传递方法来调节CAR-T细胞的激活动力学和炎症毒性发生率。
自杀基因:开发了多种“自杀基因”系统,如HSV-TK和iC9,以及细胞表面抗原标签(如截短的CD20、EGFR或HER2),以便在毒性发生时通过抗体依赖性细胞毒性(ADCC)或补体依赖性细胞毒性(CDC)来清除CAR-T细胞。
可调节CAR:通过药物触发来调节CAR信号或表达,例如ON CAR需要小分子药物来激活,而STOP CAR和OFF CAR则通过药物来抑制或降解CAR蛋白。
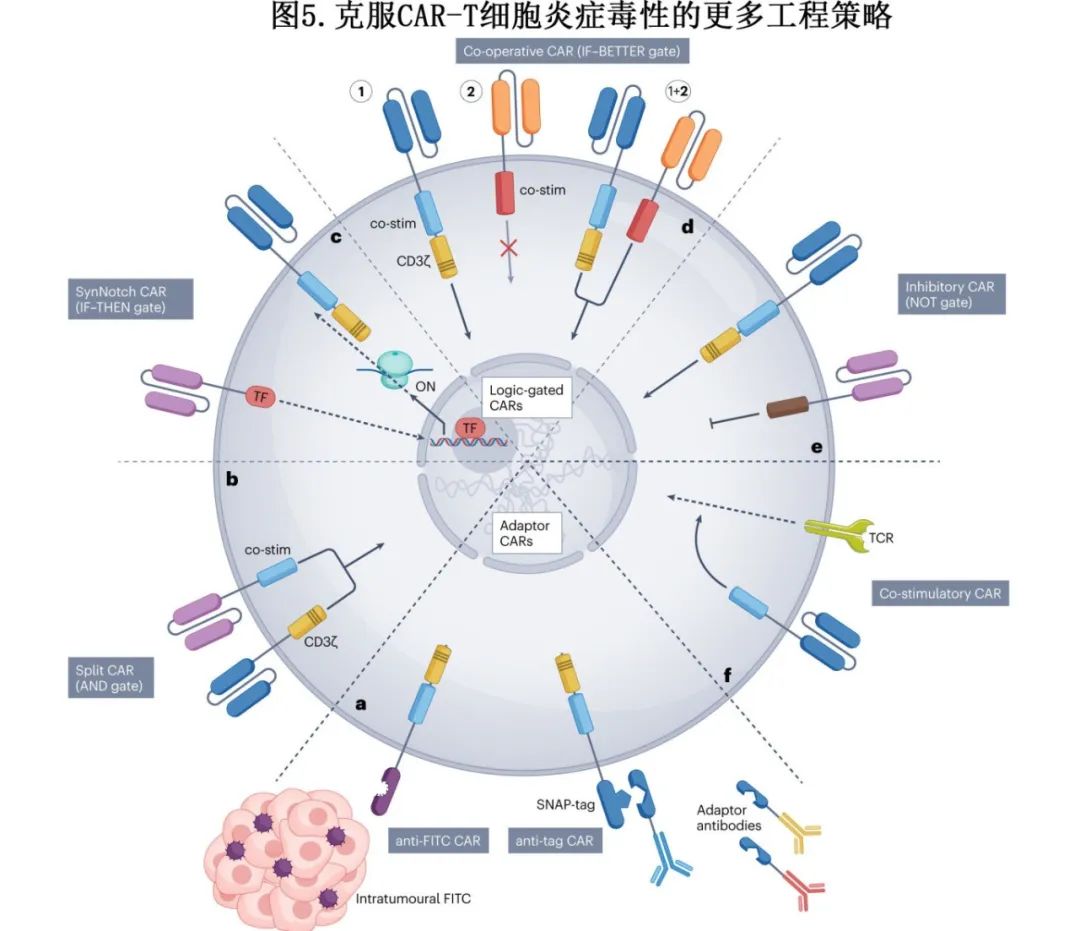
蛋白适配器与通用CAR:这些系统使用细胞外连接物或抗体来控制CAR-T细胞的激活,实现CAR-T细胞活性的可逆调节。
逻辑门控CAR:基于布尔逻辑门控,开发了多种逻辑门控CAR,如分裂CAR(AND门)、SynNotch CAR(IF-THEN门)、协同CAR(IF-BETTER门)和抑制性CAR(NOT门),以增强CAR-T细胞的安全性。
生物材料:通过添加PEG间隔或温度敏感的水凝胶来调节CAR-T细胞与肿瘤微环境的相互作用,减少CRS和ICANS的发生。
总结
尽管CAR-T细胞毒性管理仍是一个关键挑战,但最近在理解病理生理学和开发新治疗策略方面的进展为改善结果带来了希望。未来的研究应集中在优化现有药物的使用、探索新的路径和靶点以及开发更安全的CAR-T细胞设计,以增强治疗效果并最小化毒性。
参考文献
Mulvey, A., Trueb, L., Coukos, G. et al. Novel strategies to manage CAR-T cell toxicity. Nat Rev Drug Discov (2025). https://doi.org/10.1038/s41573-024-01100-5


