IMWG免疫治疗委员会关于多发性骨髓瘤免疫治疗顺序的建议
时间:2025-02-04 12:10:05 热度:37.1℃ 作者:网络
免疫治疗顺序
T 细胞重定向治疗 (TCRT) 代表着多发性骨髓瘤 (MM) 治疗的显著进步,特别是嵌合抗原受体 T 细胞治疗(CAR-T细胞)和双特异性 T 细胞衔接器 (TCE)。目前已有有多种产品上市,还有多种产品正在开发中,它们主要靶向 B 细胞成熟抗原 (BCMA) 和G蛋白偶联受体 C 类5成员D(GRPC5D)。基于高质量证据,国际骨髓瘤工作组(IMWG)免疫治疗委员会于近期发表了关于CAR-T和TCE治疗在复发或难治性多发性骨髓瘤(RRMM)中的最佳应用的建议。
随着多种免疫疗法的相对快速可用,TCRT靶点和作用机制的不断增加,也将出现更多的连续TCRT的排列组合。因此,应了解某种TCRT对肿瘤生物学、免疫微环境的影响,以及如何影响后续免疫治疗的安全性和有效性,从而优化免疫治疗的使用顺序。
MWG免疫治疗委员会于2024年3月组织了全球30余位骨髓瘤专家组成的专家小组,审查了影响免疫治疗疗效和安全性的患者和疾病相关因素,总结了治疗顺序的现有信息,并提出了系列核心建议,近日发表于《Leukemia》,我国骨髓瘤专家杜鹃教授(上海长征医院)参与共同撰写。

可用的免疫治疗
自体CAR-T细胞
对于自体CAR-T细胞治疗,患者先进行单个核细胞的分离,然后进行制备,包括T细胞纯化、CAR转染(通常使用慢病毒载体)、体外扩增和质控。CAR转基因编码一个或多个抗原识别结构域,这些结构域来自抗体结构、铰链区、跨膜结构域和细胞内信号传导结构域。CAR转基因整合到T细胞基因组中,从而允许其长期表达。CAR-T细胞在短期清淋化疗(LDC,多为氟达拉滨和环磷酰胺)后回输到患者体内。CAR-T细胞识别并结合靶抗原(例如,B细胞成熟抗原,BCMA),引起T细胞扩增和活化,最终导致T细胞诱导靶细胞溶解。
基于 KarMMa 研究的初步结果,idecabtagene vicleucel(ide-cel)成为MM中第一种可用的CAR-T 细胞疗法,该研究评估了 ide-cel 在既往接受过至少3线治疗(包括蛋白酶体抑制剂 [PI]、免疫调节剂 [IMiD]和抗 CD38 单克隆抗体[mAb])的患者中的疗效。总缓解率 (ORR) 为73%,其中33%达到≥完全缓解 (CR)。中位无进展生存期 (PFS) 为8.8个月,其中最高安全细胞剂量组患者达到12.1个月。随后的 III 期 KarMMa-3 研究在既往接受过≥2线治疗(包括PI、IMiD和抗CD38 mAb)的患者中比较了 ide-cel 与特定标准治疗 (SOC) 方案的疗效。与 SOC 相比,Ide-cel的 PFS 更优 (HR=0.49),中位 PFS 为13.3个月vs. 4.4个月,支持 ide-cel 在部分国家早期治疗线中的可用性。
Ciltacabtagene autoleucel (cilta-cel) 每个 CAR 有两个 BCMA 结合域,旨在增强活性。CARTITUDE-1是一项 1b/2 期研究,在接受过≥3线治疗方案或对PI 和 IMiD耐药的MM 患者中评估cilta-cel。所有 CARTITUDE-1 受试者均为三类暴露,即接受过PI、IMiD和抗 CD38 mAb 治疗。ORR为98%,83%的患者达到严格意义的CR(sCR),中位 PFS 为34.9个月。虽然 cilta-cel 具有深度和持久的反应,但6%的 CARTITUDE-1 受试者随后发生帕金森综合征,10%随后发生髓系恶性肿瘤。
随后的3期 CARTITUDE-4 研究在既往接受过1-3线治疗的来那度胺耐药 MM 患者中比较了cilta-cel与特定 SOC 方案的疗效,值得注意的是,该研究不需要既往抗CD38 mAb暴露。中位随访33.6个月,与 SOC 相比,cilta-cel与 PFS 改善相关 (未达到 vs 11.8个月;HR=0.29),也与总生存期 (OS) 改善相关 (HR=0.55)。帕金森综合征和继发性血液恶性肿瘤的发生率分别为1%和3%。CARTITUDE-4的结果使cilta-cel在部分国家获批用于来那度胺耐药MM 患者的一线治疗。
双特异性T细胞衔接抗体
TCE(也称为双特异性抗体)由具有Fab结构域的合成抗体(衔接T细胞上的CD3)和一个或多个Fab结构域(衔接肿瘤细胞表面抗原)组成。含有FC部分的TCE通常会进行修饰,以最大限度地减少补体激活并优化药代动力学。TCE同时与这两个靶点结合,促进T细胞进入肿瘤微环境,并足以触发T细胞的激活和肿瘤细胞的裂解,从而释放促凋亡穿孔素和颗粒酶,同时通过促炎细胞因子激活其他免疫细胞。
特立妥单抗(Teclistamab)是一种BCMAxCD3 TCE,首次在 MajesTEC-1 研究中进行评估,纳入既往接受过至少3线治疗且三类暴露的患者。在接受推荐的 II 期剂量 (RP2D)下治疗的165例患者中,ORR为63%,其中39%达到≥CR,中位 PFS 为11.3个月。MagnetisMM-3 研究在相似患者人群中评估了Elranatamab(BCMAxCD3 TCE),结果ORR为61%,35%≥CR,中位 PFS 为17.2个月。
感染是 BCMAxCD3 TCE 最重要的不良事件 (AE) 。然而根据现有的共识建议,通过抗微生物预防和免疫球蛋白替代治疗(如静脉注射免疫球蛋白)可大大降低感染风险。
Talquetamab 是目前唯一获批的非BCMA TCRT,由GPRC5DxCD3 TCE组成。在 MonumenTAL-1 研究中,使用 talquetamab 治疗既往接受过至少3线治疗的三类暴露 RRMM 患者。在接受最佳剂量和方案治疗的297例患者中,ORR为70-74%,33-40%达到≥CR。talquetamab的缓解持久,在不同 RP2D 中,中位 PFS 为7.5–11.2个月。虽然 talquetamab 组的感染并发症发生率低于 BCMAxCD3 TCE 组,但高达63%的患者发生其他独特的非肿瘤靶向毒性 (on-target off-Tumor,OTOT) 不良事件,如味觉障碍、皮肤和指甲变化。
特立妥单抗、elranatamab和 talquetamab 均为皮下给药,采用递增剂量给药可减轻细胞因子释放综合征 (CRS) 和免疫效应细胞相关神经毒性综合征 (ICANS) 的风险和严重程度。与几乎所有既往 RRMM 研究一样,初始 TCE 研究都是以全强度给予RP2D,直至疾病进展。然而鉴于其前所未有的缓解深度和持久性,TCE的最佳持续时间和剂量强度也在积极研究。此外,这些药物在不同国家获批的RRMM适应症也略有不同。
其他和即将到来的免疫疗法
许多新型 TCRT 使用非 BCMA 靶点或双抗原靶点。在MCARH109(自体 GPRC5D CAR-T 细胞疗法)的首次人体研究中,17例重度经治 MM 的缓解率为71%。另一种 GPRC5D CAR-T 细胞也在33例 RRMM 患者人群中产生91%的ORR,尽管大多数患者既往未暴露于抗 CD38 mAb 治疗。BMS-986393(GPRC5D CAR-T 细胞产品)一项正在进行的更大规模单臂研究,84例 RRMM 患者的ORR 为88%。有趣的是,与GPRC5DxCD3 TCE相比,GPRC5D CAR-T细胞疗法的OTOT毒性(如读写困难)似乎更少、更轻、持续时间更短。最后,双靶自体CAR-T细胞(例如靶向BCMA/GPRC5D或BCMA/CD19的CAR-T细胞)正在开发中,初步结果很有希望。
异基因“现货型”CAR-T细胞来源于健康供者,旨在克服自体CAR-T细胞的两个重要限制,即T细胞健康度(fitness)不足和由于自体产品制备时间而导致的患者损耗。在一项单臂研究中,ALLO-715以最佳剂量治疗时70%的患者产生应答,但由于使用包括抗CD52单抗在内的强化LDC,患者出现显著的感染负担。未来的异基因平台将纳入新型CAR制备策略(例如非病毒DNA递送技术或CRISPR编辑),从而消除对强化LDC的需求。例如P-BCMA-ALLO-1不需要CD52阻断作为清淋的一部分,即使在先前暴露于自体BCMA CAR-T细胞的患者中也显示出应答。
Cevostamab是一种静脉TCE,也靶向FcRH5(Fc受体同源物5)。在160例 RRMM患者的1期研究中,最高剂量水平的 cevostamab 产生55%的ORR,主要毒性为 CRS 和神经毒性。其他开发中的 TCE包括三特异性抗体JNJ-79635322和ISB2001,其具有BCMAxGPRC5DxCD3和 BCMAxCD38xCD3,可同时结合靶向两种 MM 表面抗原。
最后,玛贝兰妥单抗(belantamab mafadotin,belamaf) 是一种抗 BCMA 单克隆抗体-药物偶联物 (ADC),以单甲基auristatin F(微管干扰剂)作为有效载荷。玛贝兰妥单抗在接近三分之一的三类暴露 RRMM 患者中引起客观缓解。玛贝兰妥单抗最重要的毒性为血小板减少和角膜病变;后者通常导致一过性视力丧失,是真实世界实践中频繁减量和遗漏给药的原因。在 DREAMM-3 研究中,玛贝兰妥单抗单药治疗未优于泊马度胺和地塞米松。然而基于 DREAMM-7 和 DREAMM-8 研究显示基于玛贝兰妥单抗的三药方案的 PFS 优于获批的三药方案,预计未来几年玛贝兰妥单抗将在更多国家上市。因此,虽然玛贝兰妥单抗目前并非治疗RRMM的考虑,但该文章也纳入了玛贝兰妥单抗相关TCRT 顺序的现有真实世界数据。
治疗顺序的考虑因素
常规治疗对后续免疫治疗的影响
多种 MM 治疗可能潜在阻碍后续 CAR-T 细胞和 TCE 的有效性。MM关键CAR-T 细胞研究中的大多数患者为三类暴露,鉴于这些药物在 CAR-T 治疗之前已普遍接受过治疗,已知这些类别的药物可安全用于计划随后进行 TCRT 的患者。值得注意的是,这些研究通常需要在单采前对所有 MM 药物进行2周洗脱期;然而,目前尚不清楚常规药物与单采的接近程度对制备成功和CAR-T疗效的确切影响。虽然临床前数据表明IMiDs可能增强效应T细胞功能,但在TCRT中还需要对该假设进行临床验证。
鉴于多项淋巴瘤研究的证据表明苯达莫司汀对T细胞具有长期不利影响,因此在 TCRT 前应避免使用苯达莫司汀(不考虑间隔时间)。
Holding治疗和桥接治疗
自体CAR-T细胞疗法在治疗RRMM方面具有变革性。然而在当前,该过程经常遇到障碍,例如财务结算、制造槽的可用性以及机构的单采能力。除质量控制外,从单采至 LDC 的时间至后续输注 CAR-T 细胞之间通常间隔数周(“静脉-静脉[vein to vein]”时间),在决定CAR-T 细胞治疗至输注之间则会间隔更长的时间(“脑-静脉[brain to vein]”时间)。这种延迟可能通过允许不受控制的肿瘤进展而危及 CAR-T 细胞输注的安全性和可行性。事实上,对于特定患者,在CAR-T细胞和TCE之间进行选择的主要决定因素之一便是疾病的进展速度,具有暴发性疾病进展的MM患者要么无法进行CAR-T细胞输注,要么会在CAR-T细胞治疗期间出现更多并发症。
桥接治疗 (BT) 是在制备期间给予的抗浆细胞治疗,以提供疾病控制并允许 CAR-T 细胞安全给药。区分BT与单采前的抗 MM 治疗(即“holding therapy”,HT)非常重要。BT也不同于LDC,后者是一个非常标准化的治疗,通常采用氟达拉滨联合环磷酰胺,在CAR-T 细胞输注前立即进行,旨在诱导显著的淋巴细胞减少,创造有利于 CAR-T 细胞扩增和持续的最佳细胞因子环境(图1)。
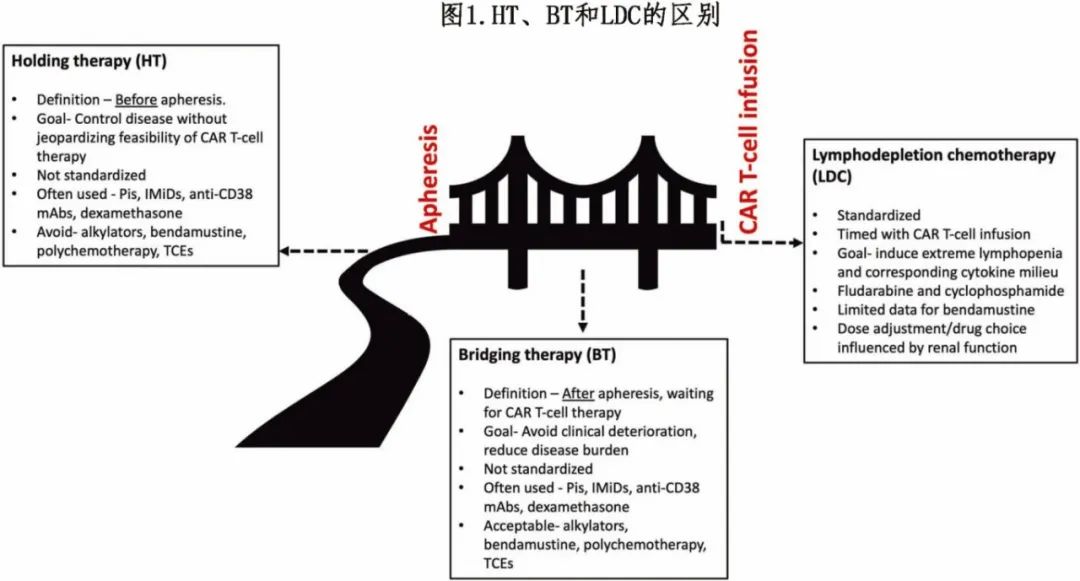
根据疾病进展的速度,白细胞单采和 CAR-T 细胞回输之间的时间可能非常混乱。疾病快速进展的患者可能会出现血细胞减少恶化、进行性器官功能障碍和功能状态下降。此外,在疾病负荷较高的情况下回输CAR-T 细胞可能与 CRS 和神经毒性的级别和严重程度较高特别相关,例如在CARTITUDE-4研究中,在进展的情况下接受cilta-cel作为后续治疗(在LDC开始前)的患者发生免疫介导的毒性甚至死亡的比例很高。
在重度经治 RRMM 患者中,如果在既往治疗期间疾病进展时决定进行 CAR-T 细胞治疗,若疾病在接下来4-6周内发病的可能性较高且存在预期可达到缓解的安全选择,则建议进行BT。首选使用疗程前几周已暴露的前期方案(Front-loaded regimens),以便在开始LDC前使毒性恢复。
全身治疗的选择必须根据既往治疗史、暴露/难治性状况、毒性概况以及合并症进行个体化治疗。一般来说,对于三类难治患者,如果无卡非佐米暴露史且没有临床禁忌,则首选以卡非佐米为基础的联合用药(联合低剂量环磷酰胺或泊马度胺)。其他选择包括低剂量每周一次塞利尼索联合方案和在t(11;14) 患者中超说明书使用 BCL2 抑制剂维奈克拉。对于近期未暴露于烷化剂且疾病负荷高和疾病进展快的患者,应考虑进行强化多药烷化剂联合治疗;该方案的结局劣于其他疗法,突出了个性化治疗的需要。TCE的最新可用性为 BT 提供了一种有吸引力的新策略。虽然在BCMA CAR-T之前使用BCMA CE作为BT可能会增加疗效下降的风险,但使用GPRC5D TCE可以通过靶向不同的抗原来绕过该风险,有可能根除BCMA低表达或无表达(但仍然表达GPRC5D)的疾病克隆。一些研究小组已经证明了该方法作为 HT 和 BT 的可行性,具有极好的短期结局。如果考虑使用,建议在单采后立即开始TCE。关于TCE作为BT的持续时间的数据仍缺乏,建议继续BT直到细胞成功制备。虽然BT通常包括全身治疗,但局部姑息性放疗也可作为选择,特别是对于有症状的髓外病变患者,或者如果有重要器官即将受损的风险的患者。对于并非三类难治的患者,或CD38单抗未暴露或敏感的患者,鉴于其安全性和有效性,基于抗CD38单抗的联合治疗仍是首选策略。
随着 CAR-T 细胞的适应症扩展至早期治疗线,将会有更多安全有效的全身治疗选择。最后,快速制备和异基因平台的开发可能最终避免 BT 的需求。
宿主和肿瘤因素对治疗顺序的影响
考虑到既往治疗可能损害免疫效应细胞的数量和质量上,为考虑MM免疫治疗的顺序增加了额外的复杂性。这些变化具有临床意义,因为 T 细胞特征是 CAR-T 细胞和 TCE 应答的重要决定因素。例如,预先存在的淋巴细胞减少(在单采前使用苯达莫司汀或烷化剂时可能发生)可能在 CAR-T 细胞治疗后恶化结局,或可能妨碍成功制备自体制品。此外,T细胞与 TCE 的持续活化导致抑制性受体表达增加,可能导致体外试验中抗肿瘤疗效受损。然而在 TCE 治疗患者的临床样本中,T细胞耗竭在多大程度上负面影响后续免疫治疗应答的深度和持续时间,仍有待功能证实。正如近期研究所示,可变因素(包括疾病负荷、靶向抗原密度、突变或脱落、效应物与靶标比值 [T 细胞绝对计数与疾病负荷] 和 T 细胞功能障碍)可降低部分接受 TCRT 序贯治疗患者的缓解率。
与T细胞功能无关,连续使用靶向相同抗原的治疗也可能使患者在第二次治疗时的预后较差。例如对于未接受过抗BCMA治疗(BCMA-naïve)的患者,MM细胞上的BCMA表达不太可能不充分,也不太可能影响抗BCMA治疗的反应;即使在存在TNFRSF17单等位基因拷贝缺失(在16p染色体上,编码BCMA)的患者(BCMA-naïve患者中约5-10% )中也是如此。相比之下,在大约40%的患者中,选择性抗原压力与BCMA靶向治疗的临床显著变化(例如双等位基因BCMA丢失或单等位基因丢失加胞外突变)有关。这种风险也适用于玛贝兰妥单抗,最近报道了治疗失败后BCMA双等位基因丢失。
对于GPRC5D,治疗前约15%的患者存在染色体 12p 单等位基因拷贝丢失。也许由于其在浆细胞存活中的非必需作用(与 BCMA 不同),在 GPRC5D 靶向 TCE 的选择压力下,随着双等位基因丢失或单等位基因丢失加跨膜或胞外域突变的几个克隆的出现,趋同进化(convergent evolution)的发生频率似乎更高。同样,在大多数 GPRC5D CAR-T 细胞治疗后进展的患者中报道了 GPRC5D 抗原丢失。重要的是,在经过特定治疗后,BCMA或GPRC5D胞外结构域的突变并不一定会阻碍靶向同一抗原的不同药物的结合。未来,更好的诊断和预测研究将有助于指导关于序贯 BCMA 或 GPRC5D 治疗预期疗效的决策。
因此,必须根据专家共识和有限的数据,在自体 CAR-T 细胞治疗前就TCE作为 HT 或BT提出建议。一般而言,TCE应避免作为HT(无论靶点如何),原因有两个:首先,由于进入骨髓和其他 MM 部位,TCE(尤其是在最初的1-2个周期中)可导致严重的淋巴细胞减少。其次,如上所述,连续 TCE 暴露可导致 T 细胞功能障碍。与未经 TCE 治疗的患者相比,在 TCE 后立即接受 CAR-T 细胞治疗的患者发生制备失败的风险更高,且缓解持续时间更短。鉴于停药间隔可以使 T 细胞数量和功能恢复,建议在单采前进行至少4周的 TCE 洗脱期,无论 TCE 靶点如何。单采后TCE治疗作为 BT 则是合理的,尤其是靶向与 CAR-T 细胞不同的抗原时。
此外应注意,TCE的生物学影响可能超过其半衰期。例如,与 BCMA TCE 相关的低丙球蛋白血症在停药后6个月内仍未恢复。真实世界数据表明,如果之前的 TCE 或 ADC 靶向与CAR-T 细胞产品相同的抗原,则既往药物停药后的间隔时间与 CAR-T 细胞治疗成功的可能性相关。但这种相关性也受到疾病特征的混淆,即侵袭性更强的 MM 患者的无治疗间期也会更短(由于潜在的疾病生物学)。
衰弱的考虑及其对治疗顺序的影响
考虑到免疫治疗相关毒性(如 CRS 和神经毒性)的独特和多器官表现,患者衰弱是 MM 免疫疗法顺序中的重要考虑因素,可能常规 MM 疗法更是如此。大多数衰弱评估工具是在免疫治疗前时代开发和验证的,因此它们的预后能力以及预测免疫治疗特有毒性影响的潜力仍然未知。考虑到 MM 的动态衰弱原则,有效治疗可改善患者并消除衰弱的负面影响,因此如果治疗顺序正确,则CAR-T细胞治疗和 TCE 可能改善衰弱患者的预后。另一方面,如果顺序错误,患者可能因疾病相关表现或治疗相关毒性而变得过于衰弱,根本不考虑 MM 免疫治疗。
虽然 MM 临床研究中越来越多地纳入衰弱评估,但关于衰弱对接受 TCRT 的患者影响的数据仍然很少。MagnetisMM-3研究的事后衰弱分析显示,elranatamab治疗后,非衰弱 (n=84) 与衰弱患者 (n=39) 的 ORR 相似 (63% vs. 56%),两组的CRS、神经毒性和≥3级感染率也相似。在真实世界中,衰弱对 T 细胞衔接系统结局的影响尚不清楚;然而一项分析指出,在体能状态较差的患者中,多变量分析显示总缓解率和 PFS 较差。在一项接受 CAR-T 细胞治疗的真实世界患者系列中,与非衰弱成人相比,衰弱成人中所有级别 ICANS 的发生率略高。同样,国际血液和骨髓研究中心 (CIBMTR) 的登记组数据也指出,高龄 (> 70 vs. < 60) 与神经毒性的高发生率相关。未来需要更大的系列研究,用于验证和了解在接受这些药物治疗的老年和衰弱成人中的毒性的潜在机制。
治疗顺序的具体场景
BCMA CAR-T细胞治疗后TCRT治疗
给予相同的 CAR-T 细胞疗法再治疗似乎并非有效策略(表1)。在 ide-cel 的 KarMMa-1 研究中,再次接受 ide-cel 治疗的28例患者中仅6例达到缓解。抗药抗体是否在再治疗的反应中发挥作用,目前尚不清楚。在 CARTITUDE-1 中,研究期间再次接受cilta-cel治疗的3例患者均未出现反应。根据真实世界数据,换用其他 BCMA CAR-T 细胞疗法可能是一种有效策略。对于对初始 BCMA CAR-T 细胞治疗反应足够长的患者,在复发时尝试不同的 BCMA CAR-T 细胞治疗可能是合理的。

已有研究BCMA CAR-T 细胞治疗后给予 BCMA TCE。在 MajesTEC-1 研究的一个专门队列中,在既往 BCMA CAR-T 细胞治疗后接受特立妥单抗治疗的15例患者中,ORR为53%,但中位 PFS 仅为4.4个月。在后续 TCRT 的背景下,ORR似乎不会像 PFS 那样受到不利影响。例如在既往接受过 BCMA CAR-T 细胞治疗的患者中进行的 elranatamab 汇总分析显示,ORR为53%,但中位 PFS 为10.0个月。真实世界数据也表明,在上次 BCMA 靶向治疗后时间较长(> 6个月)的患者中有反应更好的信号。但需要注意的是,侵袭性更强的 MM 和 T 细胞健康度受损的常见混杂因素在此处仍然适用。
有人推测,在 BCMA CAR-T 细胞治疗后复发后改变 TCRT 靶点可能会产生更好结局。GPRC5D已成为 TCE 和 CAR-T 细胞的主要靶点。MCARH109是一种研究性 GPRC5D CAR-T 细胞,在既往接受过 BCMA CAR-T 细胞治疗的6/8例患者中产生客观缓解。BMS-986393也是一种研究性 GPRC5D CAR-T 细胞,在39例既往接受过 BCMA 靶向治疗的患者中产生78%的ORR,其中30例既往接受过 CAR-T 细胞治疗。总之,在大多数情况下,BCMA靶向治疗后GPRC5D CAR-T 细胞治疗似乎有效。
在 BCMA CAR-T 细胞后使用 GPRC5D TCE talquetamab 也有数据。在 MonumenTAL-1 入组的56例既往接受过 BCMA CAR-T 细胞治疗的患者中,71%达到客观缓解且缓解持久(中位缓解持续时间为12.3个月)。
在 TRIMM 2 研究中,talquetamab联合达雷妥尤单抗治疗 RRMM 患者,11例既往接受过 BCMA CAR-T 细胞治疗的患者中9例出现客观缓解,而talquetamab、达雷妥尤单抗和泊马度胺联合治疗使20/24例患者缓解。Forimtamig的 I 期研究也证实了 GPRCD5D TCE 对既往接受过 BCMA CAR-T 细胞治疗的 RRMM 的疗效(表1)。
在专门针对既往接受过 BCMA 靶向治疗的患者的 CAMMA 2 队列中检测了Cevostamab(一种试验性FcRH5xCD3 TCE)。在11例既往接受过 BCMA CAR-T 细胞治疗的患者中,ORR为73%。
总之,这些数据似乎支持在 BCMA CAR-T 细胞治疗失败后的疾病进展中使用不同的治疗靶点,但还需要更多的数据来确定特定 MM 细胞抗原(例如 GPRC5D 或FcRH5)或特定治疗方式(CAR-T细胞或TCE)在这种情况下是否更好。虽然 BCMA CAR-T 细胞治疗复发后给予 BCMA TCE 可能是合理的,但可能最适合既往 CAR-T 细胞治疗后间隔更长的患者。
BCMA TCE后TCRT治疗
BCMA TCE 后使用 TCRT 的数据极少(表2)。CARTITUDE-2研究的队列 C 描述了7例在既往 BCMA TCE 暴露后接受 cilta-cel 的患者;有4例缓解,但中位 PFS 仅5.3个月;该小样本中也有3例死亡,包括2例感染导致。一项 ide-cel 的多中心真实世界研究纳入7例既往接受过 BCMA TCE 的患者;6例患者达到缓解,但中位 PFS 仅2.8个月。BCMA TCE 临床研究均未纳入既往接受过 BCMA TCE 的患者,该顺序也尚未在真实世界数据中描述。
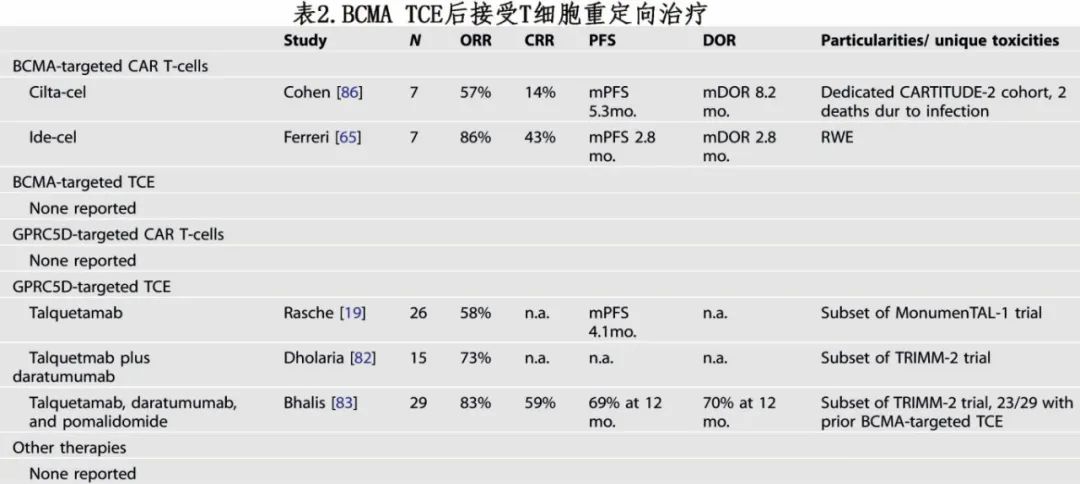
少数既往接受过 BCMA TCE 的患者接受了 GPRC5D CAR-T 细胞 BMS-986393 治疗,但未报道该亚组的结果。talquetamab 的II期 MonumenTAL-1 研究报告了26例既往接受过 BCMA TCE 的患者:ORR为58%,但中位 PFS仅4.1个月。值得注意的是,与TCE 作为任何既往治疗线相比,接受 TCE 作为末线治疗的患者中 talquetamab 治疗的 ORR 较低 (61% vs. 29%)。事实上在真实世界中,即使使用不同靶点,在TCE 后进行另一个 TCE 治疗时ORR也仅为33%。该情况可能是由于 T 细胞功能障碍(而非靶抗原丢失)是复发的驱动因素。
一般而言,BCMA TCE 治疗后免疫治疗的数据很少,现有数据似乎表明单药治疗的疗效受损(即使后续治疗使用不同靶点)。联合策略可能更有前景,例如在 TRIMM-2 队列中,在 GPRC5DxCD3 TCE talquetamab 的基础上加用达雷妥尤单抗和泊马度胺后,在23/29例既往接受过 TCE 治疗(主要是靶向 BCMA)的患者中观察到缓解。需要未来研究及更长时间随访,以评估该方案的长期成功。
BCMA ADC治疗后TCRT治疗
如表3所示,CARTITUDE-2 队列 C(cilta-cel)和ide-cel真实世界研究均表明,在接受过玛贝兰妥单抗的患者中BCMA CAR-T细胞的长期结局较差。虽然两种情况下的 ORR 均超过60%,但cilta-cel和ide-cel组的中位 PFS 仅为9.5个月和3.2个。
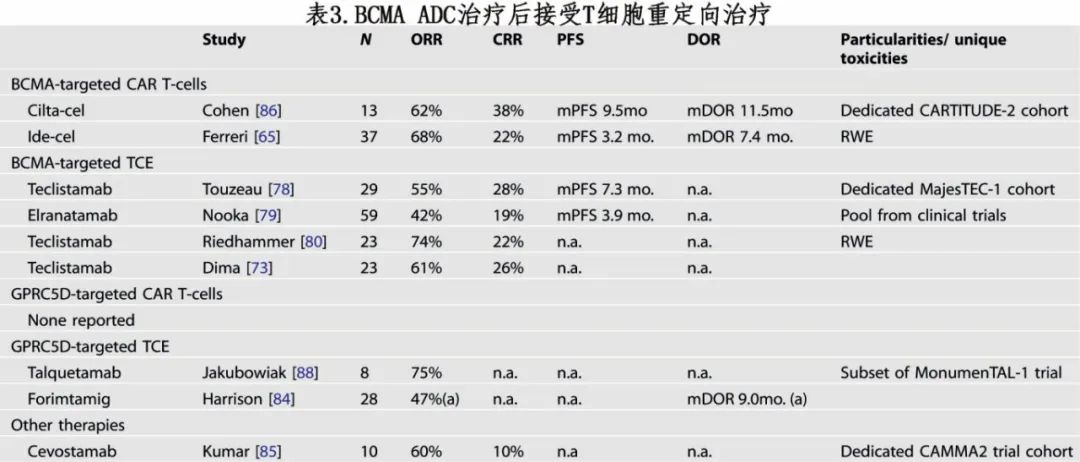
在特立妥单抗的 MajesTEC-1 研究中,29例既往接受过 ADC 治疗,ORR为55%,PFS为7.3个月。在真实世界研究中,既往接受过玛贝兰妥单抗治疗的患者中特立妥单抗治疗的 ORR 为61-74%。在对研究中接受 elranatamab 治疗的59例患者进行的汇总分析中,ORR为42%,但疾病控制相对较短。
GPRC5D CAR-T 细胞研究中纳入极少数既往接受过玛贝兰妥单抗治疗的患者,尚未报告其结局。在 MonumenTAL-1 中,8例既往接受过 TCRT 和玛贝兰妥单抗治疗的患者中有6例缓解。基于 talquetamab 的联合治疗研究中纳入既往接受过玛贝兰妥单抗治疗的患者,但尚未单独报告其结局。evostamab的 CAMMA 2 研究获得类似结果,10例既往接受过玛贝兰妥单抗治疗的患者中有6例缓解。总之,虽然既往使用玛贝兰妥单抗可能会损害后续 BCMA TCRT的缓解持久性,但有限数据未表明使用替代靶点会对 TCRT 产生相似影响。
GPRC5D靶向治疗后TCRT治疗
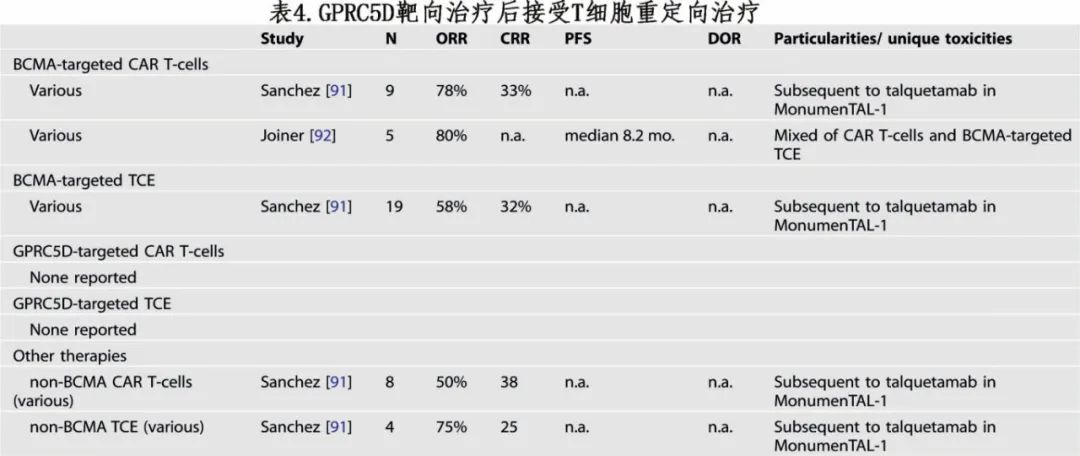
由于 BCMA 靶向治疗的一般开发早于 GPRC5D 靶向治疗,因此关于 GPRC5D 靶向治疗后后续 TCRT 的信息很少(表4)。talquetamab治疗后,9例接受 BCMA CAR-T 细胞治疗的患者中有7例缓解,19例接受 BCMA TCE 治疗的患者中有11例缓解。由于 GPRC5D 靶向治疗后抗原丢失或修饰似乎很常见,因此在获得额外数据之前,不建议使用第二种 GPRC5D 靶向药物。有限的信息表明,既往 GPRC5D TCRT 不会强烈影响使用不同靶点的 TCRT 的疗效。
TCRT后非TCRT治疗
TCRT 失败后尚未系统研究常规治疗,然而BCMA CAR-T 细胞治疗后的复发有时可通过非 TCRT 方法挽救治疗。新出现的临床前数据表明,XPO1抑制剂对 T 细胞的有害作用较小、增强作用较大。除了对恶性肿瘤细胞的直接细胞毒性外,XPO1抑制剂还可能调节免疫微环境,以促进 T 细胞完整性并减少 T 细胞耗竭的标志物。在 STOMP 研究中,基于塞利尼索的三药或四药联合治疗在11例既往接受过 BCMA 靶向治疗的患者中的7例 (64%) 中诱导缓解。另一份报告显示,BCMA CAR-T 细胞后复发的7例患者接受塞利尼索或塞利尼索联合治疗,有6例达到客观缓解,包括部分持久缓解。
iberdomide 和 mezigdomide 等CELMoD(cereblon E3连接酶调节剂)是口服研究性药物,效力高于IMiD。CC-220-MM001研究纳入41例既往暴露于 BCMA 靶向治疗的患者的专门队列,接受iberdomide联合地塞米松治疗。ORR为34%,似乎不受既往 BCMA 靶向治疗类型的影响;缓解患者中位 DOR 为7.5个月。同样,在30例既往接受过 BCMA 靶向治疗的患者中,mezigdomide联合地塞米松的 ORR 为50%,中位 DOR 为6.9个月,中位 PFS 为5.4个月。这些全口服两药方案还需要继续研究,对于不同 TCRT 不可取或不可行的情况可能特别有帮助。
由于大多数 TCRT 后进展的患者目前已接受PI、IMiD和抗 CD38 mAb 治疗,使用这类药物的联合治疗方案预期 ORR 不高于30%,中位 PFS 约为4个月,与既往观察性研究一致。但在一项单机构研究中,细胞毒化疗+/−干细胞支持或挽救性自体干细胞移植的 ORR 高达50%,因此仍是具有冻存干细胞的特定fit患者的可行选择,尤其是在疾病快速进展或血细胞减少的情况下,并且未来有机会使用新作用机制药物进行临床研究。
建议
未来的证据,无论是来自真实世界数据,还是来自随机对照研究,都必须更好地指导围绕 TCRT 顺序的决策。基于上文总结的现有证据,专家小组为 MM 中免疫治疗的最佳使用顺序制定了9项建议。
1. 对于接受PI、IMiD、(裸)单克隆抗体、皮质类固醇或联合方案作为最新治疗线的患者,无需担心后续TCRT。如果作为采集T细胞前的“holding therapy”,建议在最后一次常规药物给药和单个核细胞单采之间有2周的洗脱期。同样,建议在TCE首次给药之前对这些药物进行2周的洗脱。
2. 如果可行,避免正在接受TCE的患者采集单个核细胞。如果该顺序是患者的最佳选择,在末次TCE给药和单采之间应至少有4周的洗脱期;抑或,如果可能,应考虑在TCE开始前采集T细胞。
3. 对于后线治疗可能是CAR-T细胞和/或TCE的患者,避免使用大剂量烷基化剂和苯达莫司汀。
4. 在CAR-T细胞制备过程的4-6周内,对于高疾病负荷或有MM发病风险的患者,强烈考虑在单采后进行桥接治疗。理想的桥接治疗应包含对患者骨髓瘤无已知耐药性的药物、时间短、感染或长期血细胞减少的风险低。
5. 如果可及性相同,对于BCMA ADC和BCMA TCRT的候选患者,建议首先使用TCRT,因其疗效更高,且BCMA ADC后TCRT的疗效降低。
6. 如果可及性相同,对于BCMA CAR-T细胞和TCE的候选患者,建议进行CAR-T细胞治疗。该建议是考虑到CAR-T细胞治疗后进展时TCE的疗效具有更可靠的数据,以及CAR-T后的长期无治疗间隔(通常进展时挽救选择更多)。然而随着使用TCE联合治疗和不同抗原靶点序贯治疗的数据的发展(例如talquetamab后给予cilta-cel),该问题需要重新审视,特别是在特定人群中。
7. 对于疾病进展迅速且不太可能顺利度过单采和桥接的患者,应给予TCE(由于可及性更好)。
8. BCMA靶向免疫疗法和GPRC5D靶向免疫疗法在既往接受过BCMA CAR-T细胞治疗的患者中都是安全且有效的。相对于未接受过BCMA CAR-T细胞治疗的患者,在BCMA CAR-T细胞治疗后给予BCMA靶向治疗的反应较低且不持久。
9. 对于在批准的剂量强度下接受BCMA TCE治疗直至进展的患者,关于不同方式的BCMA靶向治疗的可行性和有效性数据有限。低剂量或固定时间治疗的结局尚不清楚。对于接受BCMA TCE治疗期间或之后不久进展的患者,建议给予不同作用机制的治疗或靶向不同抗原的免疫治疗。
参考文献
Costa, L.J., Banerjee, R., Mian, H. et al. International myeloma working group immunotherapy committee recommendation on sequencing immunotherapy for treatment of multiple myeloma. Leukemia (2025). https://doi.org/10.1038/s41375-024-02482-6


