【论肿道麻】癌症免疫治疗中代谢适应性与饮食的相互作用
时间:2025-01-31 12:09:00 热度:37.1℃ 作者:网络
癌症免疫疗法通过引入免疫检查点抑制剂以及增强过继性细胞免疫疗法来强化先天性癌症防御机制,取得了显著进展。肿瘤微环境(TME)中癌细胞的代谢重塑和营养竞争改变了许多免疫功能,影响了免疫细胞的适应性、极化、募集和存活。饮食因素也在驱动免疫治疗抵抗中发挥着重要作用。
2024年8月,Lena Espelage等人在《Clin Cancer Res》上发表了题为《The Interplay between Metabolic Adaptations and Diet in Cancer Immunotherapy》的综述。本综述重点强调并总结了目前对免疫治疗以及肿瘤细胞代谢变化的理解,讨论了饮食和特定营养素如何影响癌症免疫治疗。

免疫治疗处于癌症治疗的前沿,具有创新性和复杂性。最有前景的方法包括免疫检查点抑制(ICI)和过继性细胞免疫疗法(ACT),聚焦于抗肿瘤防御的关键角色:T细胞。因此,免疫治疗的策略旨在增强T细胞作为天然癌症防御机制的反应。调节T细胞代谢为增强其干细胞能力和长期记忆提供了潜力,进而改善其效应功能,同时减少T细胞耗竭。在肿瘤微环境(TME)中,T细胞依赖葡萄糖和氨基酸等营养物质和代谢物发挥作用。然而,它们必须与肿瘤细胞竞争以获取这些必要资源。除了T细胞外,先天性免疫系统中的其他细胞,包括巨噬细胞、自然杀伤(NK)细胞、髓系来源抑制细胞(MDSC)和中性粒细胞,也在TME中发挥着关键作用(图1)。这些细胞分泌各种细胞因子、趋化因子和其他因子,既可以对抗肿瘤也可以促进其生长。
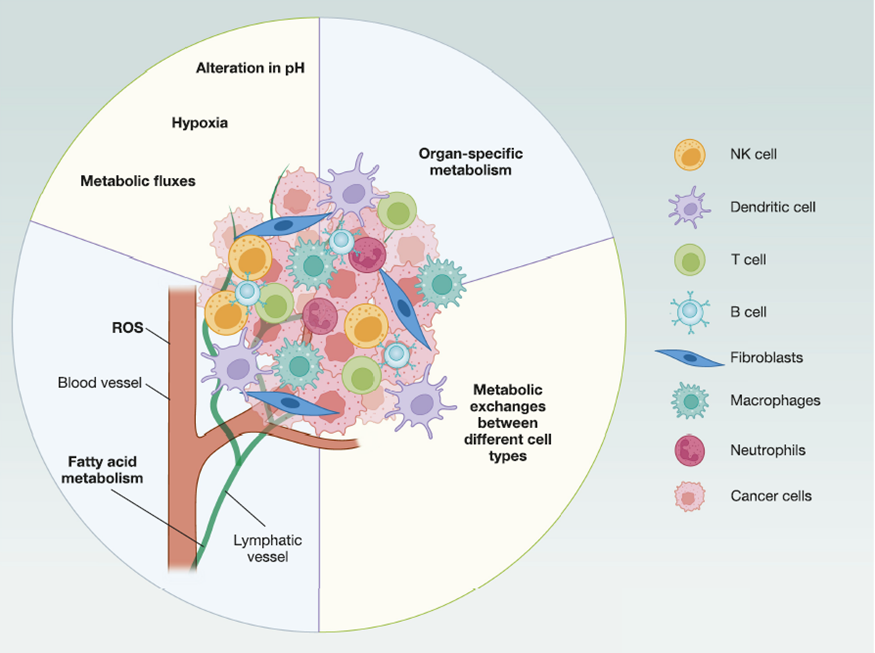
图1.
免疫检查点抑制剂治疗
免疫系统受到免疫检查点的严格调控,当免疫细胞(尤其是T细胞)与其表面蛋白结合时,免疫检查点就会被激活。在天然癌症防御的背景下,免疫检查点抑制剂(ICI)治疗的目的是阻断检查点蛋白与T细胞之间的相互作用,从而增强T细胞对癌细胞的破坏作用。
ICI治疗的基本原理是使用单克隆抗体抑制T细胞上的抑制性受体,增强其防御能力。其中一种ICI药物伊匹木单抗(ipilimumab)专注于抑制细胞毒性T淋巴细胞相关蛋白4(CTLA-4),该蛋白在CD4+和CD8+ T细胞表面组成性表达。靶向CTLA-4的ICI可以重新激活并扩增T细胞,但这依赖于抗原提呈细胞有效呈递肿瘤抗原以及主要组织相容性复合体(MHC)I类/II类分子对其的识别。同样,西米普利单抗(cemiplimab)、纳武利尤单抗(nivolumab)和帕博利珠单抗(pembrolizumab)等ICI药物靶向PD-1/PD-L1途径,导致T细胞的重新激活和扩增。
另一种ICI药物relatlimab,靶向淋巴细胞激活基因3(LAG-3)。LAG-3是一种在免疫细胞上表达的细胞表面分子,由活化的T细胞、B细胞、自然杀伤细胞和浆细胞样树突状细胞表达,由耗竭的T细胞上调。在包括黑色素瘤在内的多种癌症类型中,肿瘤浸润淋巴细胞上的LAG-3水平上调。LAG-3的上调有助于抑制T细胞增殖和T细胞活性的增强。
ICI药物在多种癌症类型中显示出显著的疗效,可具有持久的反应和延长生存期。然而,仍需要新的药物和组合来进一步提高治疗效果。对于黑色素瘤的患者,使用伊匹木单抗和纳武利尤单抗的ICI组合治疗显著提高了患者的生存期。最近在III期试验RELATIVITY-047中研究了LAG-3和PD-1的双重检查点抑制。研究表明,在黑色素瘤患者中,使用relatlimab(靶向LAG-3)联合纳武利尤单抗(靶向PD-1)可有效阻断LAG-3,从而提高患者的生存期。
过继性细胞免疫疗法(ACT)
ACT的治疗方法涉及从肿瘤患者体内分离出T细胞,这些T细胞随后在体外受控环境中通过生长因子或疫苗增强其抗肿瘤能力,经过这种体外增强处理后重新引入患者体内。
最新的基于T细胞的临床方法是创建经过嵌合抗原受体(CAR)工程改造的T细胞。在这个过程中,分离的T细胞会针对不同患者进行个性化调整,使其表达人工抗原结合受体(CAR)。因此,CAR不依赖于患者的组织相容性白细胞抗原类型,能够绕过肿瘤逃逸机制。CARs在调节信号传导方面具有更广泛的范围,包括T细胞增殖、T细胞持久性和肿瘤微环境(TME)内的活化等方面。在血液肿瘤的治疗方面, FDA已批准了六种CAR-T细胞疗法。ACT已被用于转移性黑色素瘤的治疗研究,因为黑色素瘤通常会引发强烈的免疫反应,并伴有大量肿瘤浸润淋巴细胞。然而,值得注意的是基于T细胞的治疗方式仍处于试验阶段,并面临许多障碍。肿瘤微环境(TME)的成分和免疫抑制条件对CAR-T细胞治疗的效果产生显著影响。这些挑战包括CAR-T细胞迁移受限、代谢条件不利、血管化受损、缺氧、抑制性免疫微环境、T细胞耗竭和肿瘤异质性。
此外,针对T细胞受体工程化T细胞(TCR-T)有效性的研发工作也在持续进行中,其增强了T细胞靶向特定抗原的特异性,可通过个性化设计避免耐药、提高反应率。
免疫治疗抵抗
免疫细胞的代谢变化
尽管免疫疗法在治疗高度恶性的癌症方面展现出了显著的疗效,但仍存在诸多挑战有待克服。肿瘤微环境(TME)中的免疫抑制机制以及免疫细胞和肿瘤细胞中的各种代谢改变,都可能促进免疫治疗抵抗的发展。
TME中的免疫细胞有很大一部分由中性粒细胞组成,在对抗肿瘤细胞中发挥着关键作用。然而,它们也在TME中表现出免疫抑制作用。最近的一项研究表明,中性粒细胞数量的增加会促进血管生成和肿瘤生长,进而为转移创造一个有利的环境。其中磷酸戊糖途径(PPP)发挥着至关重要的作用。在TME中存在高氧化应激条件下,中性粒细胞会将其以糖酵解为主的代谢转向磷酸戊糖途径,这种代谢转变能够生成更多的NADPH并降低活性氧(ROS)水平。另一方面,癌细胞依赖于其抗氧化防御机制,能够耐受TME中增加的ROS产生的有害影响。因此,磷酸戊糖途径产生的NADPH的增强支持了肿瘤细胞的抗氧化防御机制,进一步促进其生长。免疫抑制作用通常与中性粒细胞产生的大量ROS有关, ROS会抑制其他免疫细胞,尤其是T细胞。
肿瘤相关巨噬细胞(TAMs)传统上被分为两个亚群:促炎型(M1)和免疫抑制型(M2)。M1型TAMs通常表现出高度糖酵解代谢,其特点是分泌大量乳酸。从M1向M2巨噬细胞的转变是一个动态过程,主要受肿瘤微环境(TME)中缺氧条件和低pH值的影响。在缺氧的TME中,M2巨噬细胞分泌精氨酸酶,该酶抑制T细胞活性并增强免疫抑制。TAMs表达PD-L1和PD-1,促进免疫抑制。因此,TAMs可能通过阻碍细胞毒性T细胞接触肿瘤细胞,从而阻碍抗PD-1免疫治疗。
临床前研究探讨了NK细胞代谢改变对其抗肿瘤效果的影响。在TME中,NK细胞表现出GLUT1表达增加,这是由缺氧环境导致的。研究表明,NK细胞中的GLUT1表达增加会损害其抗肿瘤能力,因为减少了γ-干扰素(IFN-γ)和颗粒酶B的产生。
先前的研究表明,免疫检查点抑制剂(ICI)通过抑制糖酵解并促进脂肪酸氧化和脂解作用对免疫细胞代谢具有抑制作用。因此,更深入地理解信号级联和代谢网络之间的相互作用,为开发新型联合治疗方法提供了可能性。另一种策略是将ICI与代谢干预相结合,通过逆转免疫代谢功能障碍来增强抗肿瘤效果。Missiaen及其同事通过联合限制精氨酸和抑制丝氨酸/苏氨酸激酶GCN2的治疗,在肝细胞癌中实现了显著的肿瘤抑制。另一项研究表明,用二氯乙酸治疗可促进p53阳性肿瘤细胞中的氧化磷酸化,并通过诱导应激配体的表达来增强CAR-T细胞或同种异体NK细胞治疗的疗效。
癌细胞的代谢改变
在癌细胞中,致瘤因素和外在因素共同促进了对免疫治疗的原发性和获得性耐药性的发展。内在机制包括恶性肿瘤的固有分子特征,其阻碍了免疫系统产生抗肿瘤反应的能力。这些机制涉及抗原呈递的减少以及肿瘤微环境(TME)中免疫效应细胞的数量和质量的下降。例如,主要组织相容性复合体(MHC)的下调会导致γ-干扰素(IFN-γ)信号传导的改变,以及包括β-连环蛋白、p53和RAS/RAF/MAPK信号传导在内的致癌通路的失调。此外,程序性死亡配体1(PD-L1)的表达会导致其与配体程序性死亡受体1(PD-1)结合后T细胞耗竭。
为了满足癌细胞的高能量需求,肿瘤主要依赖糖酵解。事实上,增强的肿瘤内在糖酵解已被认为是黑色素瘤患者对免疫治疗产生耐药性的驱动因素。最近,Cascone及其同事研究表明,糖酵解相关基因如甘油醛-3-磷酸脱氢酶(GAPDH)、醛缩酶A(ALDOA)和烯醇化酶2(ENO2)的表达增强与来自黑色素瘤患者的肿瘤样本中的T细胞浸润呈负相关。这一发现表明,肿瘤糖酵解阻碍了T细胞介导的黑色素瘤细胞凋亡。因此,肿瘤微环境中葡萄糖消耗的增加可能会触发免疫细胞中的5’腺苷酸活化蛋白激酶(AMPK)的激活。从而,有利于免疫抑制细胞(如肿瘤相关巨噬细胞(TAMs)、髓系衍生抑制细胞(MDSCs)和调节性T细胞)在肿瘤微环境中的持续存在。
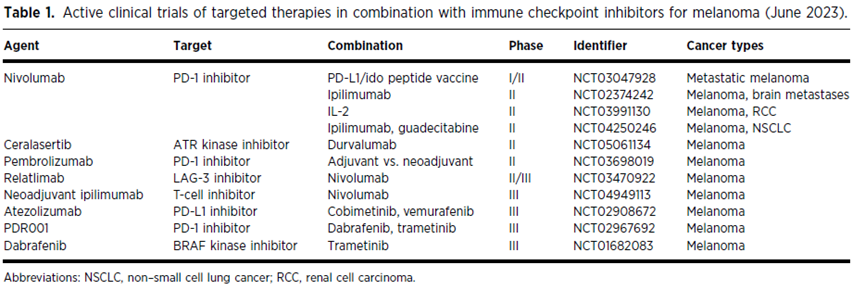
表1. 针对黑色素瘤的靶向疗法与免疫检查点抑制剂联合使用的临床试验
营养对免疫治疗抵抗的影响
目前,人们对营养如何影响癌症的发生和进展的兴趣增加,因为营养对免疫系统具有重大影响。近期研究表明,饮食可以影响癌症免疫治疗的反应。一个典型的例子是地中海饮食,其特点是全谷物、鱼类、坚果、橄榄油、水果和蔬菜含量高。
PRIMM(通过肠道微生物组和代谢组学预测黑色素瘤对免疫治疗的反应)研究评估了地中海饮食与晚期黑色素瘤患者对免疫检查点抑制剂(ICI)治疗反应之间的关联。结果显示,遵循地中海饮食的患者总体反应率更高,无进展生存期更长。这种对治疗反应的积极影响可能归因于饮食中高膳食纤维的摄入。该发现在临床前模型中得到了验证,在低纤维素饮食的小鼠中,抗PD-1治疗的反应减弱。可能是由于低纤维素饮食小鼠的肿瘤微环境(TME)中γ-干扰素分泌和细胞毒性T细胞的频率降低。相反,在ICI治疗期间接受高纤维素饮食的小鼠中,CD4+ T细胞的频率显著更高。
近期证据表明,免疫检查点抑制剂疗效的差异部分与肠道微生物群有关。膳食纤维在肠道中通过细菌作用降解,产生短链脂肪酸(SCFA)。接受ICI治疗的小鼠和患者中,粪便SCFA水平升高者显示出更长的无进展生存期。令人惊讶的是,不是肠道微生物群的整体组成,而是肠道微生物群中特定的细菌,在ICI治疗反应者和无反应者之间存在显著差异。在此背景下,与无反应组相比,纤维发酵细菌瘤胃球菌在ICI治疗反应者中更为丰富。对小鼠数据的网络分析表明,瘤胃球菌通过影响与肿瘤内T细胞积聚和激活相关的途径,有助于抗肿瘤免疫。
此外,短链脂肪酸(SCFAs)具有增强免疫治疗反应的潜力。研究表明,SCFAs有可能增加癌细胞对免疫原性反应的敏感性,进而增强用于抗癌的免疫治疗策略的效果。例如,乙酸已被证明可降低结直肠癌中CD155的表达,可能促进了天然的抗肿瘤防御,因为有研究表明,癌细胞上CD155表达的减少增强了CD8+T细胞对这些细胞的效应反应。此外,在接受抗PD-1抗体治疗的实体瘤患者中,粪便中几种SCFAs(包括乙酸、丙酸、丁酸和戊酸)的高浓度与更长的无进展生存期相关。尽管这些研究表明SCFAs在支持免疫检查点抑制剂(ICI)治疗中起着关键作用,但先前的研究显示,丁酸补充会降低抗CTLA-4抗体在多种小鼠肿瘤模型中的疗效。因此,SCFAs在体内是促进还是抑制抗癌T细胞介导的细胞毒性,其确切作用仍需进一步研究。
总而言之,临床前研究表明,包括纤维素和短链脂肪酸(SCFAs)在内的多种营养素可通过肠道微生物群发挥免疫调节和抗肿瘤作用。但仍需开展全面研究,探讨整体饮食组成与免疫检查点抑制剂(ICI)治疗反应之间的关联。
癌症治疗的代谢脆弱性
癌细胞通过多种代谢适应机制来确保其生存和增殖(图2;表2)。因此,揭示癌症特有适应机制中的代谢脆弱性,为开发创新性的靶向疗法提供了一条令人兴奋的途径。
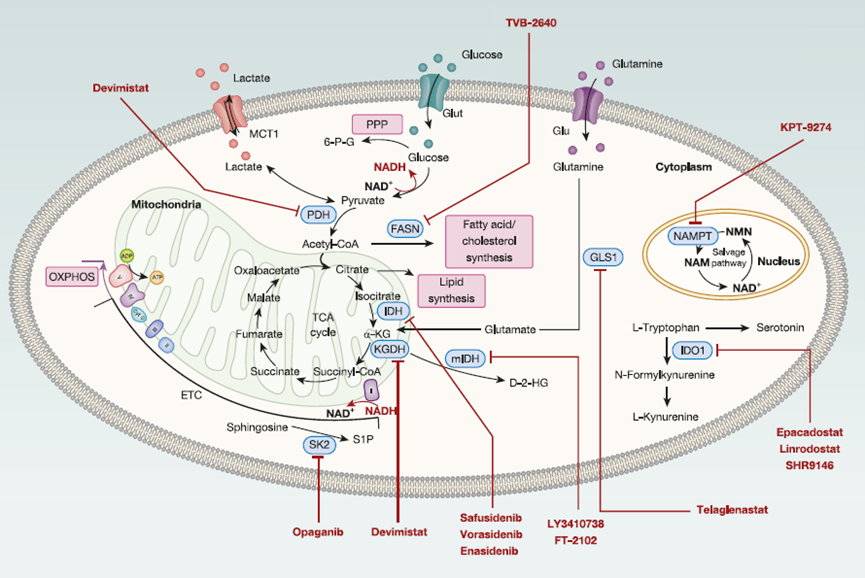
图2. 肿瘤细胞中各种重要代谢途径的图解
乳酸是乳酸脱氢酶在缺氧条件下由丙酮酸产生的一种关键代谢产物,已成为癌症治疗中的一个有吸引力的靶点,其在肿瘤微环境(TME)中的水平显著升高。乳酸会促进免疫抑制环境,增强癌细胞生长并促进免疫逃逸。通过增强CD8+ T细胞的干细胞样特性并增强抗肿瘤免疫来实现这一点。在模拟TME代谢条件的体外模型中,发现肿瘤来源的乳酸抑制了CD8+ T细胞的细胞毒性。此外,乳酸和单羧酸转运蛋白(MCT)1至4被证实有助于肿瘤的侵袭性。在B细胞淋巴瘤小鼠模型和人类细胞系中,MCT 1抑制剂AZD3965通过抑制肿瘤生长和阻止转移,展现出了令人鼓舞的结果。在使用由AZD3965组成的新型纳米药物AZD-UPS NP联合抗PD-1治疗的小鼠模型中,也观察到了类似的结果。尽管在I期、剂量递增和剂量扩展试验中取得了有希望的结果,但另一项涉及晚期癌症患者的临床试验报告称,大多数接受AZD3965治疗的患者出现了致命结局(NCT01791595)。虽然AZD3965通常被认为是安全的,但一项I期剂量递增试验注意到,当剂量超过20mg时,会出现剂量限制性的但可逆的心脏肌钙蛋白升高,这是一种潜在的毒性。因此,需要进一步的研究来全面评估MCT 1抑制剂的临床可行性。
另一种代谢治疗策略聚焦于抑制谷氨酰胺酶,许多不同类型的癌症都依赖谷氨酰胺来生长和抵抗治疗)。体外和体内分析均表明了谷氨酰胺酶抑制剂Telaglenastat(CB-839)对黑色素瘤有潜在抑制作用。Telaglenastat可调节癌细胞中的谷氨酰胺代谢,从而增强T细胞介导的抗肿瘤反应。目前,多项I期和II期临床试验正在评估CB-839与各种化疗或免疫治疗药物联合使用的疗效(见表2)。
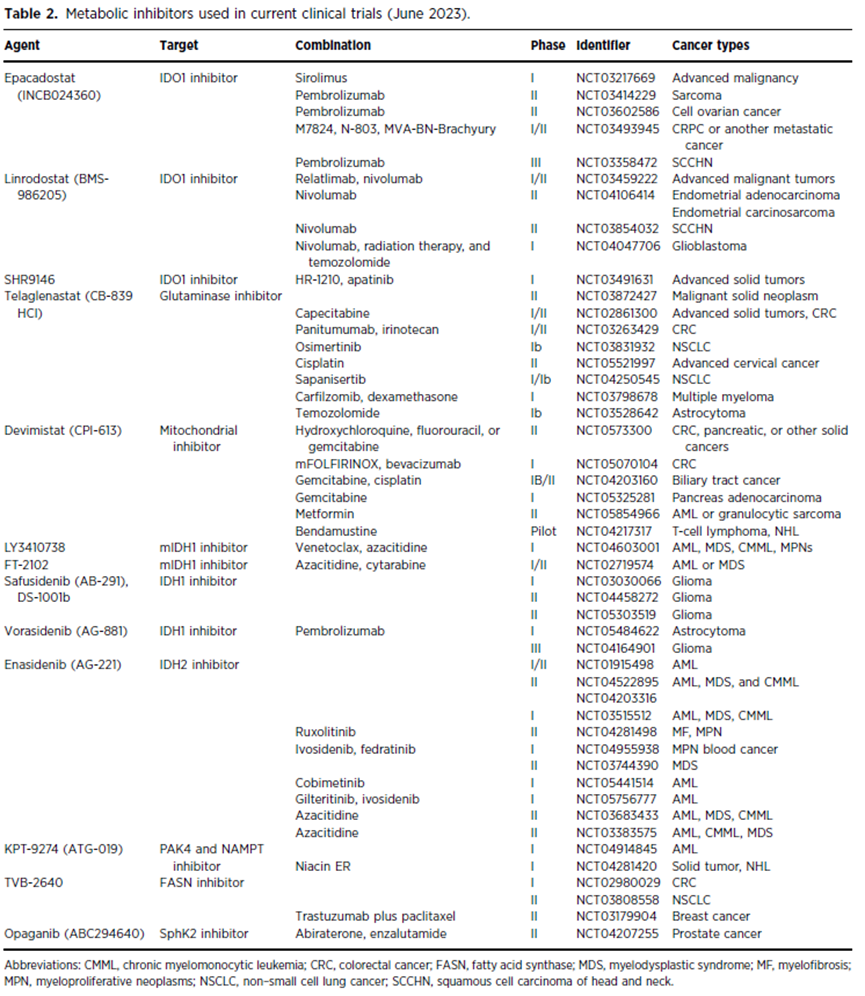
表2. 当前临床试验中使用的代谢抑制剂(2023年06月)
另一个代谢靶点是抑制吲哚胺2,3-双加氧酶1(IDO1),这是色氨酸代谢中的限速酶。TME中IDO1的积累与癌细胞相关,并有助于免疫抑制。它会耗尽TME中的色氨酸,并阻碍T细胞的增殖,最终阻碍抗肿瘤反应。因此,抑制IDO1是恢复抗肿瘤反应的一种有前景的策略。然而,当作为单一药物使用时,IDO抑制剂对已建立的肿瘤影响甚微,但与免疫检查点抑制剂(ICI)联合使用时,它们展现出协同效应,可有效控制癌症生长并改善生存结局。2020年,一项针对IDO1和PD-L1的免疫调节疫苗首次在临床试验(NCT03047928)中与纳武利尤单抗联合使用。在转移性黑色素瘤患者中,接种疫苗的队列显示出80%的强劲反应率,其中43%的患者达到完全响应。这项临床试验以及其他临床前观察最初为治疗各种癌症类型带来了希望,并促进了多种IDO1抑制剂(如epacadostat)的开发。然而,一项大型III期试验(ECHO-301/KEYNOTE-252)显示,epacadostat和帕博利珠单抗的联合使用并未达到预期的疗效。最近的一项研究甚至证明了IDO1抑制的不良影响。因此,仍需进一步的调查研究。
线粒体代谢在维持肿瘤生长和存活中起着至关重要的作用。线粒体氧化磷酸化(OXPHOS)是有氧呼吸过程中产生能量的主要途径。因此,破坏OXPHOS会导致能量和大分子产物耗竭,进而引起细胞周期阻滞和凋亡。在急性髓系白血病(AML)小鼠模型中抑制线粒体复合物I(IACS-010759)的临床前试验显示,肿瘤高度依赖于OXPHOS。事实上,应用IACS-010759可抑制AML小鼠的肿瘤生长。然而,尽管在小鼠体内研究中取得了有希望的结果,但涉及AML患者(NCT02882321)和晚期实体瘤患者(NCT03291938)的临床试验仅显示出有限的治疗效果,原因是剂量限制性毒性和副作用,如神经毒性和乳酸酸中毒。
相比之下,其他研究提供了证据,表明IACS-010759通过抑制OXPHOS复合物I可以降低脑转移癌进展的风险,在肺癌和脑转移的小鼠模型以及人黑色素瘤脑转移样本中均有被观察到。需要指出的是,癌症代谢的代谢可塑性可能会限制OXPHOS抑制剂作为单一疗法的有效性。然而,其在联合疗法中的潜力已在临床前得到了广泛评估。在一项1期试验中,该治疗使对表皮生长因子受体(EGFR)抑制剂产生继发性耐药的患者出现了显著的肿瘤消退和代谢改善。值得注意的是,在一组对EGFR酪氨酸激酶抑制剂产生继发性耐药的患者子群中,OPB-51602治疗降低了代谢活性并减小了肿瘤体积。总体而言,该研究强调了线粒体OXPHOS在驱动癌症靶向药物耐药性中的关键作用。
除了靶向氧化磷酸化(OXPHOS)外,抑制其他线粒体途径,如三羧酸循环(TCA循环),也为阻止肿瘤进展提供了可能性。Devimistat(CPI-613)是一种首创药物,旨在选择性抑制癌细胞中丙酮酸脱氢酶复合物、其调节激酶和α-酮戊二酸脱氢酶复合物的催化功能和调节功能。在一项I期研究(NCT01835041)中,CPI-613联合mFOLFIRINOX治疗胰腺癌患者耐受性良好。
异柠檬酸脱氢酶(IDH)在TCA循环中发挥着关键作用,催化异柠檬酸氧化脱羧生成α-酮戊二酸(α-KG)。IDH突变(mIDH)与癌症相关,并表现出新功能活性,将α-KG转化为D-2-羟基戊二酸(D-2-HG)。目前,有几种针对mIDH(如LY3410738和FT-2102)和IDH1(如safusidenib和verazide)的抑制剂正处于I期和II期研究中。这些研究已报告胶质瘤患者中有初步疗效迹象。在AML方面,已有几种IDH1和IDH2抑制剂获得批准。
此外,正在进行的临床试验积极探索靶向脂肪酸合成(TVB-2640)、鞘氨醇信号通路(opaganib)以及p21活化激酶4(PAK4)/烟酰胺磷酸核糖转移酶(NAMPT)抑制剂(KPT-9274;见表2)的抗癌潜力。总之,关注癌症适应过程中独特的代谢脆弱性是开发创新靶向疗法的一种有前景的方法。因此,需要进一步详细研究操纵癌症代谢的策略,不仅是为了更全面地了解其对宿主细胞的影响,也是为了了解其对肿瘤微环境(TME)的影响。
分子病理流行病学在精准医学研究中的潜力
患者生活的内外部因素,包括环境、饮食、生活方式和微生物群,都可能潜在地影响肿瘤对免疫治疗的反应。因此,具有相似分子病理特征的患者不太可能具有相同的潜在病因,并对药物和其他治疗方式产生相似的反应。在此背景下,为了根据可能影响治疗反应的各种内外部因素来定制癌症治疗方案,识别新型肿瘤生物标志物显得尤为重要。分子病理流行病学这样的新兴研究领域通过强调同一诊断并不一定具有相同的潜在病因或疾病进展这一理念,展现出了巨大的前景。考虑到内外部因素也可能影响肿瘤和非肿瘤细胞的遗传、表观遗传、转录、蛋白质组和代谢组方面,技术的进步正日益使得分析相应的多组学数据成为可能,旨在揭示特定肿瘤生物标志物。这些研究为以精准医学为重点的未来治疗策略提供了依据,并可能进一步弥合肿瘤免疫学与流行病学之间的研究鸿沟。
讨论与小结
总之,虽然代谢抑制剂在癌症治疗中展现出巨大潜力,但重要的是要指出,临床前研究中确定的治疗方法,如IDO1、GLS1和线粒体抑制剂,并不总能成功转化为临床试验的结果。这在一定程度上可归因于临床前模型的局限性,可能无法完全反映实际患者的复杂性。为了更好地理解代谢适应,要在治疗前和治疗后对癌症患者的代谢进行研究。此外,迫切需要改进工具来对患者进行分层。未来应将代谢组学的临床应用付诸实施,以进一步剖析癌症患者的代谢脆弱性。代谢抑制剂已在临床实践中使用了多年,其中一些已成为各种适应症的标准治疗方法。例如,抗叶酸药物用于急性淋巴细胞白血病,IDH抑制剂用于急性髓系白血病(AML)。
然而,针对核苷酸代谢以外代谢途径的新型药物的临床成效相对有限。癌症研究领域才刚刚开始充分利用代谢组学的新可能性和新型代谢物生物标志物的鉴定。这些生物标志物已经可以预测癌症风险、肿瘤侵袭性和治疗反应,为根据患者代谢情况将其分为不同亚组提供了机会。
癌症治疗领域需要鉴定肿瘤微环境(TME)中免疫细胞特有的代谢标志物,以优化患者的个性化治疗方案。我们认为,鉴定与癌症相关的代谢标志物具有进一步优化的巨大潜力。整合代谢标志物和免疫系统代谢相关方法有望发现改善癌症治疗的新途径。


