最全综述:胰腺癌新型靶向治疗的进展
时间:2025-01-31 12:08:55 热度:37.1℃ 作者:网络
胰腺导管腺癌(PDAC)是一种侵袭性极强的恶性肿瘤,治疗选择有限,预后较差。近年来,靶向治疗的进展为PDAC的干预开辟了新途径,重点聚焦于驱动肿瘤进展的关键基因和分子通路。本综述概述了胰腺腺癌新型靶向治疗的进展。
本文探讨了靶向KRAS通路的最新研究进展,KRAS通路一直以来被视为 “不可成药” 的靶点,却对PDAC的发病机制至关重要。抑制KRAS的策略包括直接靶向KRAS的疗法、调节其上下游信号传导、KRAS特异性siRNA,以及将KRAS抑制剂与免疫检查点阻断剂、PARP抑制剂、化疗药物、CDK4/6抑制剂和自噬调节剂相结合的新型联合疗法。除KRAS外,本文还讨论了一些新兴靶点,如NRG1融合、NTRK/ROS1融合、RET变异以及PRMT5/CDKN2A/MAT2A轴,同时还包括EGFR和Claudin18.2抑制剂,这些都被视为有前景的治疗策略。此外,本综述重点介绍了针对高微卫星不稳定性(MSI - H)PDAC的新兴疗法,包括过继细胞疗法(CAR - T、TCR、TIL疗法)、癌症疫苗以及改变肿瘤微环境的策略。
总体而言,靶向治疗的迅速发展为抗击胰腺癌带来了新的希望,胰腺癌一直以来都是预后极差的恶性肿瘤。
研究背景
胰腺腺癌(PDAC)仍是最致命的恶性肿瘤之一,在胰腺癌病例中占大多数,也是导致预后不佳的主要原因。PDAC的5年生存率低于10%,对包括化疗、放疗和免疫疗法在内的传统治疗手段具有显著的耐药性。其侵袭性强,再加上缺乏早期检测方法,这意味着大多数患者确诊时已处于晚期,几乎没有有效的治疗选择。尽管手术技术和全身治疗有所进步,但在过去几十年里,PDAC患者的总体生存率实际上并无变化,这突显出对新型治疗方法的迫切需求。
对PDAC基因和分子层面更深入的了解,让我们明晰了驱动肿瘤生长与存活的关键突变,其中最显著的是KRAS基因,超过90%的PDAC病例中该基因都发生了突变。这使得KRAS成为药物研发的重点,因为致癌性KRAS信号在肿瘤增殖、逃避凋亡以及产生治疗耐药性方面发挥着关键作用。早期直接靶向KRAS的尝试颇具挑战性,原因在于该蛋白具有“不可成药”的结构。然而,小分子抑制剂领域近期取得的突破为治疗带来了希望。除了靶向KRAS,PDAC的治疗手段也在不断拓展,纳入了其他新靶点以及旨在克服耐药机制的联合治疗策略。例如,在临床前模型中,将KRAS抑制剂与其他通路抑制剂(如靶向PI3K/AKT/mTOR或MAPK通路的抑制剂)或传统化疗药物联合使用,已展现出良好前景(图1)。此外,基于免疫的疗法,尤其是与靶向疗法联合使用,有望增强针对PDAC的免疫反应,这一领域正受到越来越多的关注。PDAC以其抑制性肿瘤微环境(TME)而闻名,其特征为致密的基质屏障、免疫抑制细胞的浸润以及效应T细胞的渗透受限。
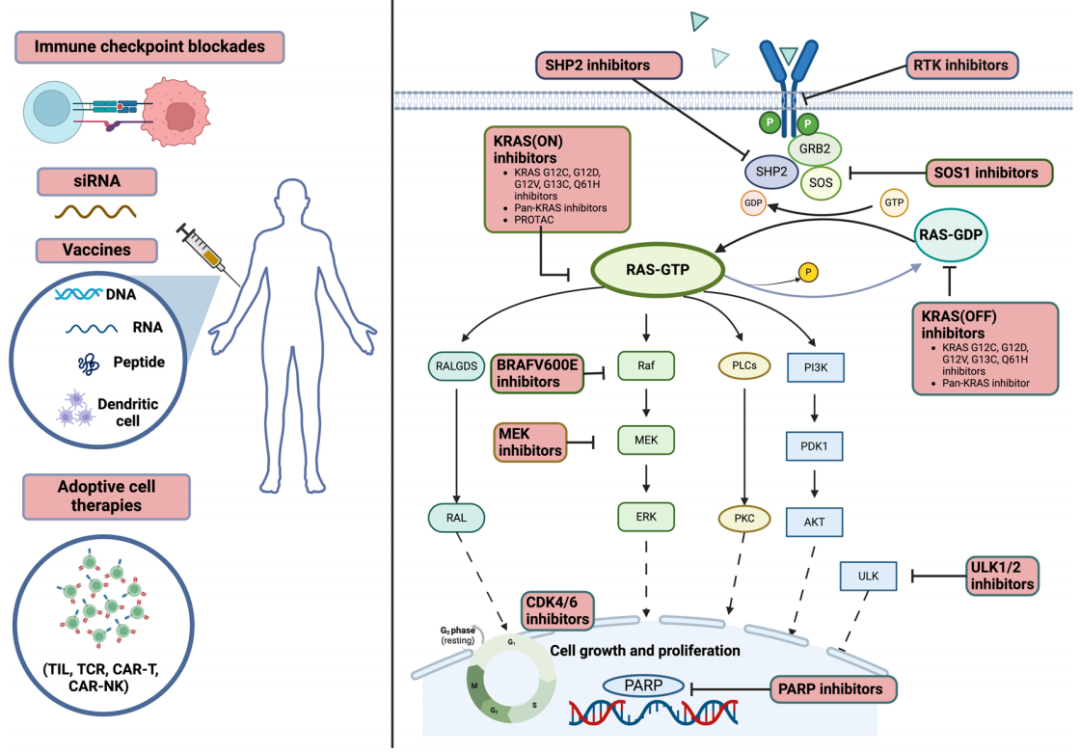

图1
本综述将概述PDAC靶向治疗的最新进展,重点聚焦KRAS抑制剂及其与其他治疗方式的联合应用。研究者将审视支持这些新方法的临床前及临床证据,并探索如何将这些疗法融入临床实践的未来方向,以改善PDAC患者的治疗效果。
靶向“不可用药”:靶向KRAS通路疗法
高达90%的PDAC病例都涉及KRAS癌基因的突变,该基因作为关键的信号枢纽,调控着细胞生长、增殖、代谢和迁移等重要过程(图1)。突变的KRAS通过抑制GTP酶,使KRAS维持在与GTP结合的激活状态,从而引发早期胰腺肿瘤形成。PDAC中典型的KRAS突变类型包括G12D(36 - 44%)、G12V(34 - 36%)、G12R(14 - 20%)以及Q61H(4%),而KRAS G12C突变仅见于1 - 3% 的病例中。靶向KRAS通路的治疗策略,既聚焦于对KRAS的直接抑制,也关注其上下游靶点,同时还在探索包括免疫疗法在内的联合治疗方案。
直接靶向KRAS疗法:
KRAS G12C小分子抑制剂:
2013年,Ostrem等人在II型开关区域和半胱氨酸附近发现了一种变构抑制剂,可使KRAS G12C保持在与GDP结合的非活性状态。这促使人们发现了几种KRAS G12C抑制剂,包括索托雷塞(AMG - 510)和阿达格拉西布(MRTX849)。这些KRAS G12C抑制剂在胰腺癌中显示出一定活性的同时,在非小细胞肺癌(NSCLC)患者中表现出了更好的缓解率和疗效持续时间。在索托雷塞的1/2期CodeBreak 100试验中,8名胰腺癌患者中有6名病情稳定,其中3名患者在中位随访4.3个月时肿瘤缩小30%。一项针对38名经治的胰腺癌患者(中位治疗线数为2)每日接受960mg索托雷塞的更新研究报告称,客观缓解率(ORR)为21%,疾病控制率为84.2%,中位无进展生存期(PFS)为4.0个月,中位总生存期(OS)为6.9个月。KRYSTAL - 1试验对10名经治的胰腺癌患者使用了阿达格拉西布进行研究,其中5名患者达到部分缓解,无进展生存期为6.6个月。一份更新报告显示,21名胰腺癌患者中有7名(33.3%)达到部分缓解。目前,人们正在努力开发新一代的KRAS G12C抑制剂。Divarasib(GDC - 6036)作为一种新型KRAS G12C抑制剂,与索托雷塞和阿达格拉西布相比,在效力和选择性方面有显著提升。在一项针对137名携带KRAS G12C突变的实体瘤患者的1期试验中,NSCLC患者的ORR为53%,结直肠癌患者为29.1%。试验中的7名胰腺癌患者中有3名(43%)出现客观缓解,7名中有4名(57%)病情稳定。Olomorasib(LY3537982)在针对KRAS G12C突变的晚期实体瘤的1a/1b期LOXO - RAS - 20001试验(NCT04956640)中进行了研究,在24名胰腺癌患者中显示出了有希望的结果,ORR为46%,中位PFS为6.4个月。同样,glecirasib(JAB - 21822)在汇总的1/2期试验(NCT05009329、NCT05002270)中表现出了类似的活性,28名胰腺癌患者的ORR为46.4%,中位PFS为4.1个月。目前,正在涌现具有各种作用机制的下一代KRAS G12C抑制剂(表1和表2)。

表1
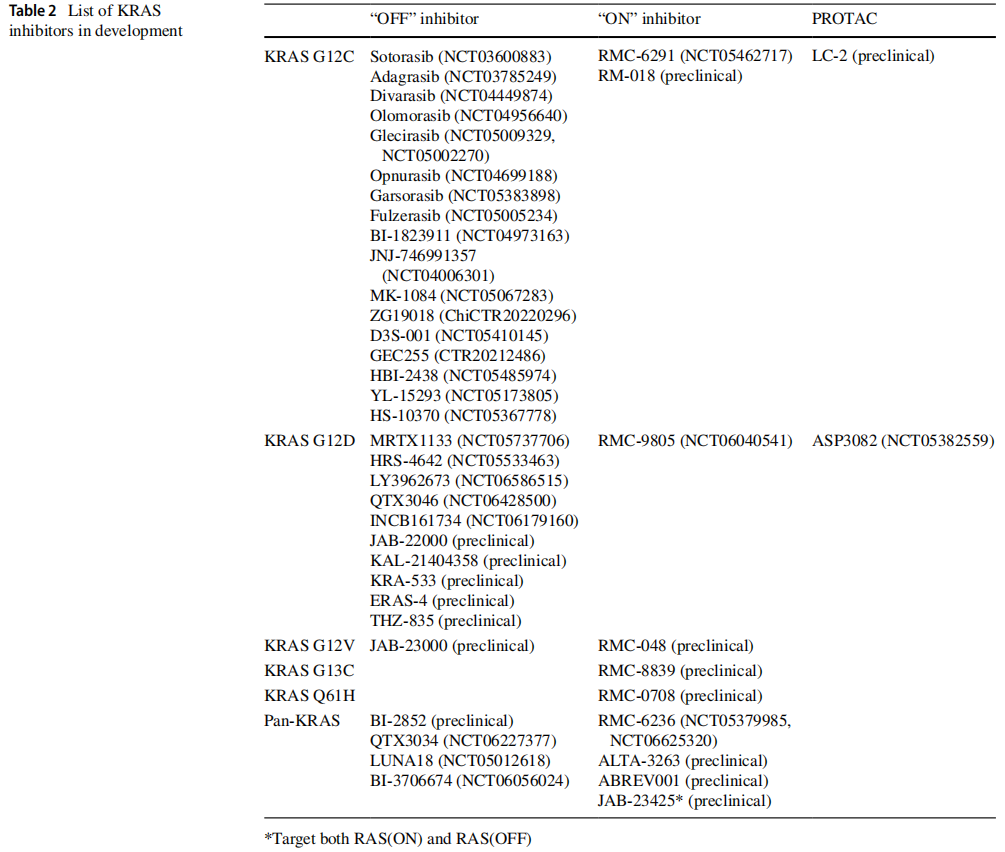
表2
KRAS非G12C小分子抑制剂:
由于大多数非G12C型KRAS变异缺乏可实现蛋白质共价修饰的Cys12残基,且其处于与GTP结合的活性形式,因此设计针对非G12C型KRAS突变的抑制剂颇具难度。通过优化与Asp12残基的选择性结合设计了MRTX1133,它能以比野生型KRAS高700倍的亲和力抑制处于GDP结合形式的KRAS G12D。使用MRTX1133的小鼠动物模型显示出有前景的结果,在KRAS G12D突变的异种移植小鼠肿瘤模型中展现出高抗肿瘤活性。目前,该药物正在针对实体瘤进行1期试验(NCT05737706)。另一种KRAS G12D抑制剂是HRS - 4642,目前正在针对晚期KRAS G12D突变实体瘤患者进行1期试验(NCT05533463)。
KRAS抑制剂的新型设计:
尽管众多针对与GDP结合的非活性形式的新型KRAS抑制剂不断涌现,但同时也在开发一些新型方法。其中包括靶向KRAS与GTP结合的活性状态的三聚体复合物抑制剂,以及靶向KRAS蛋白降解剂的设计。
三聚体复合物抑制剂的作用机制是将靶分子与内源性细胞质蛋白结合,形成一种空间位阻复合物,从而阻止下游信号传导。一种名为RMC - 6291的抑制剂,能与处于活性(ON)状态的KRAS G12C共价结合,同时与分子伴侣亲环蛋白A相互作用,形成一种无活性的三聚体复合物。这种机制比针对非活性(OFF)状态的抑制剂更有效地抑制RAS通路。早期试验数据表明,RMC - 6291对先前用其他KRAS G12C抑制剂治疗过的NSCLC具有活性。
此外,泛RAS抑制剂也已开发出来,包括Revolution Medicine的RAS(ON)多选择性抑制剂RMC-6236。该药剂与之前的KRAS G12C(ON)抑制剂类似,能在与GTP结合的RAS和亲环蛋白A之间形成三聚体复合物。在一项正在进行的1期试验(NCT05379985)中,接受RMC - 6236治疗的RAS突变型胰腺癌患者,在二线治疗中的PFS为7.6个月(95%CI,5.3 - 无法评估),而在三线或更晚治疗阶段接受治疗的患者,中位PFS达到4.2个月(95%CI,4.1 - 6.4)。目前,3期RASolute 302研究(NCT06625320)正在进行中,该研究旨在比较RMC - 6236与化疗药物在二线转移性PDAC治疗中的效果。
另一种创新方法是通过促进突变型KRAS等位基因的降解,来靶向治疗携带KRAS突变的PDAC。蛋白质降解剂,如蛋白酶靶向嵌合体(PROTACs)和类似沙利度胺的药物,可促使靶蛋白与E3泛素连接酶结合,进而引发蛋白酶体介导的蛋白质降解过程。ASP3082是一种靶向KRAS G12D的PROTAC,目前正在1期临床试验(NCT05382559)中进行评估,该试验将其作为单药疗法,或与西妥昔单抗联合,用于治疗携带KRAS G12D突变的实体瘤。
靶向上游KRAS通路疗法:
SOS1抑制剂:
一种靶向所有突变型KRAS等位基因的方法是抑制支持KRAS功能的上游效应因子,如GFE SOS1和SHP2。SOS1通过将非活性的与GDP结合的KRAS转化为活性的与GTP结合的KRAS,从而促进KRAS的激活。小分子抑制剂BI - 3406通过破坏SOS1 - KRAS的相互作用来阻断这一过程,与MEK抑制剂联用时可抑制细胞增殖。基于BI - 3406的研发,产生了BI - 1701963,目前该药物正在针对KRAS突变的实体瘤进行临床试验。1期试验的初步数据显示,31名患者中有7名耐受性良好且病情稳定。其他有前景的SOS1抑制剂包括BAY - 293、RM - 0331、RMC - 5845和MRTX0902。
SHP2抑制剂:
SHP2由PTPN11编码,是一种参与关键信号通路的磷酸酶(图1)。目前,有许多SHP2抑制剂正处于临床及临床前研究阶段。RMC - 4630是一种三元复合物SHP2抑制剂,在少数携带KRAS G12C突变的NSCLC患者中展现出活性。CodeBreak101研究还评估了RMC - 4630与索托雷塞联合用于KRAS G12C突变的晚期实体瘤的疗效。Batoprotafb(TNO155)与opunurasib联合使用时,在携带KRAS G12C突变的NSCLC患者中,ORR达到33%。这种药物组合在其他携带KRAS G12C突变的实体瘤中也显示出活性。另一种SHP2抑制剂JAB - 3312,正在一项1/2a期试验中,与glecirasib联合用于治疗KRAS G12C突变的实体癌。在28名未接受过KRAS G12C抑制剂治疗的可评估NSCLC患者中,ORR为50%(14/28),疾病控制率(DCR)为100%。在最新分析中,NSCLC患者的ORR为72.5%,DCR为96.3%。
RTK抑制剂:
通过负反馈回路的ERK再激活上调KRAS抑制后的EGFR,促使研究将EGFR抗体与KRAS抑制剂联合使用。在CodeBreak 101的1b期试验中,索托雷塞与帕尼单抗(panitumumab)联合使用,ORR达到30%,中位PFS为5.7个月,中位OS为15.2个月。另一项针对KRAS G12C阳性CRC患者的1b期试验中,divarasib与西妥昔单抗(cetuximab)联用,报告的ORR为62.5%,且安全性良好。在临床前研究中,MRTX1133与RTK抑制剂联合用于KRAS G12D突变的PDAC,取得了有前景的结果。此外,在KROCUS研究中,fulzerasib与西妥昔单抗联合用于未经治疗的KRAS G12C突变的NSCLC患者,ORR达到82%。
靶向下游KRAS通路疗法:
RAS - RAF - MEK - ERK通路是RAS下游的关键信号网络,在PDAC中发挥着重要作用。2% - 3% 的病例中存在BRAF突变,尤其是BRAF V600E突变。正在进行的研究,如康奈非尼(encorafenib)和比美替尼(binimetinib)的2期试验(NCT04390243),正在探索靶向BRAF V600E突变型PDAC中MAPK的疗效。ROAR和NCI - MATCH篮子试验的结果,促使达拉非尼(dabrafenib)和曲美替尼(trametinib)联合用药获批用于BRAF V600E阳性实体瘤。在CodeBreak 101试验中,评估曲美替尼和索托雷塞用于KRAS G12C突变实体瘤的疗效时发现,总体缓解率为11%,中位PFS为7个月,疗效有限。
KRAS siRNA:
小干扰RNA(siRNA)通过靶向特定的mRNA来沉默基因表达,但由于其在体内易快速降解,且PDAC的肿瘤基质致密,将其递送至组织,尤其是PDAC组织,颇具挑战性。在一项1/2期试验中,研究人员在晚期PDAC患者中评估了采用可生物降解植入物(LODER)递送靶向KRAS G12D的siRNA并联合化疗的治疗效果。在12名可评估的患者中,2名有治疗反应,10名病情稳定,中位OS为15.1个月。外泌体是一种纳米级囊泡,递送效率更高且半衰期更长,为siRNA的递送提供了另一种选择。在临床前模型中,携带靶向KRAS G12D的siRNA的工程化外泌体可抑制PDAC的生长。
新型联合疗法
免疫检查点阻断剂(ICBs):
已知RAS突变的肿瘤细胞会营造一种免疫抑制性的肿瘤微环境(TME),而在RAS受到抑制后,这些肿瘤细胞对免疫疗法的敏感性会有所增加。过往试验数据表明,与KRAS野生型肿瘤患者相比,KRAS突变型肿瘤患者对帕博利珠单抗和纳武利尤单抗的反应更佳,这为RAS抑制剂与ICBs联合使用提供了理论依据。在PCK - HY1936 PDAC小鼠模型中,与单独使用MRTX1133相比,MRTX1133与抗CTLA4或抗PD1抗体联合使用可延长小鼠生存期。同样,KRAS(ON)G12D抑制剂RMC - 9805与抗PD1抗体联合使用也显示出显著疗效。尽管临床前数据显示KRAS G12D抑制剂与ICB在PDAC中的潜力,但由于低肿瘤突变负担和免疫抑制TME,这种癌症类型通常对ICB反应较差。此外,在KRAS抑制剂与ICBs联合使用时,控制毒性仍是一大挑战,尤其是肝毒性。
PARP抑制剂:
PARP抑制剂是同源重组修复缺陷(HRD)患者,尤其是携带BRCA相关癌症患者的有效治疗选择。孙等人在动物研究中表明,将MEK抑制剂与PARP抑制剂联用,对RAS突变型癌症的治疗效果更佳,且该效果与BRCA1/2和p53的突变状态无关。他们发现,RAS/MAPK通路会降低FOXO3a蛋白水平,从而导致对PARP抑制剂产生耐药性。然而,MEK抑制剂能够提高FOXO3a水平,增强癌细胞对PARP抑制剂的敏感性。这表明,在携带KRAS G12C突变的肿瘤中,阻断KRAS可能会提高PARP抑制剂的疗效。一项1期临床试验已经在验证这一设想,该试验将PARP抑制剂奥拉帕利与KRAS抑制剂阿达格拉西布联合,用于治疗晚期实体瘤(NCT06130254)。
联合化疗:
近期针对小鼠的临床前研究显示,将传统化疗与新型KRAS抑制剂MRTX1133联用,或许能显著提高胰腺癌的治疗效果。这些研究结果表明,化疗药物与KRAS抑制剂作用于驱动肿瘤生长的不同分子通路,联合使用时会产生协同效应。鉴于超过90%的胰腺肿瘤都携带KRAS突变,KRAS抑制剂在早期临床试验中已初显成效。然而,使用KRAS抑制剂进行单一疗法时,由于肿瘤细胞状态变化导致的耐药性问题,其疗效受到了限制。肿瘤细胞可转变为对KRAS信号依赖程度较低的“经典”细胞状态,这种转变一方面导致了耐药性,另一方面却使肿瘤细胞对化疗更为敏感。因此,化疗与KRAS抑制联合使用,可能为克服耐药性和改善治疗效果提供一种双重途径。目前正在进行的研究旨在优化这些疗法的用药顺序和剂量,不久后也将开展临床试验,在人体上测试这些新型治疗策略。
CDK4/6抑制剂:
CDK4/6是细胞生长和增殖过程中的细胞周期调节激酶。CDK4/6的激活被认为参与了KRAS G12C抑制剂的耐药,特别是参与了CDKN2A的突变缺失和PI3K-AKT-mTOR通路的激活。CDK4/6抑制剂有望通过化学方式恢复细胞周期抑制蛋白p16的抑制功能,从而对PDAC产生疗效。临床前研究表明,KRAS G12C抑制剂与CDK4/6抑制剂联合使用具有抗肿瘤活性,目前有多项临床试验正在探索这一联合治疗方案(NCT05178888、NCT04185883、NCT04956640、NCT05358249)。新出现的证据也支持将CDK4/6抑制剂与MAPK通路抑制剂联合使用的潜力,比如MEK抑制剂曲美替尼与CDK4/6抑制剂哌柏西利的联合。同样,在PDAC类器官中,CDK4/6抑制剂与ERK抑制剂联合使用可诱导细胞凋亡。目前,针对CDK与MEK抑制剂联合使用(NCT05554367)以及CDK与ERK抑制剂联合使用(NCT03454035)的临床试验正在进行中。
靶向自噬:
自噬是一个帮助细胞在分解和循环利用细胞成分的过程中存活的机制,尤其在营养有限的条件下更是如此。在癌细胞中,自噬通过为细胞增殖提供营养物质来支持肿瘤生长。ULK1/2是一种关键激酶,它通过各种磷酸化事件来调节自噬,并且与mTORC1和AMPK信号通路密切相互作用。研究表明,KRAS G12C抑制剂能够提高KRAS G12C突变的NSCLC中ULK1的活性,并增强自噬作用。因此,研究发现将ULK1/2抑制剂与KRAS G12C抑制剂联合使用,能够更好地控制肿瘤。目前,一项针对KRAS G12C突变的NSCLC的研究,正在评估ULK1/2抑制剂DCC - 3116与索托雷塞联合使用的效果(NCT04892017)。
PDAC中的其他新兴靶点
约8% - 10%的PDAC不存在KRAS突变。在临床上,这类患者预后相对较好,且常伴有一些具有潜在靶向治疗价值的致癌突变,包括EGFR、BRAF、NRG1重排、NTRK,以及其他罕见的融合和ALK重排。
NRG1融合:
NRGs是一类细胞生长因子家族。在PDAC中,NRG1融合突变较为罕见,在未经筛选的患者中发生率为0.6% - 1.3%,但在KRAS野生型的PDAC患者中,这一比例高达17%。NRG1融合会刺激HER2/HER3二聚化,进而通过激活下游的MAPK和PI3K信号通路来促进肿瘤增殖。一项1/2期eNRGy试验(NCT02912949)评估了泽妥珠单抗(zenocutuzumab)——一种双特异性抗HER2/HER3单克隆抗体,用于治疗携带NRG1融合的实体瘤。结果显示,在27名PDAC患者中,ORR为44%,其中CR 1例,PR 11例。大多数患者(81%)的靶病灶缩小,84%的患者CA19 - 9水平下降超过50%。中位DoR为9.1个月,33%的患者缓解仍在持续。2023年6月,泽妥珠单抗用于治疗携带NRG1融合的PDAC,获得美国FDA的突破性疗法认定。瑟瑞妥单抗(Seribantumab)是一种选择性NRG1融合抑制剂,在一项2期CRESTONE试验中,55名携带NRG1融合阳性的局部晚期或转移性实体癌患者使用该药后显示出疗效。这些患者大多患有肺癌,总缓解率(RR)为30%,DCR为90%。
NTRK/ROS1融合:
NTRK是一类跨膜酪氨酸激酶,在神经元发育过程中起着关键作用。已知有三种NTRK融合类型,分别为NTRK1、NTRK2和NTRK3,它们各自编码蛋白TRKA、TRKB和TRKC。NTRK融合在胰腺癌中较为罕见(发生率为0.3% - 0.8%)。目前已研发出多种NTRK抑制剂。拉罗替尼(Larotrectinib)是首款泛TRK抑制剂,它能选择性地靶向TRK蛋白。在三项1/2期单臂试验中,共纳入55名携带NTRK融合阳性实体瘤的患者,结果显示其RR达75%。一项汇总分析表明,拉罗替尼在多种肿瘤类型中均显示出活性,其中包括14名胃肠道癌患者(含PDAC患者),缓解率为43%。恩曲替尼(Entrectinib)是另一款第一代NTRK抑制剂,它是一种口服TKI,可靶向TRKA、TRKB、TRKC、ROS1和ALK基因。三项1/2期试验对121名接受恩曲替尼治疗的NTRK融合阳性实体瘤患者进行汇总分析,结果显示ORR为61.2%,DoR为20.0个月,中位PFS为13.8个月。其中有4名晚期PDAC患者,ORR为75%,中位DoR为12.9个月,中位PFS为12.8个月,中位OS为22.0个月。TRIDENT - 1研究(NCT03093116)评估了下一代ROS1和NTRK抑制剂瑞波替尼(Repotrectinib),该研究纳入了88名携带NTRK融合的晚期实体瘤患者。既往未接受过NTRK抑制剂治疗的患者,ORR为58%,而此前接受过NTRK抑制剂治疗的患者,ORR为50%。2024年6月,美国FDA加速批准瑞波替尼用于治疗无其他治疗选择的成人及12岁以上携带晚期NTRK融合阳性肿瘤的儿童患者。在1/2期TRIDENT - 1试验中,瑞波替尼在ROS1融合阳性的NSCLC中显示出显著疗效(ORR为79%,中位PFS为35.7个月),在未接受过ROS1 TKI治疗的患者中,颅内活性也很强(颅内ORR为89%)。基于这些结果,FDA于2023年批准瑞波替尼用于治疗局部晚期或转移性ROS1阳性NSCLC。
RET融合/变异:
RET融合和突变虽然罕见,但在一小部分PDAC病例中存在,尤其是在KRAS野生型(WT)肿瘤中。1/2期LIBRETTO - 001试验探究了RET抑制剂塞普替尼(selpercatinib)对各种RET融合阳性癌症的疗效,其中包括12名转移性PDAC患者,ORR为54.5%。同样,ARROW试验评估了另一种RET抑制剂普拉替尼(pralsetinib)在KRAS野生型PDAC患者中的疗效。4名PDAC患者均出现缓解反应,其中一名患者达到完全缓解,且持续时间超过33个月。目前正在进行的临床试验正在研究下一代RET抑制剂用于RET融合阳性实体瘤的情况(NCT05443126、NCT05265091、NCT05265091)。
PRMT5/CDK2NA/MAT2A轴:
9p21.3染色体位点包含肿瘤抑制基因CKDN2A和甲硫氨酸补救基因MTAP的基因组位置。约15% 的癌症存在9p21.3位点的纯合缺失,这会导致甲基硫代腺苷(MTA)积累,抑制蛋白质精氨酸甲基转移酶5(PRMT5),进而影响RNA剪接、基因表达和DNA修复,最终导致细胞周期停滞、衰老和细胞死亡。在一项1期试验中,PRMT5抑制剂AMG193在167名患者(其中28.7%为PDAC患者)中显示出良好的安全性。在NSCLC患者中的缓解率为18.2%,PDAC患者中为12.5%,胆管癌患者中为18.2%。该研究证明了MTAP缺失可作为一种合成致死策略加以利用。目前,AMG193正在开展联合治疗的研究,在NSCLC中与化疗免疫疗法联用(NCT06333951),在胰腺癌中与化疗联用(NCT06360354),同时也在研究与MAT2A抑制剂IDE397联用(NCT05975073)。
EGFR抑制剂:
EGFR在PDAC中通常呈过表达状态。厄洛替尼(Erlotinib)是一种EGFR抑制剂,一项3期试验显示,它与吉西他滨联用时,可使患者的中位OS有适度改善(6.24个月 vs. 5.91个月,HR为0.82,p = 0.038),随后该药获得美国FDA批准。近期一项随机、安慰剂对照试验评估了抗EGFR抗体尼妥珠单抗(Nimotuzumab)与吉西他滨联用治疗KRAS野生型PDAC的效果,结果显示中位OS更长(10.9个月 vs. 8.5个月),中位PFS也更长(4.2个月 vs. 3.6个月,p = 0.04),这表明在KRAS野生型PDAC中靶向EGFR可能具有潜在益处。
Claudin18.2抑制剂:
Claudin 18.2(CLDN18.2)是一种紧密连接蛋白,在生理状态下于胃黏膜表达,但也在不同来源的腺癌中被发现,如胃癌、食管癌、胰腺癌和卵巢癌。多项研究报道了CLDN18.2在原发性胰腺癌及其转移灶中的表达情况。目前,一项关于佐妥昔单抗(Zolbetuximab)的扩大2期研究正在进行中,佐妥昔单抗是首款针对CLDN18.2的IgG单克隆抗体,该研究将其与吉西他滨/白蛋白结合型紫杉醇联合,用于一线治疗CLDN18.2阳性的晚期PDAC(NCT03816138)。其他针对CLDN18.2的临床试验也在进行中,包括使用抗体 - 药物偶联物(ADC)的试验(NCT05458219)、双特异性抗体的试验(NCT05482893)以及CAR - T疗法的试验(NCT04404595、NCT05620732、NCT05472857、NCT05539430)。
MSI-H疗法
1% - 2%的PDAC存在错配修复缺陷(dMMR)。这些基因的功能缺失会导致复制错误和高微卫星不稳定性(MSI - H)。最近,免疫检查点抑制剂(ICIs)已证明对MSI - H或dMMR肿瘤有效,因此ICIs获得了该适应症的跨组织学批准。帕博利珠单抗在晚期MSI - H/dMMR胃肠道恶性肿瘤中的RR为53%(CR为21%)。关于ICIs在MSI - H/dMMR PDAC中的疗效,相关文献报道并不一致。在2期KEYNOTE - 158试验中,帕博利珠单抗在22例PDAC患者中疗效有限,ORR为18%,中位PFS和OS分别为2.1个月和3.7个月,远低于其他MSI - H/dMMR癌症患者。然而,一项来自16个欧洲中心的回顾性研究报告称,晚期MSI - H/dMMR PDAC患者使用ICIs后结局更好,ORR为48%,中位PFS为26.7个月。这些差异表明相关数据有限,并提示可能存在潜在机制影响PDAC对ICIs的反应。其他标志物,如肿瘤突变负荷(TMB),也被用于探索预测ICIs疗效。大规模基因组筛选已确定Werner综合征RecQ解旋酶(WRN)是MSI癌症中的一个合成致死靶点。最近,开发出了一种强效WRN抑制剂HRO761,它能将WRN锁定在非活性状态,导致DNA损伤,并选择性地抑制MSI细胞中的肿瘤生长。HRO761目前正在进行临床试验(NCT05838768),以评估其在MSI结直肠癌及其他实体瘤患者中的安全性、耐受性和抗肿瘤效果。针对其他用于MSI/dMMR实体瘤的WRN抑制剂的临床试验也在进行中(BP44474,NCT06004245)。
新兴的新型方法
过继细胞疗法:
过继细胞疗法已被证实是治疗血液系统恶性肿瘤的有效手段。尽管尚处于发展早期,但过继细胞疗法有望改善实体瘤(尤其是PDAC)的治疗反应。
肿瘤浸润淋巴细胞(TIL)疗法:
肿瘤浸润淋巴细胞(TILs)是由浸润在TME中的单核细胞组成,在识别和杀伤癌细胞方面发挥着重要作用。TIL疗法通常包括利用白细胞介素(IL)-2对从肿瘤样本中提取的TIL进行体外扩增。经过扩增的TIL在进行预处理性非清髓性淋巴细胞耗竭化疗后,再回输到患者体内。TIL疗法具有多种优势,包括可靶向多种肿瘤抗原的多样化T细胞克隆性、强大的肿瘤归巢能力以及极低的脱靶毒性。Hall等人报告了从胰腺肿瘤相关抗原中获得TIL扩增的可行性。目前有两项临床试验正在进行中,以评估TIL疗法在转移性PDAC患者中的疗效(NCT03935893和NCT01174121)。
工程化TCR T细胞疗法:
工程化TCR T细胞是对天然存在的T细胞进行体外改造后的细胞,使其表达能够识别肿瘤相关抗原的TCRs。2022年,Leidner等人报告了一项病例研究,该研究采用基因工程技术,让自体T细胞克隆性地表达两种针对肿瘤所表达的突变型KRAS G12D的同种异体HLA - C*08:02限制性T细胞受体(TCRs),结果显示内脏转移瘤显著消退。目前,有多项1/2期试验正在评估针对PDAC TME调节的TCR疗法,其靶点分别为KRAS G12V(NCT04146298、NCT03190941)、KRAS G12D(NCT03745326)、TP53(NCT05877599)以及间皮素(NCT04809766)。
嵌合抗原受体(CAR)T细胞疗法:
嵌合抗原受体(CARs)是一种合成受体,可使免疫细胞(如T淋巴细胞)靶向肿瘤抗原。CAR - T细胞疗法包括从患者血液中分离T细胞,对其进行改造以表达CARs,扩增其数量,然后将它们重新输回患者体内。这些经过改造的T细胞能够通过抗原结合域识别肿瘤抗原,且不依赖于主要MHC分子,从而提高了它们靶向癌细胞的能力。虽然许多CAR - T细胞疗法已在临床上用于治疗血液系统恶性肿瘤,但在实体瘤治疗领域该疗法仍相对滞后。一项针对CD133(一种在PDAC中高表达的癌症干细胞标志物)的CAR - T细胞1期试验显示,7名患者中有3名SD,2名PR,2名PD。目前,针对PDAC有多项正在进行的CAR - T细胞疗法试验,其靶抗原包括KRAS、ROR2(NCT03960060)、HER2(NCT04511871)、CD22(NCT04556669)、CD70(NCT02830724)、CEA(NCT02850536)、Claudin18.2(NCT04404595、NCT04581473)、EpCAM(NCT03013712)、EpCAM/TM4SF1(NCT04151186)以及MSLN(NCT03323944)。
CAR - NK细胞疗法:
CAR - NK细胞疗法是一种很有前景的癌症治疗方法,它能增强NK细胞靶向和杀死癌细胞的能力。与CAR - T细胞疗法相比,CAR - NK细胞疗法毒性更低,但它也面临着诸如细胞寿命短、抗原异质性以及NK细胞向肿瘤浸润等挑战。Lee等人对FRα CAR - NK细胞进行重编程,以诱导FRα和DR4/5阳性肿瘤发生选择性凋亡,显著增强了肿瘤特异性细胞死亡。同样,已开发的抗间皮素CAR - NK细胞以及前列腺干细胞抗原(PSCA)- CAR NK细胞在PDAC治疗中也展现出了抗肿瘤活性。
疫 苗
全肿瘤细胞疫苗:
在一项2期试验中,含CD4+辅助性T细胞和CTL表位的全肿瘤细胞疫苗algenpantucel-L与吉西他滨和5-氟尿嘧啶联合应用时,显示辅助治疗的PDAC患者的3年生存率为42%。GVAX是一种由全肿瘤细胞组成的癌症疫苗,经过修饰后可分泌人粒细胞-巨噬细胞集落刺激因子(GMCSF),之前人们曾发明它来促进PDAC患者的T细胞对一系列肿瘤相关抗原的反应。目前有研究将GVAX联合纳武利尤单抗和乌瑞芦单抗(urelumab,抗CD137激动剂)用于可切除的PDAC患者(NCT02451982)。
树突状细胞(DC)疫苗:
树突状细胞(DC)疫苗取自患者血液,加载肿瘤抗原后,被注入体内以增强淋巴结中的免疫反应。一项1b期试验正在评估一种加载了个性化肽(PEP)的自体DC疫苗,该疫苗与标准辅助化疗及纳武利尤单抗联合用于PDAC患者(NCT04627246)。另一项单臂开放标签试验正在评估成熟DC(mDC3/8)辅助疫苗(初次接种及加强接种)用于已切除PDAC辅助治疗时的安全性和耐受性(NCT03592888)。
肽疫苗:
肽疫苗由合成的免疫原性肽设计而成,这些肽能够激发特异性免疫反应。在2期试验中,GV1001肽疫苗(一种针对人类端粒酶逆转录酶催化亚基(hTERT)的II类16聚体肽疫苗)提高了PDAC免疫应答者的生存率(免疫应答者的中位生存期为216天,而非免疫应答者为88天) 。遗憾的是,后续的3期临床试验表明,对于晚期PDAC患者,在卡培他滨和吉西他滨治疗方案中加入GV1001,并未带来OS方面的获益 。新兴的针对KRAS突变的肽疫苗,如ELI - 002 2P,正在研究中,早期试验结果令人期待(NCT05726864)。
DNA和RNA疫苗:
核酸疫苗以其研发过程简便快捷而闻名,在癌症治疗以及像新冠病毒(SARS-CoV-2)这类病毒感染的临床试验中展现出良好前景。这些疫苗能够轻松进行改造,以针对特定病原体,通过主要MHC I类和II类分子参与抗原呈递,从而诱导细胞免疫和体液免疫反应。DNA疫苗和RNA疫苗利用宿主的蛋白质合成机制来产生肿瘤相关抗原(TAAs)。有研究表明,这能延长患有PDAC的小鼠的存活期。一种针对α - 烯醇化酶(ENO1)的DNA疫苗,ENO1是一种在胰腺癌中上调表达的肿瘤相关抗原,已证实该疫苗可延长小鼠的存活期。DNA疫苗与化疗联合使用时,针对多种肿瘤相关抗原也显示出更高的疗效。在一项针对可切除PDAC的1期试验中,一种个体化的mRNA新抗原疫苗(autogene cevumeran)与阿替利珠单抗及化疗联合使用,与对照组相比,使得疫苗增强的T细胞数量增加,且无复发生存期延长。
改变PDAC TME
由于PDAC具有抑制性TME,推进其治疗面临诸多挑战。这一微环境存在致密的间质屏障、大量浸润的免疫抑制细胞,且效应T细胞的渗透有限。间质细胞外基质(ECM)中含有如透明质酸(HA)这样的促结缔组织增生屏障。在小鼠模型中,PEGPH20(一种聚乙二醇化重组人源化透明质酸酶)可消耗透明质酸,并增强吉西他滨的疗效。在透明质酸含量高的转移性PDAC患者中,PEGPH20与白蛋白结合型紫杉醇/吉西他滨联合使用,仅提高了缓解率,并未改善PFS或OS。细胞外基质的另一个靶点是整合素;CEND - 1是一种靶向αV整合素和Neutrophillin - 1的环肽,它增加了晚期PDAC患者化疗药物的递送量,达到了59%的缓解率。
TME还包含免疫抑制细胞和细胞因子(如TGF-β、IL - 10),这些成分会促进肿瘤的免疫逃逸。Chibaya等人提出了一种新方法,将干扰素基因刺激剂(STING)和 Toll 样受体 4(TLR4)激动剂与 RAS 靶向疗法相结合,以激活NK和细胞毒性 T 细胞,从而PDAC模型中显著控制肿瘤负荷。
本综述全面分析了PDAC靶向治疗的最新进展。在攻克曾被认为 “无药可及” 的KRAS靶点难题方面,已取得显著进展,新方法包括设计新型小分子抑制剂、阻断上下游通路、基于siRNA的干预措施,以及创新的联合疗法。针对KRAS野生型PDAC开发精准疗法的工作也在不断拓展,与此同时,过继细胞疗法和疫苗研发也蓬勃发展。尽管这些治疗策略大多仍处于临床早期阶段,但治疗方案的快速发展,为抗击PDAC这一历来预后不佳的恶性肿瘤带来了新的希望。
参考文献:
Hoang T, Tsang ES. Advances in Novel Targeted Therapies for Pancreatic Adenocarcinoma. J Gastrointest Cancer. 2025;56(1):38. Published 2025 Jan 6. doi:10.1007/s12029-024-01149-w



