NGS检测揪出“隐匿”在胃食管连接处的碰撞瘤,多基因检测助力临床诊断罕见癌种
时间:2025-01-31 12:09:03 热度:37.1℃ 作者:网络
碰撞瘤的特征是两种独特的肿瘤紧密共存,这种肿瘤非常罕见,诊断起来很困难。当肿瘤属于同一组织学类型时更是如此。本文报告了这样一例病例,该患者通过下一代测序(NGS)和免疫组织化学对肿瘤进行全面分析,发现最初诊断为单个胃食管连接处(GEJ)腺癌包括两个独立的腺癌。GEJ食管部分肿块的活检显示错配修复缺陷(dMMR),MLH1和PMS2免疫表达缺失,而从胃部肿块进行的活检显示存在一个具有不一致、不重叠分子变异的肿瘤,包括EML4::ALK融合,以及错配修复完整(pMMR)。此病例说明了NGS可以作为碰撞瘤等肿瘤的一种诊断方式,这些肿瘤通常难以基于临床和组织学明确。这对于患者诊疗具有重要意义,特别是在可干预分子变异存在不一致的情况下。
背 景
碰撞瘤是由两个独特肿瘤在空间上相邻生长而形成的肿瘤。传统上,其诊断依据是肿瘤显示出具有不同组织学的不同区域,另外还规定,不同组织学类型之间不允许有混合区域或只有有限的混合区域,并且不应有组织学过渡区域。如果见到大面积的混合或中间组织形态学区域,则通常认为这些肿瘤应归类为复合肿瘤。复合肿瘤是指肿瘤显示出多种不同的组织形态学模式,但这些模式被解释为同一肿瘤的一部分。在这种情况下,可以假设复合肿瘤的不同区域代表由单个克隆细胞群产生的不同谱系;而在碰撞瘤中,不同组织学类型的来源是两种不同的肿瘤克隆增殖。
人们早就认识到肿瘤的组织学特征并不总是能够实际反映潜在的肿瘤生物学特性,并且随着有关其发病机制的更详细信息的出现,特别是在分子时代,许多肿瘤病例表明,基于组织病理学分类的缺陷变得越发明显。而对于碰撞和复合肿瘤,研究更加有限,但在不同器官系统中进行的一些小规模研究发现,基于组织病理学的诊断与使用分子方法对克隆性的评估之间存在差异。
碰撞瘤总体上很少见,此类肿瘤最常见的诊断部位之一是胃食管连接处(GEJ)。Milne 等人开展的一项研究调查了 5 例GEJ肿瘤的克隆性,每例肿瘤都包含鳞状细胞癌和腺癌成分。其中两例肿瘤根据组织学被诊断为碰撞瘤,三例被诊断为腺鳞癌——这是一种复合肿瘤。克隆性判定是基于TP53序列分析以及 10 个多态性基因座的杂合性缺失(LOH)分析。在该研究中,两例假定碰撞瘤的鳞状细胞和腺状成分在均具有独特的TP53突变,并且在多个基因座具有一致的LOH,这无法证明这些肿瘤是通过独立肿瘤发展而来的,而是表明它们来自共同前体肿瘤的不同组织学成分。在之前诊断的 3 例复合肿瘤中,分子数据证实了 2 例肿瘤为复合肿瘤。在第 3 例中,只有腺癌成分有TP53突变,LOH分析显示 4 个标记物存在差异,这表明第 3 例可能代表了一种碰撞瘤,尽管TP53突变可能发生在腺癌成分的晚期,并且两种成分仍然可能具有共同的早期前体,但碰撞瘤的可能性不能排除。这些发现强调了这样一点:仅根据组织学外观来评估克隆性可能很困难,有时甚至不可能。
本文报告一例胃食管交界处隐匿性碰撞瘤病例,“隐匿性”是指从临床、大体病理或组织学角度无法怀疑碰撞肿瘤是由多个不同的肿瘤组成。然而,通过下一代测序(NGS)对从肿瘤食管和胃部取样的组织进行肿瘤突变谱分析,显示出独特的、不重叠的分子谱。不同的突变谱在治疗意义方面也不同。
病 例
患者男,64 岁,无重大病史,因一年来吞咽困难恶化和体重下降六十磅而就诊。最近无法进食任何固体食物,否则会出现反流。胸部、腹部和骨盆的CT扫描显示胃小弯处有一个大肿块,没有明确的淋巴结肿大。食管胃十二指肠镜检查(EGD)显示一个 7-8 cm的肿块,从远端食管(从门齿开始 43 cm)延伸到胃食管连接处到胃底。肿块活检显示为中度至低分化的侵袭性腺癌,具有局灶性印戒细胞特征。免疫组织化学(IHC)和荧光原位杂交(FISH)HER2呈阴性。随后,患者转至美国罗伯特伍德约翰逊大学医院,再次接受EGD和内镜超声(EUS)检查,以进行分期、活检和食管支架放置。EGD显示,距门齿 45 cm处的胃食管交界处(GEJ)有一个大的环形肿块,几乎完全阻塞,并且 41 cm处的胃食管交界处肿块和相关结节与肿块不连续。在GEJ处对肿块进行了活检。下食管EUS显示,距门齿 41-45 cm 处有一个低回声的近环形肿块,超声证据表明肿块侵入了外膜,没有淋巴结肿大。超声内镜和成人内镜无法穿过 45 cm以外的肿块,但儿童胃镜可以进入胃部。检查显示胃部出现一个大块、溃疡、部分环状肿块,与胃食管交界处肿块相连,累及胃贲门和近端胃体,延伸至距门齿 55 cm。因此,肿块被归类为Siewert III型病变,T3期。食管部分肿块的活检显示浸润性恶性腺体,组织学符合中分化侵袭性腺癌(图1A)。IHC显示肿瘤细胞HER2阴性,与EBER原位杂交为阴性。错配修复(MMR)IHC显示肿瘤特异性MLH1和PMS2蛋白表达缺失,而MSH2和MSH6保留(图2)。PD-L1的IHC显示 2% 的肿瘤细胞呈PD-L1阳性(膜阳性),40% 的肿瘤相关免疫细胞呈PD-L1阳性(膜或细胞质阳性),得到综合阳性评分(CPS)为 25。
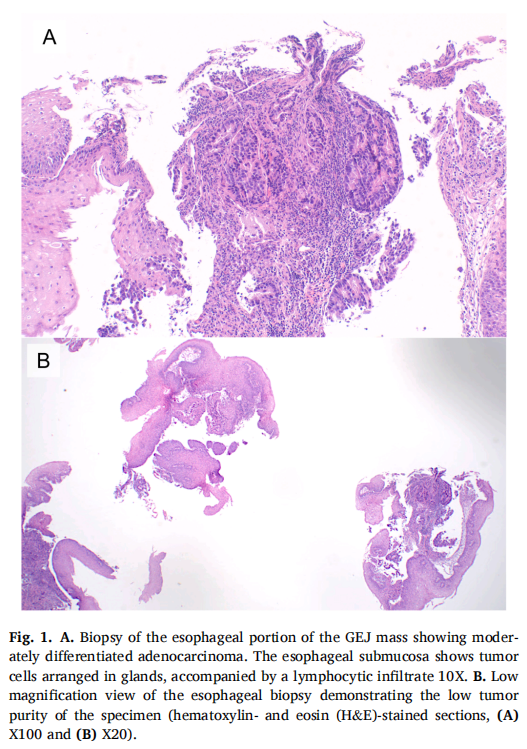
▲图1
A.GEJ肿块食管部分活检显示中分化腺癌;B.食管活检低倍率视图显示标本肿瘤含量低
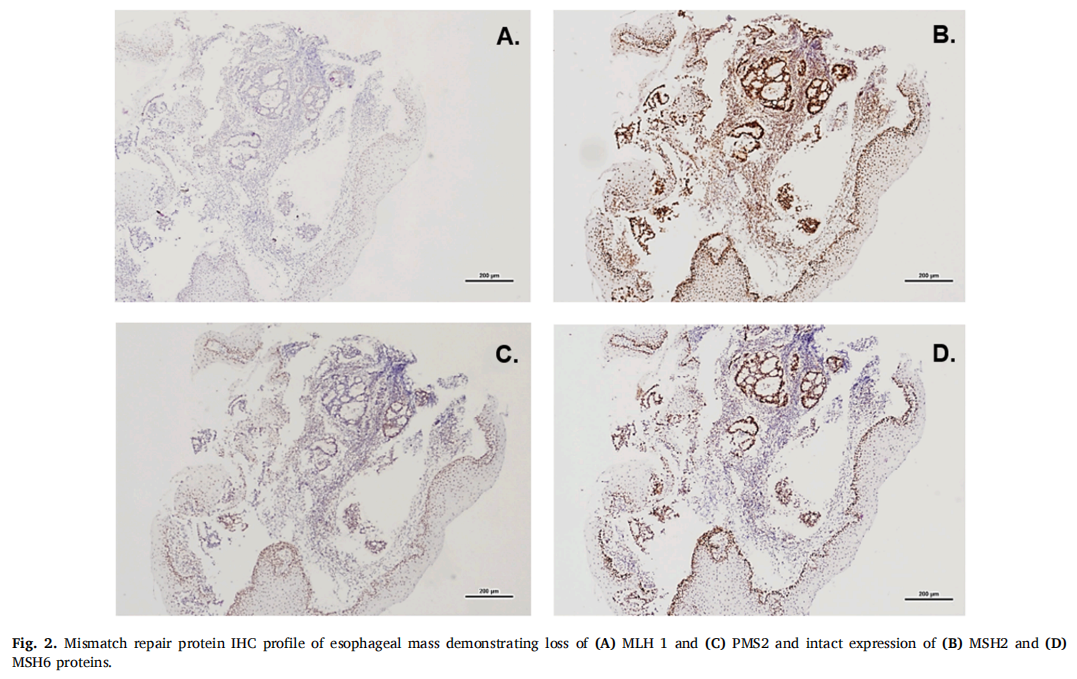
▲图2 食管肿块错配修复蛋白IHC检测显示(A)MLH1和(C)PMS2蛋白缺失,(B)MSH2和(D)MSH6蛋白表达保留
鉴于患者当时严重虚弱和恶性病理结果,研究人员评估手术风险高,也不适合接受多药新辅助化疗。由于患者肿瘤IHC检查结果显示dMMR,且疾病处于晚期,开始接受单药免疫疗法,即帕博利珠单抗。在接受第一轮帕博利珠单抗治疗后,患者临床症状有所改善,但保险公司拒绝支付更多轮次的治疗,因此患者开始接受亚叶酸、氟尿嘧啶和奥沙利铂(FOLFOX)化疗,并联合使用纳武利尤单抗进行免疫治疗。患者对治疗方案的耐受性良好,临床症状也有所改善,但 3 个月后重复CT检查显示胃食管交界处和胃小弯处有持续性肿块,无明显变化,腹腔干淋巴结肿大。
鉴于这些影像学发现,决定将患者的治疗方案改为多西他赛、奥沙利铂、亚叶酸钙和5-氟尿嘧啶(FLOT),并将先前食管肿块活检的组织送去使用F1CDx检测进行全面基因组分析(CGP)。通过NGS检测发现,肿瘤样本的肿瘤突变负荷(TMB)较低,为 2.52 mut/Mb,且微卫星稳定状态(MSS)与IHC的MMR结果不一致。报告的基因组改变有PIK3CA p.E542K,变异丰度(VAF)为 2.2%;PIK3CA p.E545K,变异丰度为 1.3%(解释为亚克隆变异);REL扩增和可疑的RAD21扩增。其它变异包括MSH3 p.G301fs*7(VAF 0.9%)、NOTCH1 p.N760fs*8(VAF 0.73%)和PIK3CA p.P539A(VAF 2.03%)。此外,已报告的未知意义变异(VUS)包括CDK12 p.N486S(VAF 51.02%)、MLH1 p.G336D(VAF 57.11%)、NOTCH3 p.L1574V(VAF 50.52%)、RET p.L160F(VAF 48.69%)和SPEN p.Y184C(VAF 47.17%),所有这些变异可能与胚系变异有关。在包括dbSNP和gnomAD在内的主要数据库中,这些变异的次要等位基因频率(MAF)均小于 0.005(0.5%),除RET变异外,其余四种变异的MAF均低于 0.0001(0.01%),其中两种(NOTCH3 L1574V和SPEN Y184C)不存在于这些数据库中(访问日期:2024 年 12 月 19 日)。这些基因分别位于不同的染色体上,因此它们不处于连锁不平衡状态。
此时,患者还接受了重新分期胃镜检查和活检,并移除了胃部的食管支架。EDG显示胃食管交界处存在远端食管结节,并延伸至贲门和胃底。远端食管通畅,因此未更换食管支架。对胃部肿块进行了活检,结果显示在大面积坏死背景下的侵袭性腺癌(图3)。
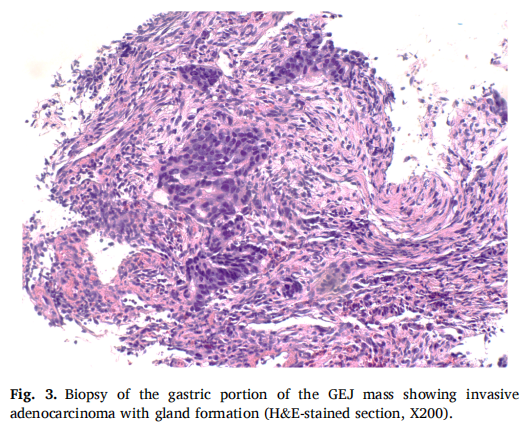
▲图3 胃食管交界处肿块胃部活检显示侵袭性腺癌,并有腺体形成
由于MMR IHC和FoundationOne MSS结果似乎不一致,且食管活检的肿瘤含量较低,因此胃活检组织随后被送往Caris Life Sciences进行基于NGS和IHC的进一步全面分子检测(MI Tumor Seek分析检测)。胃肿瘤组织的RNA测序显示致病性EML4::ALK融合(V3a),并且肿瘤细胞经IHC检测呈ALK阳性。基因检测进一步显示致病性PIK3CA变异 p.E726K(VAF 9%),与六个月前在食管肿块取样部分发现的两种PIK3CA变异均不同。在胃部肿瘤体系突变VAF中未发现之前报告的食管肿瘤体系变异。然而,之前报道的CDK12 p.N486S、MLH1 p.G336D、NOTCH3 p.L1574V、RET p.L160F和SPEN p.Y184C疑似胚系VUS均被检测到,VAF分别为 58%、62%、55%、47% 和 45%,所有这些变异都可能与胚系变异相符。后一个发现证实了两个肿瘤样本之间的基因差异不能用检测前错误(例如组织块混淆)来解释,因为这些样本显然来自同一患者。不同部位的肿瘤的IHC结果也存在一些差异。IHC显示胃肿瘤组织中的MMR表达完整(而食管肿瘤显示MLH1和PMS2缺失,尽管F1CDx检测将其归类为微卫星稳定)。胃组织还显示PD-L1染色阴性,CPS评分为 1。
研究人员机构的多学科肿瘤分子肿瘤委员会对分子发现进行了综合讨论。肿瘤两个区域组织的分子谱完全不重叠(表1)的解释是,它们包含独立的原发灶。食管肿瘤的dMMR与NGS的TMB-L和MSS结果之间的差异被归因于肿瘤含量低(图1B),导致F1CDx检测评估的NGS TMB和MSS状态结果错误。已知一些基于NGS的微卫星不稳定性算法在肿瘤含量低水平(<20%)下性能不佳,并且如FoundationOne报告附录中所述,TMB的估计取决于肿瘤含量、检测的检测限(LOD)和TMB评分中的变异过滤等。预计较低的肿瘤含量会导致某些变异低于LOD和/或因未达到阈值VAF(在FoundationOne报告的附录中报告为 5% VAF)而从TMB计算中过滤掉。检查报告的研究部分还显示MSH3(p.G301fs*7,0.9% VAF)和NOTCH1(p.G301fs*7,0.9% VAF)中存在移码突变。此类移码突变在dMMR肿瘤中很常见,为该肿瘤为dMMR提供了基因支持,与IHC结果一致。

▲表1 碰撞性胃食管肿瘤的关键分子和免疫组织化学发现总结。†表示后来在肿瘤复发的胸腔积液中检测到的变异
鉴于胃部肿块活检中发现EML4::ALK融合,还考虑了肺癌转移的可能性,并建议重新评估之前在影像学中发现的小肺结节。然而,随后的多次CT和PET扫描并未发现与稳定肺结节或任何其它可疑肺肿块相关的任何可疑特征。患者接受一个疗程卡铂和紫杉醇新辅助放化疗后,在机器人辅助下行左侧Ivor Lewis食管切除术及纵隔淋巴结清扫术。切除标本显示残留腺癌,位于 3.8 cm纤维化瘤床内(肿瘤消退评分 2,图4)。肿瘤侵入外膜和胃周软组织。所有淋巴结均为肿瘤阴性,3 个淋巴结显示无细胞黏蛋白,与治疗效果一致。边缘为肿瘤阴性。根据这些结果,患者开始接受纳武利尤单抗辅助维持治疗,这是基于Checkmate 577试验的结果。约一年后,患者因左侧胸腔积液增多而接受胸腔穿刺术。细胞学检查显示腺癌,肿瘤细胞MOC31、CK7和CDX2呈阳性,CK20呈局部阳性,TTF-1呈阴性(IHC染色),符合上消化道转移性腺癌。随后患者开始接受亚叶酸、氟尿嘧啶和伊立替康(FOLFIRI)方案治疗。
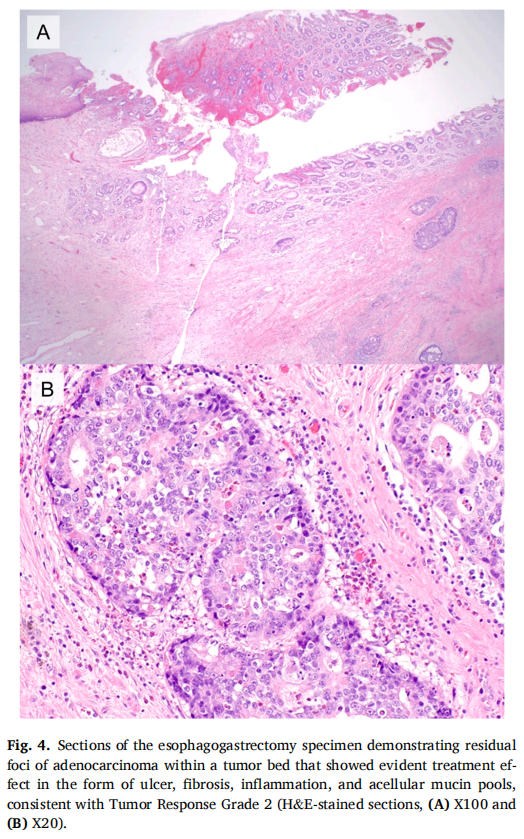
▲图4 食管胃切除术标本切片显示肿瘤床内残留腺癌灶,以溃疡、纤维化、炎症和无细胞粘蛋白池的形式显示出明显的治疗效果,符合肿瘤反应2级
胸腔积液细胞蜡块被送往Caris Life Sciences进行全面的分子分析,但由于标本中肿瘤细胞的比例较低,因此只完成了一组IHC染色。肿瘤细胞显示pMMR,并且与之前肿瘤的食管和胃部分一样,ISH检测显示ERBB2、BRAF V600E和EBER呈阴性。还对一种迄今为止尚未检测过的新型生物标志物进行了IHC,即CLDN18(Claudin 18.2),结果为阳性(80% 的肿瘤细胞呈阳性,2+评分)。Caris未进行ALK IHC。研究人员使用ALK-1进行了IHC检测,这种抗体不同于传统的ALK抗体(即抗体克隆号D5F3和抗体克隆号5A4),后者已获证对本文病例中发现的特异性EML4::ALK融合具有高灵敏度,这种融合在非小细胞肺癌(NSCLC)中最为常见。细胞学标本中的肿瘤细胞对ALK-1染色呈阴性。研究人员还对ALK基因重排进行了FISH检测,结果也为阴性,在所分析的 50 个间期细胞中均未检测到任何重排。
随后,研究人员进行了内部NGS检测,使用Trusight Tumor 15基因panel,其中包括PIK3CA的靶向区域,因为研究人员认识到胸腔积液细胞块样本肿瘤细胞含量低限制了检测体系变异的灵敏度。结果检出PIK3CA c.1633G>A、p.E545K突变(3.3% VAF)。这是在食管肿块活检中发现的三个PIK3CA突变之一。研究人员没有检测到最初在食管肿块中发现的另外两个同时发生的PIK3CA突变(c.1615和 c.1624)。PICK3CA c.1633基因座的测序深度为 58,352,附近的c.1615和c.1624基因座的测序深度相同。然而,研究人员再次注意到样本变异丰度与检测限(预设为 5% VAF)相比较低,可能与标本的肿瘤细胞含量低有关。总体而言,这些结果与食管肿瘤复发对应的恶性胸腔积液相一致,这一结果与FISH未检出EML4::ALK融合相一致。
讨 论
研究人员发现,对从相邻GEJ肿瘤的食管和胃部取样的组织进行全面的NGS检测,发现碰撞瘤由两个组织学相似的腺癌形成,具有明显、不重叠的分子变异。食管肿块活检显示中分化腺癌,基因组学特征为两个独立的PIK3CA突变(PIK3CA p.E542K和PIK3CA p.E545K)和REL扩增。肿瘤IHC还显示MLH1和PMS2缺失,以及某些与dMMR一致的基因变异,包括MSH3和NOTCH1中的移码突变。移码突变的富集是dMMR的一个基因组特征,并且已发现PIK3CA和NOTCH1突变在dMMR胃癌中富集。食管活检中所见的PD-L1阳性也与胃癌中的dMMR有关。
虽然胃部肿块测序显示与食管肿块存在相同的疑似胚系杂合变异,但检测到的体系变异完全不同,即完全不同的PIK3CA突变(p.E726K)和EML4::ALK融合。胃肿块IHC显示pMMR以及ALK阳性,再次显示出与食管肿块的不一致。
在一项关于胃癌切除样本的研究中,IHC检测发现ALK阳性率高达 8%,这表明ALK信号失调,但ALK融合/重排极为罕见,仅限于病例报告或病例系列中的个案。据报道,胃癌中有多种ALK融合伴侣,包括RAB10、HMBOX1以及EML4,就像本文病例中发现的一样。尽管EML4::ALK融合以其在 3-5% 的所有NSCLC中的致病作用而最为人所知,但也有报道称其存在于其它胃肠道癌中,包括多例结直肠腺癌和胰腺腺癌。
Ambrosini等人描述了一组应用ALK抑制剂治疗的ALK融合阳性胃肠道癌患者。所有患者均接受过至少一线转移性疾病的标准系统治疗。研究报告称,12 名患者中有 5 名通过 ALK抑制剂获得部分缓解,5 名患者病情稳定。该队列中包括一名转移性胃癌患者,该患者接受过多种化疗方案治疗。在病情进展并在淋巴结转移中发现ALK::HMBOX1融合(可能由相互重排引起,后经证实也存在于原发性胃癌手术标本中)后,患者安排接受ALK抑制剂阿来替尼治疗。阿来替尼治疗迅速且反应显著。经过七个月的治疗后,ctDNA检测显示存在ALK p.V1180L耐药突变,患者改用二线洛拉替尼,在疾病进展归因于另一种耐药突变的出现之前,影像学和临床反应持续了几个月。本病例报告说明了ALK抑制剂在晚期胃癌治疗中的潜在作用。ALK抑制剂对ALK融合阳性胃肠道肿瘤的疗效证据主要限于病例报告,因为鉴于这些病例的罕见性,不可能进行系统研究或对照试验。
本文病例涉及两个独立的胃肠道腺癌,它们“相撞”形成一个连续的肿块,从食管下段延伸到贲门。鉴于肿块的食管部分、胃部分和切除标本的活检均显示中度分化的肠型腺癌,因此无法确定“碰撞”的确切解剖位置。因此,这两个不同的肿瘤可能包括食管下段或胃食管结合部腺癌与胃食管结合部或贲门腺癌相撞。
关于GEJ腺癌应该归类为食管腺癌还是胃腺癌一直存在争议,其归类为食管腺癌或胃腺癌也经常变化。目前最广泛使用的分类依赖于肿瘤中心的确定。美国癌症联合委员会(AJCC)分期手册第八版将中心位于近端胃 2 cm 或以内的GEJ肿瘤归类为食管癌,而中心位于胃 2 cm以上的肿瘤归类为胃癌。美国病理学家学院(CAP)遵循此方案;涉及 GEJ且中心位于胃内 2 cm 以内的上皮性肿瘤使用CAP“食管癌患者标本检查方案”进行报告,而中心位于GEJ 2 cm以上的上皮性肿瘤则使用“胃癌患者标本检查方案” 清单进行报告。这种分类与关于这些肿瘤生物学起源的传统思想有所不同,其中位于远端食管中的涉及GEJ的腺癌被理解为源自Barrett食管(鳞状黏膜肠上皮化生),而位于GEJ或以下的腺癌被理解为胃贲门癌。然而,最近的研究颠覆了人们对Barrett食管起源的认识,多项证据表明胃贲门未分化细胞是食管腺癌的起源细胞。因此,胃食管连接处和食管的所有腺癌实际上可能都属于胃腺癌的一种类型。
碰撞瘤是同步原发性肿瘤的一种特例,只是生长到了相互接触的程度。据报道,食管和胃的同步原发性癌发生率相当高,尤其是在东亚和欧洲部分地区等高发地区。这种现象通常归因于这些肿瘤具有共同的危险因素,包括吸烟、饮酒和饮食习惯(包括吃熏制食品)。据推测,致癌物暴露会导致上消化道黏膜区域癌化,因此可以预计该区域内独立出现多个类似肿瘤的病例会偶尔发生。这种情况也可能发生在同一器官内,但在这种情况下,多个同步肿瘤被诊断出来的可能性要小得多,因为有指导方针规定,除非满足严格的标准,否则不要做出此类诊断。世卫组织IARC规则规定,在同一器官中同时发现的离散肿瘤只有当它们是不同的组织学类型时才应诊断为单独的肿瘤,例如腺癌和鳞状细胞癌。
采用IARC标准必然会导致同一器官中同一种组织学类型的多个同时性原发性肿瘤被误诊为单个肿瘤。然而,在一些胃腺癌发病率高的国家,如日本和中国,则使用不那么严格的标准,如最初由Moertel提出的标准;当发现离散的胃部病变在显微镜下被正常胃壁清楚地分隔开时,通常会诊断为两个独立的腺癌,并且其中一个病变为局部扩散或转移性肿瘤的可能性“被排除在合理怀疑之外”。在这些地区的研究发现,同时性多发性胃癌(SMGC)的发病率为 6%–14%,这已成为一个值得深入研究的课题。这些地区SMGC的危险因素包括高龄、男性、慢性萎缩性胃炎和严重肠上皮化生。其他已确定的相关性包括早期肿瘤分期、肠型形态和高分化组织学。
SMGC与早期检测相关的可重复发现并不令人惊讶,因为对于晚期肿瘤,人们会认为肿瘤可能开始相互影响,因此更有可能被误诊为单个肿瘤。由于晚期肿瘤通常也更有可能与转移有关,因此在晚期发现的并发胃癌也更有可能被认为是同一肿瘤,其中一个肿块代表局部扩散/转移。因此,SMGC与早期肿瘤分期之间的关联可能是对晚期肿瘤诊断的偏见导致的。
在组织学相似的同时性胃癌/胃食管癌中,至少有一个肿瘤为局部晚期,很可能只能像本文的病例一样偶然确诊。不同的IHC染色模式可能是诊断的线索。例如,Matsuda等人描述了临床上单个胃腺癌的EBER原位杂交和TP53 IHC染色如何意外地显示出异质性结果,其中EBER(+)/TP53(+)和EBER(-)/TP53(-)部分的边界清晰。他们认为,这一发现最简单的解释是两种独立腺癌的碰撞。在Imataki等人对胃腺癌进行的 10 年研究中, 在 1041 例(0.5%)胃癌中,有 5 例被诊断为碰撞胃腺癌。其中三例诊断基于不同的组织学表现,一例分化良好,一例边界清晰,无移行组织学,两例诊断基于IHC在组织学相似的肿瘤中鉴定出两个离散区域。在后两例中,CK7和MUC2的IHC突出显示了两个部分之间有明显的分离和清晰的边界。所有病例都进行了dMMR免疫组织化学评估。有趣的是,在 5 个碰撞瘤、共 10 个肿瘤中,有 9 个显示dMMR的免疫特征。一个碰撞瘤显示两个腺癌之间的MMR结果不一致,一个肿瘤dMMR,另一个pMMR,与本文病例中发现的类似。多项研究报道了dMMR与多发性同时性胃癌之间的关联。
虽然一些研究发现,单发和多发性胃癌(均为早期肿瘤)的预后没有差异,但这种情况下治疗方法(例如内镜黏膜切除术还是胃切除术)仍存在争议。对于包括碰撞瘤在内的晚期肿瘤,鉴于这些肿瘤的诊断罕见,预后意义和最佳治疗方案仍然未知。当根据分子数据诊断SMGC肿瘤时,数据本身可能会提示治疗方案。
Shao等报道了一例晚期SMGC病例,该病例涉及两个大的溃疡性胃病灶,一个位于贲门,一个位于胃窦,最初诊断为单发胃腺癌,采用化疗治疗,后来加用曲妥珠单抗,因为贲门病变的活检经IHC显示HER2阳性。然而,由于无法忍受的副作用,曲妥珠单抗在开始使用后不久就停止了。随着病情进展,对贲门和胃窦肿块进行的重复活检显示胃窦肿块为HER2阴性,因此对两个病变分别进行了NGS以确定它们是同步原发灶还是转移灶。两个病变之间没有发现重叠突变,因此推断它们是两个独立的肿瘤。与IHC结果一致,ERBB2扩增仅见于贲门病变,而胃窦病变显示微卫星不稳定以及MSH6的移码突变。随后,患者接受帕博利珠单抗联合化疗治疗。经过 5 个月的治疗,胃窦病变通过影像学检查已获得完全缓解,而贲门病变通过影像学和胃镜检查已获得部分缓解。几个月后,循环肿瘤DNA(ctDNA)显示ERBB2扩增,重新引入曲妥珠单抗直至患者接受全胃切除术和辅助化疗,结果在发表文章时持续缓解,总生存期为 43 个月。该病例表明,在肿瘤具有不同分子特征的SMGC中——包括碰撞肿瘤——针对每种肿瘤变异的不同疗法可能有助于带来持久反应。
结 论
鉴于碰撞瘤在临床和影像学上通常无法与其他它肿瘤区分开来,甚至根据组织学也难以区分,因此只能偶然做出诊断,就像本文病例一样。随着来自不同部位的肿瘤越来越多地接受全面的分子检测,并在多个时间点进行NGS(例如为了监测目的,对连续的血液样本进行ctDNA测序),隐匿性多发性肿瘤的发病率预计会增加。虽然多个同步原发性肿瘤同时发生本身就很有趣,但它也可能对治疗方案产生重要影响。如果发现不同的肿瘤具有不同的可靶向分子变异,就像本文病例中发现的那样,影响更为明显。因此,重要的是要意识到这种可能性,特别是在对治疗没有预期反应的病例中,因为据报道SMGC的发病率高达 14%。鉴于碰撞瘤罕见,目前尚无既定的治疗指南。需要更多的证据来确定碰撞瘤的最佳个性化治疗方法,以确保这些患者获得最佳的临床结果。
参考文献:
Blaszczyk MB, Boukhar SA, Zhou Z, Berim L, Ganesan S, Riedlinger GM. Occult collision tumor of the gastroesophageal junction comprising adenocarcinomas with distinct molecular profiles. Cancer Genet. 2025 Jan 4;292-293:27-34. doi: 10.1016/j.cancergen.2025.01.001. Epub ahead of print. PMID: 39805155.



