论著|比较不同成分短链脂肪酸的抗抑郁作用及对肠道菌群的影响
时间:2025-01-21 12:10:32 热度:37.1℃ 作者:网络
摘 要
目的 探讨不同成分短链脂肪酸(short-chain fatty acids,SCFAs)对慢性不可预测温和应激(chronic unpredictable mild stress,CUMS)模型大鼠抑郁样行为及肠道菌群的影响。
方法 76只雄性成年大鼠随机分为乙酸钠干预组(n=12)、丙酸钠干预组(n=15)、丁酸钠干预组(n=14)、短链脂肪酸混合物干预组(n=12)、模型组(n=13)、对照组(n=10)。除了对照组,其他组均采用CUMS进行抑郁造模,且在每日造模前连续干预。乙酸组、丙酸组、丁酸组按体质量1 mL/100 g分别腹腔注射50 mg/kg乙酸钠溶液、100 mg/kg丙酸钠溶液、50 mg/kg丁酸钠溶液;混合物组按体质量1 mL/100 g腹腔注射1∶1∶1的乙酸钠、丙酸钠、丁酸钠混合溶液;模型组按体质量1 mL/100 g腹腔注射生理盐水,干预组每日应激前给药,持续28 d。通过糖水偏好、强迫游泳及旷场实验评估大鼠行为;采集盲肠粪便样本,用16S rRNA测序分析肠道菌群组成。
结果 与对照组相比,模型组大鼠体质量下降,糖水偏好系数降低,不动时间延长(P<0.05),丁酸组逆转了糖水偏好系数、不动时间的改变(P<0.05),混合物组提高了糖水偏好系数(P<0.05)。与对照组比,模型组大鼠独有的物种数量减少且肠道群落结构发生改变;干预后乙酸组、丙酸组、丁酸组、混合物组独有的物种数量均升高且乙酸组肠道群落结构得到部分改善。LEfSe分析发现双歧杆菌属(Bifidobacterium)在丙酸组中富集,柯林斯菌属(Collinsella)在混合物组中富集。
结论 丁酸钠能明显改善大鼠的抑郁样行为,乙酸钠、丙酸钠、短链脂肪酸混合物会影响肠道菌群组成,但抗抑郁效果不明显。丁酸钠可能是一种补充短链脂肪酸干预抑郁症的更有效的选择。
关键词
抑郁;慢性不可预测温和应激;短链脂肪酸;胃肠道微生物;乙酸钠;丙酸钠;丁酸钠
抑郁症的发病机制复杂多样[1-2]。近年来,微生物-肠-脑(microbiota-gut-brain,MGB)轴逐渐成为研究抑郁症发病机制和潜在治疗途径的焦点,其中短链脂肪酸作为关键介质在MGB轴的交流中发挥重要作用[3-6]。既往临床研究观察到,抑郁症患者肠道菌群紊乱且粪便中短链脂肪酸含量下降[7-9];药物干预在改善啮齿动物的抑郁样行为时,也改变了动物肠道菌群结构和短链脂肪酸含量[10-11]。目前观察和比较不同成分短链脂肪酸抗抑郁效果的研究有限,因此,本研究采用慢性不可预测温和应激(chronic unpredictable mild stress,CUMS)模型,通过腹腔注射乙酸钠、丙酸钠、丁酸钠及短链脂肪酸混合物,比较不同成分短链脂肪酸的抗抑郁效果,并观察其对肠道菌群的影响,为短链脂肪酸在抗抑郁治疗的选择提供更好的理论基础。
1 对象与方法
1.1 动物分组、造模及干预 雄性成年Sprague-Dawley大鼠(6周龄),体质量(180±20) g,购于北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2021-0006]。本动物实验过程遵循动物伦理委员会规定。适应1周后,76只SD大鼠随机分为6组:乙酸钠干预组(n=12)、丙酸钠干预组(n=15)、丁酸钠干预组(n=14)、短链脂肪酸混合物干预组(n=12)、CUMS模型组(n=13)、对照组(n=10)。除了对照组外,其他组采用CUMS建立大鼠抑郁模型[12]。应激种类包括冷、热、束缚、噪声、异物、夹尾、黑暗、光亮、频闪灯、潮湿垫料、倾斜鼠笼、禁水禁食等,每日随机选择1~2种应激方式,连续3 d应激方式不重复,持续28 d。乙酸钠、丙酸钠、丁酸钠干预组按体质量1 mL/100 g分别腹腔注射50 mg/kg乙酸钠溶液、100 mg/kg丙酸钠溶液、50 mg/kg丁酸钠溶液;短链脂肪酸混合物组按体质量1 mL/100 g腹腔注射1∶1∶1的乙酸钠、丙酸钠、丁酸钠混合溶液;模型组按体质量1 mL/100 g腹腔注射生理盐水;对照组不做任何处理。干预组每日应激前给药,连续干预28 d。每日定时称量体质量,监测大鼠体质量变化。
1.2 行为学测试
1.2.1 糖水偏好实验 该实验主要评价大鼠快感缺失。禁水24 h后,每笼各放1瓶饮用水和1%的蔗糖水,为避免大鼠位置偏好对实验结果造成影响,12 h交换1次水瓶的位置,24 h后记录饮用水和蔗糖水的消耗量。糖水偏好系数=糖水消耗量/总液体消耗量。
1.2.2 强迫游泳实验 该实验主要评估大鼠的绝望行为。实验前一天将大鼠从笼中轻柔抓出,置于水深约为30 cm,温度为(24±1)℃的圆柱形容器(高45 cm,直径25 cm)中预游15 min进行适应,观察大鼠的游泳行为、攀爬行为、不动行为。正常情况下大鼠在水中会保持规律且流畅的游泳动作,攀爬行为表现为四肢伸出水面并沿桶壁向上爬行,不动行为表现为仅保持头部在水面以上,四肢浸入水中仅有轻微动作;攀爬行为、不动行为时间越长,提示其抑郁状态越严重。正式实验时将大鼠放置在上述相同的实验条件下进行5 min的强迫游泳,并用摄像机记录其表现。
1.2.3 旷场实验 该实验主要是对大鼠的探索行为和自主活动进行评估。活动场地为(100 cm×100 cm×40 cm)敞口的箱体,用摄像机记录大鼠5 min内在箱中活动情况,统计分析每只大鼠活动总距离、直立次数、中心区域活动时间和距离、外周区域活动时间和距离、穿箱次数。
1.3 肠道菌群16S rRNA测序 行为学实验全部结束后,将大鼠在麻醉状态下处死,留取大鼠盲肠内新鲜粪便样本,于无菌冻存管-80 ℃保存。所有样本的16S rRNA测序分析由上海派森诺生物科技有限公司完成并出具微生物群落多样性组成谱报告。16S rRNA测序实验流程包括提取微生物总DNA并采用Nanodrop定量,目标片段进行PCR扩增,扩增产物磁珠纯化收回并进行荧光定量,用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库,用MiSeq测序仪进行高通量测序得到Raw Data 序列。使用Cutadapt软件剪切掉引物序列,将合格的双端Raw Data使用QIIME2默认参数进行质量过滤、降噪、拼接及去嵌合体等质控分析,得到代表序列及扩增子序列变异(amplicon sequence variant,ASV)丰度表格。
1.4 肠道菌群差异性分析 采用α多样性分析反映样本物种的多样性程度,并通过稀疏曲线反映测序深度是否合适;基于Bray-Curtis距离的主坐标分析(principal co-ordinates analysis,PCoA)比较不同分组样本的β多样性;线性判别分析(linear discriminant analysis effect size,LEfSe)寻找组间具有统计学差异的生物标志。
1.5 统计学方法 采用SPSS 22.0进行统计学分析。体质量等正态分布数据采用均数±标准差(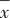 ±s)描述,糖水偏好系数、旷场实验的中心时间、直立次数等非正态数据用中位数(下四分位数,上四分位数)[M(QL,QU)]描述。体质量比较采用重复测量方差分析;行为学数据组间比较,正态数据用单因素方差分析,两两比较用Turkey检验,非正态数据用Kruskal-Wallis H检验,两两比较用Bonferroni法校正。检验水准α=0.05,双侧检验。
±s)描述,糖水偏好系数、旷场实验的中心时间、直立次数等非正态数据用中位数(下四分位数,上四分位数)[M(QL,QU)]描述。体质量比较采用重复测量方差分析;行为学数据组间比较,正态数据用单因素方差分析,两两比较用Turkey检验,非正态数据用Kruskal-Wallis H检验,两两比较用Bonferroni法校正。检验水准α=0.05,双侧检验。
2 结果
2.1 短链脂肪酸干预对大鼠体质量的影响 大鼠体质量分组与时间交互效应有统计学意义(F=22.016,P<0.001)。进一步的简单效应分析表明6组大鼠基线体质量无统计学差异(F=1.005, P=0.421),4周后,6组体质量存在统计学差异(F=22.448,P<0.001)。与对照组比,模型组、乙酸组、丙酸组、丁酸组、混合物组体质量均下降(P<0.001);与模型组比,乙酸组、丙酸组、丁酸组、混合物组体质量差异无统计学意义(P>0.05)。见表1。
表1 短链脂肪酸对大鼠体质量的影响Tab.1 Effects of short-chain fatty acids on body weight of rats
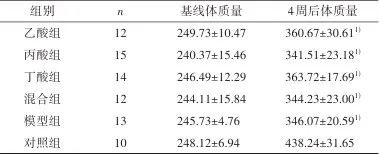
1)经重复测量方差分析,与对照组比较,经Bonferroni校正,P<0.01。
2.2 短链脂肪酸干预对抑郁大鼠行为学的影响 6组间糖水偏好系数(H=35.472, P<0.001)、强迫游泳的不动时间(F=3.408, P=0.008)、旷场实验中运动总距离(F=3.290, P=0.010)和直立次数(H=18.717, P=0.002)有统计学差异。与对照组相比,模型组的糖水偏好系数下降(P=0.001)、不动时间升高(P=0.010)、运动总距离(P=0.012)和直立次数(P=0.022)下降;乙酸组(P=0.023)、混合物组(P=0.024)的运动总距离下降;丙酸组(P=0.048)、混合物组(P=0.002)的直立次数下降。与模型组相比,丁酸组、混合物组的糖水偏好系数增加(P<0.001);丁酸组的不动时间降低(P=0.013)。见表2。
表2 短链脂肪酸对大鼠行为学指标的影响Tab.2 Effects of short-chain fatty acids on behavioral induces of rats
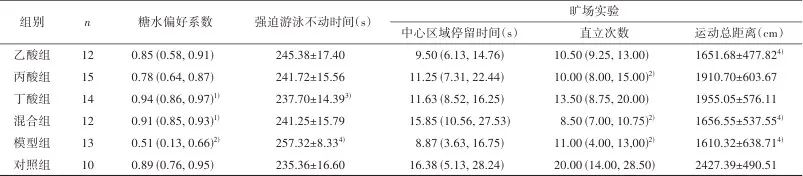
1)经Kruskal-Wallis H检验,与模型组比较,经Bonferroni校正,P<0.05;2)经Kruskal-Wallis H检验,与对照组比较,经Bonferroni校正,P<0.05;3)经单因素方差分析,与模型组比较,经Turkey校正,P<0.05;4)经单因素方差分析,与对照组比较,经Turkey校正,P<0.05。
2.3 短链脂肪酸干预对大鼠肠道菌群组成的影响 各组大鼠盲肠粪便样本的稀释曲线见图1,送测数量合理,测序深度可以满足后续研究。ASV维恩图结果显示,与对照组比较,模型组独有的物种数量降低;与模型组比较,乙酸组、丙酸组、丁酸组、混合物组独有的物种数量升高。见图2。
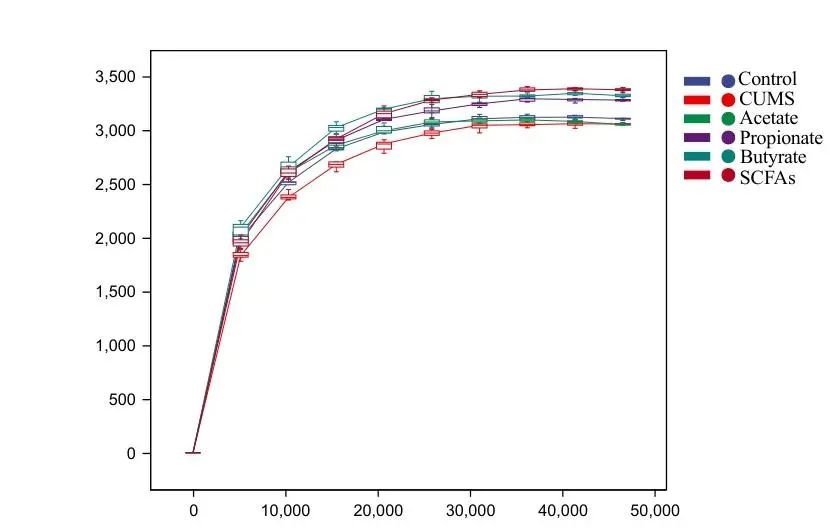
图1 各组大鼠盲肠粪便样本的稀释曲线 注:Control,对照组;CUMS,慢性不可预测温和应激模型组;Acetate,乙酸钠组;Propionate,丙酸钠组;Butyrate,丁酸钠组;SCFAs,短链脂肪酸混合物组。Fig.1 A-dilution curve of cecal fecal samples in each group

图2 各组样本扩增子序列变异的花瓣图Fig.2 Petals of ASV in each group
6组间Chao1、Faith’s PD、Pielou’s evenness、Observed species、Shannon、Simpson、Good’s coverage指数均无统计学差异(P>0.05),表明肠道菌群α多样性无差异。PCoA分析显示对照组和模型组样本分别位于2个位置,丙酸组、丁酸组、混合物组与模型组部分样本有交叉,乙酸组大部分样本位于对照组和模型组中间。见图3。
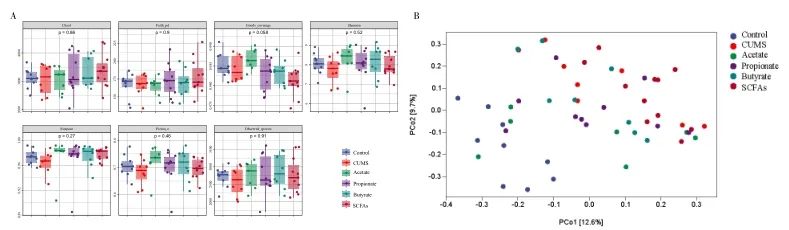
图3 短链脂肪酸对大鼠肠道菌群多样性的影响 A. Chao1、Faith’s PD、Pielou’s evenness、Observed species、Shannon、Simpson、Good’s coverage指数箱线图;B. 肠道菌群主坐标分析图。Fig.3 Effect of short-chain fatty acids on intestinal flora diversity of rats
LEfSe分析共鉴定出26个有统计学差异(LDA>1)的特征物种,其中属水平下的物种有9种:rc4-4属(rc4_4)、萨特氏菌属(Sutterella)、乳球菌属(Lactococcus)在对照组富集,苯基杆菌属(Phenylobacterium)、肠球菌属(Enterococcus)、螺杆菌属(Helicobacter)在模型组富集,双歧杆菌属(Bifidobacterium)在丙酸组富集,HB2_32_21属在丁酸组富集,柯林斯菌属(Collinsella)在混合物组富集。见图4。
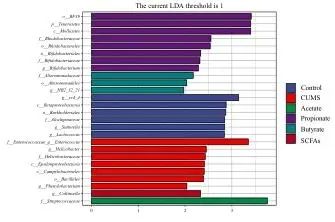
图4 大鼠肠道菌群差异物种的线性判别分析效应值柱状图Fig.4 Histogram of LDA effect values for different species of intestinal flora of rats
3 讨论
抑郁症生理病理学背后的确切机制仍然未知,但越来越多的证据表明,SCFAs能够直接或者间接参与调节MGB轴,从而影响大脑信号传递和功能作用[13-14]。本课题组前期的临床数据分析表明抑郁障碍患者血浆中短链脂肪酸水平显著低于健康被试,且抑郁症状、短链脂肪酸与肠道菌群密切相关[15],故本研究对抑郁大鼠分别腹腔注射乙酸钠、丙酸钠、丁酸钠及短链脂肪酸混合物,比较不同成分短链脂肪酸的抗抑郁效果,并观察其对肠道微生物群组成的影响。在本研究中,模型大鼠体质量下降,糖水偏好系数降低,不动时间延长,运动总距离和直立次数减少,表明CUMS抑郁造模有效。与既往研究结果[16-17]一致,本研究观察到丁酸钠表现出明显的抗抑郁效果,丁酸组逆转了糖水偏好系数、不动时间的改变。丁酸盐已被证明不仅能调节肠道健康、抑制炎症、发挥抗氧化作用[18-19],还是一种潜在的抑郁症治疗剂。研究报道,单剂量或连续注射28 d丁酸钠、氟西汀混合物能显著降低小鼠悬尾实验的不动时间,改善效果优于氟西汀单药治疗[20]。本研究中混合物组提高了糖水偏好系数,表现出抗抑郁的作用,与既往研究结果[21]一致,但混合组没有改善大鼠体质量的下降和不动时间的延长。
SCFAs是肠道微生物发酵膳食纤维的代谢产物,包括乙酸盐、丙酸盐、丁酸盐,是细胞的能量物质,也能作为组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACI)调节宿主的一系列生理过程[22]。BEHRENS等[23]给CUMS大鼠分别口服补充乙酸钠、丙酸钠、丁酸钠及三种混合物1周后,发现丙酸钠能通过调节肠道微生物、组蛋白p的表观遗传,改善抑郁样行为;HUANG等[24]发现灌胃3 d的三乙酸甘油酯(在非特异性酯酶的作用下能分解为乙酸和甘油,有效提高循环和组织中乙酸钠水平)能增强海马锥体神经元的树突状分支和脊柱密度,促进组蛋白p和p的乙酰化,改善慢性社交挫败应激模型小鼠的抑郁样行为;但本研究并没有发现乙酸钠、丙酸钠对抑郁的改善作用。本研究结果提示相比于乙酸钠、丙酸钠、短链脂肪酸混合物,丁酸钠能有效改善大鼠的抑郁样行为,可能是一种潜在的干预抑郁症的选择。
与对照组相比,模型组大鼠肠道独有的物种数量减少且群落结构发生改变;干预后乙酸组、丙酸组、丁酸组、混合物组独有的物种数量均升高,并且乙酸组肠道群落结构得到部分改善。短链脂肪酸可以促进益生菌增殖、调节肠道pH,创造有利于益生菌生存和增殖的环境,维持肠道菌群的平衡和健康[25]。作为MGB轴的中间介质,肠道菌群能够持续产生SCFAs,这些SCFAs能通过肠神经系统、内分泌系统、免疫系统等调控大脑功能[26]。本研究中LEfSe分析发现双歧杆菌属(Bifidobacterium)在丙酸组中富集。双歧杆菌属是一类常见的肠道益生菌且能产生SCFAs[27-28],既往研究表明,双歧杆菌(Bifidobacterium longum)能够产生神经递质高香草酸,通过抑制自噬性死亡保护海马神经元,进而缓解抑郁[29-31]。产SCFAs的益生菌主要包括乳杆菌、双歧杆菌和丁酸梭菌等[28],YU等[10]用多糖显著改善了慢性应激诱导的大鼠肠道微生物群的紊乱,特别是影响产生短链脂肪酸的细菌,例如乳酸杆菌。但本研究并未发现丙酸钠的改善作用。
综上,相比于乙酸钠、丙酸钠、短链脂肪酸混合物,丁酸钠能有效改善大鼠抑郁样行为。本研究只关注了短链脂肪酸对肠道菌群的影响,没有检测相关脑组织炎症因子、信号通路的改变。后续应该深入研究短链脂肪酸抗抑郁的具体机制,进一步解释其与脑肠轴之间的关联。
参考文献:
1. 伊思敏, 鲁成好, 翁飞鸿, 等. 不同营养成分对抑郁障碍影响的研究进展[J]. 中国神经精神疾病杂志, 2023, 49(10): 620-624.
2. CUI L, LI S, WANG S, et al. Major depressive disorder: Hypothesis, mechanism, prevention and treatment[J]. Signal Transduct Target Ther, 2024, 9(1): 30.
3. 荆琳, 刘鹏鸿, 孙宁. 重性抑郁障碍患者肠道菌群特征及其与睡眠质量的相关性分析[J]. 中国微生态学杂志, 2024, 36(8): 922-926, 932.
4. CHANG L, WEI Y, HASHIMOTO K. Brain–gut–microbiota axis in depression: A historical overview and future directions[J]. Brain Res Bull, 2022, 182: 44-56.
5. DALILE B, VAN OUDENHOVE L, VERVLIET B, et al. The role of short-chain fatty acids in microbiota–gut–brain communication[J]. Nat Rev Gastroenterol Hepatol, 2019, 16: 461-478.
6. 陈露, 陶芳标, 黄锟. 短链脂肪酸在微生物-肠-脑轴影响神经精神障碍中的作用[J/OL]. 营养学报 (2024-11-27) [2024-10-31]. https://doi.org/10.13325/j.cnki.acta.nutr.sin.20240912.002.
7. HU X, LI Y, WU J, et al. Changes of gut microbiota reflect the severity of major depressive disorder: A cross pal study[J]. Transl Psychiatry, 2023, 13(1): 137.
8. SKONIECZNA-ZYDECKA K, GROCHANS E, MACIEJEWSKA D, et al. Faecal short chain fatty acids profile is changed in Polish depressive women[J]. Nutrients, 2018, 10: 1939.
9. BRUUN C F, HALDOR HANSEN T, VINBERG M, et al. Associations between short-chain fatty acid levels and mood disorder symptoms: A systematic review[J]. Nutr Neurosci, 2024, 27(8): 899-912.
10. YU M, CAI C C, HUANG Y F, et al. A novel antidepressant homogeneous polysaccharide YLP-1 from Millettia pulchra ameliorates tryptophan metabolism and SCFAs through modulating gut microbiota[J]. Carbohydr Polym, 2024, 344: 122527.
11. 杨红宇, 蒋家豪, 裴雨轩, 等. 乳酸片球菌CCFM6432通过缓解大脑炎症改善小鼠抑郁行为[J]. 食品与发酵工业, 2024, 50(19): 25-32.
12. ZHANG Y, HUANG J, XIONG Y, et al. Jasmine tea attenuates chronic unpredictable mild stress-induced depressive-like behavior in rats via the gut-brain axis[J]. Nutrients, 2021, 14(1): 99.
13. MIRZAEI R, BOUZARI B, HOSSEINI-FARD S R, et al. Role of microbiota-derived short-chain fatty acids in nervous system disorders[J]. Biomed Pharmacother, 2021, 139: 111661.
14. AVERINA O V, ZORKINA Y A, YUNES R A, et al. Bacterial metabolites of human gut microbiota correlating with depression[J]. Int J Mol Sci, 2020, 21(23): 9234.
15. 张艳艳. 抑郁障碍中肠道菌群与短链脂肪酸的特征及其相互作用研究[D]. 太原: 山西医科大学, 2023.
16. VALVASSORI S S, R RESENDE W, BUDNI J, et al. Sodium butyrate, a histone deacetylase inhibitor, reverses behavioral and mitochondrial alterations in animal models of depression induced by early-or late-life stress[J]. Curr Neurovasc Res, 2015, 12(4): 312-320.
17. VALVASSORI S S, VARELA R B, ARENT C O, et al. Sodium butyrate functions as an antidepressant and improves cognition with enhanced neurotrophic expression in models of maternal deprivation and chronic mild stress[J]. Curr Neurovasc Res, 2014, 11(4): 359-366.
18. 梁胜男, 柯楚新, 黄鹤, 等. 肠道内产丁酸细菌及其产物丁酸生理功能的研究进展[J]. 微生物学通报, 2021, 48(3): 948-959.
19. ALPINO G C Á, PEREIRA-SOL G A, DIAS M M, et al. Beneficial effects of butyrate on brain functions: A view of epigenetic[J]. Crit Rev Food Sci Nutr, 2024, 64(12): 3961-3970.
20. SCHROEDER F A, LIN C L, CRUSIO W E, et al. Antidepressant-like effects of the histone deacetylase inhibitor, sodium butyrate, in the mouse[J]. Biol Psychiat, 2007, 62(1): 55-64
21. VAN DE WOUW M, BOEHME M, LYTE J M, et al. Short-chain fatty acids: Microbial metabolites that alleviate stress-induced brain-gut axis alterations[J]. J Physiol, 2018, 596(20): 4923-4944.
22. VAN DER HEE B, WELLS J M. Microbial regulation of host physiology by short-chain fatty acids[J]. Trends Microbiol, 2021, 29(8): 700-712.
23. BEHRENS L M P, GASPAROTTO J, RAMPELOTTO P H, et al. Sodium propionate oral supplementation ameliorates depressive-like behavior through gut microbiome and histone 3 epigenetic regulation[J]. J Nutr Biochem, 2024, 130: 109660.
24. HUANG W, HU W, CAI L, et al. Acetate supplementation produces antidepressant-like effect via enhanced histone acetylation[J]. J Affect, 2021, 281: 51-60.
25. DELEU S, MACHIELS K, RAES J, et al. Short chain fatty acids and its producing organisms: An overlooked therapy for IBD?[J]. EBioMedicine, 2021, 66: 103293.
26. LIU L, WANG H, CHEN X, et al. Gut microbiota and its metabolites in depression: From pathogenesis to treatment[J]. EBioMedicine, 2023, 90: 104527.
27. CHEN J, CHEN X, HO C L. Recent development of probiotic bifidobacteria for treating human diseases[J]. Front Bioeng Biotechnol, 2021, 9: 770248.
28. 卜子晨, 夏永军, 艾连中, 等. 益生菌中短链脂肪酸的合成途径及功能性研究[J]. 食品与发酵工业, 2022, 48(14): 286-291, 302.
29. ZHAO M, REN Z, ZHAO A, et al. Gut bacteria-driven homovanillic acid alleviates depression by modulating synaptic integrity[J]. Cell Metab, 2024, 36(5): 1000-1012.e6.
30. 徐磊, 赵润平, 陈洁云, 等. 基于CUMS模型探究抑郁症对细菌感染的影响及作用(英文)[J]. 中山大学学报(医学科学版), 2024, 45(4): 567-581.
31. 田明, 郑丹, 刘春龙.肠道微生物参与抑郁症发病机制研究进展[J]. 临床军医杂志, 2022, 50(6): 658-660.
【引用格式】陈金蓉,张艳艳,张睿彧,等. 比较不同成分短链脂肪酸的抗抑郁作用及对肠道菌群的影响[J]. 中国神经精神疾病杂志,2024,50(11):668-674.
【Cite this article】CHEN J R,ZHANG Y Y,ZHANG R Y,et al.To compare the antidepressant effects and impact on intestinal flora of different components of short-chain fatty acid[J]. Chin J Nervous Mental Dis,2024,50(11):668-674.
DOI:10.3969/j.issn.1002-0152.2024.011.005


