吉林大学林权教授团队ACS Nano:纳米酶作为肿瘤能量稳态破坏器增强级联催化治疗
时间:2024-12-18 12:00:44 热度:37.1℃ 作者:网络
肺癌是全球疾病负担最重的恶性肿瘤之一。在各种类型的肺癌中,非小细胞肺癌(NSCLC)约占所有肺癌的 85%,其发病率和死亡率逐年上升,严重威胁患者的健康。然而,传统的癌症治疗方法常常效果有限,因此,寻找更有效的治疗策略成为当前科学研究的重点。基于肿瘤微环境(TME)特征构建特异性治疗纳米材料,已成为实现精准治疗的有力途径。肿瘤细胞表现出异常的代谢特征,导致TME中葡萄糖代谢增强、轻度酸性环境、谷胱甘肽(GSH)和过氧化氢(H2O2)水平升高,这些变化是癌细胞适应性反应的结果,并通过复杂的氧化还原调节增强了其抗氧化防御机制。TME的独特特性为治疗提供了特异性和宝贵的靶点。因此,针对这些内源性生化变化调节肿瘤细胞的适应性稳态,是一种可行的治疗策略。
针对上述挑战,吉林大学林权团队和吉林大学第一医院王春艳团队合作开发一种的“肿瘤能量稳态破坏器”Cu2O@Au纳米酶,它具有优异的葡萄糖氧化酶样活性能够用于饥饿治疗,并模拟过氧化物酶(POD)用于化学动力学治疗(CDT)产生•OH。Cu2O@Au纳米酶在肿瘤部位消耗葡萄糖,阻断肿瘤的能量供应,持续产生H2O2,并降低pH值,从而提高CDT的效率,引发级联反应,导致活性氧(ROS)的风暴。此外,Cu2O@Au纳米酶消耗GSH,降低SLC7A11(xCT)蛋白的表达,减少癌细胞对半胱氨酸的摄取,进一步促进ROS的积累,导致肿瘤细胞脂质过氧化,并最终引发铁死亡。Cu2O@Au纳米酶的优异光热性能还可以进一步增强CDT的治疗效果。此外,Cu2O@Au纳米酶还具有CT和光热成像能力。综上所述,Cu2O@Au纳米酶作为肿瘤能量稳态破坏器,能够有效抑制肿瘤生长,并成功实现饥饿治疗/CDT/光热治疗(PTT)的协同效应。相关工作以“Nanozyme as Tumor Energy Homeostasis Disruptor to Augment Cascade Catalytic Therapy”为题发表在《ACS Nano》。第一作者为吉林大学化学学院博士生李星辰和吉林大学第一医院博士生张霞。

【文章要点】
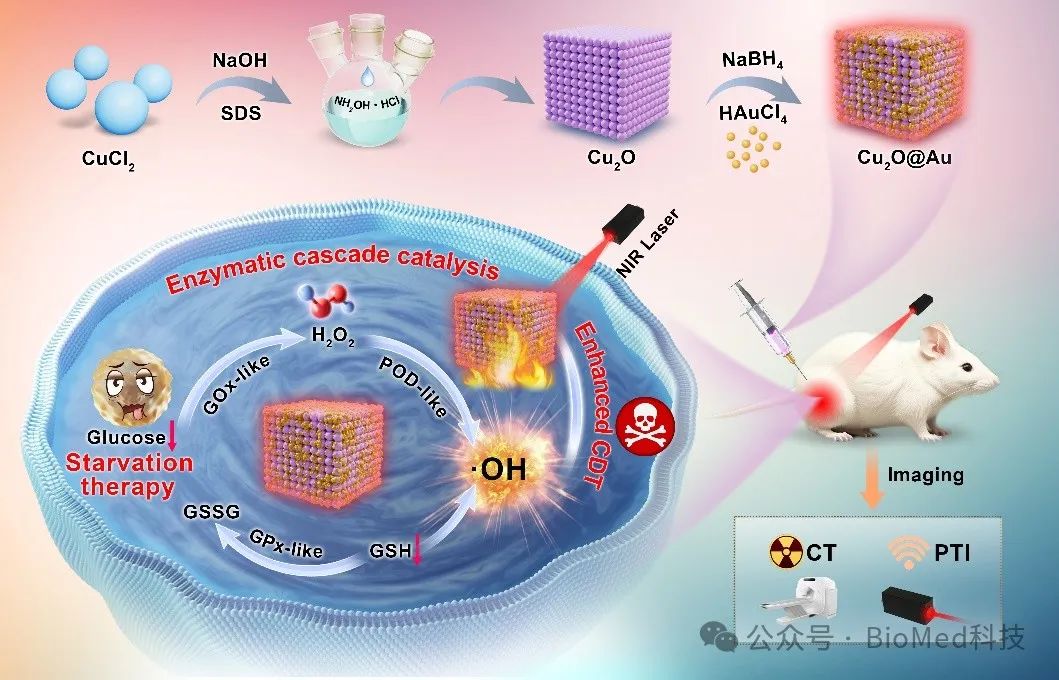
图1. Cu2O@Au纳米酶的制备及抗肿瘤机制示意图
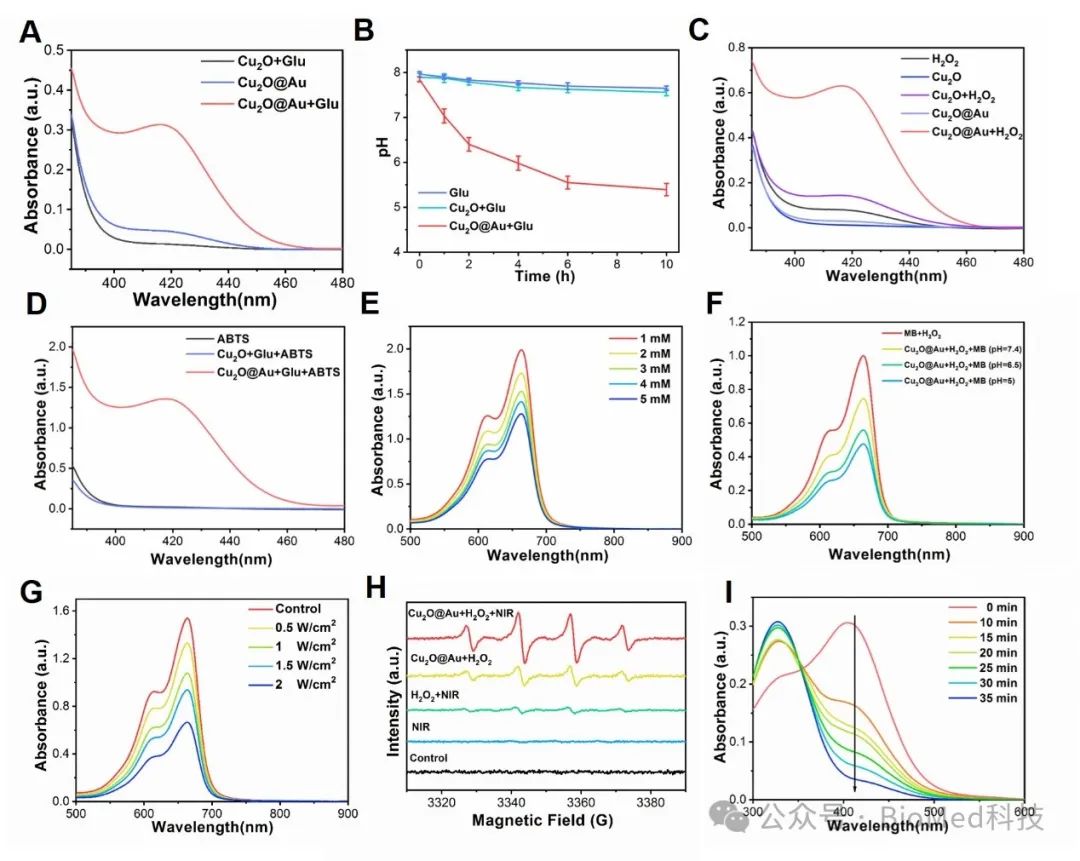
图2. Cu2O@Au纳米酶的类酶活性评价
铁死亡的调调控涉及一系列复杂的生物过程。为了研究Cu2O@Au纳米酶的抗癌机制,我们主要聚焦于驱动铁凋亡的核心途径:ROS的产生、半胱氨酸消耗以及脂质过氧化。在Cu2O@Au纳米酶的类GPx活性作用下,GSH被氧化为GSSG,从而阻断GPX4的合成并抑制其表达。GPX4的失活抑制了有害的脂质过氧化物(LPO)向无毒羟基化合物(LOH)的转化。随着Cu2O@Au纳米酶剂量的增加,以及NIR、Glu和H2O2对Cu2O@Au纳米酶的作用,GSH浓度显著降低(图3F、G),并导致GPX4蛋白表达下调(图3C、E)。这一变化与丙二醛(MDA)含量的增加相吻合,丙二醛是LPO的关键终产物,Cu2O@Au纳米酶的浓度增高后,无论有无NIR、Glu或H2O2作用,MDA的含量均明显升高(图3H、I)。此外,Cu2O@Au纳米酶通过下调SLC7A11(xCT)蛋白的表达,减少癌细胞对半胱氨酸的摄取(图3C、D),进一步降低了GSH水平。这些结果表明,Cu2O@Au纳米酶可以显著消耗GSH,诱导GPX4失活并增强ROS的积累,从而导致LPO的积累,最终引发铁死亡。GSH的补充显著提高了细胞活力,强调了Cu2O@Au纳米酶在增强治疗效果中的关键作用(图3J)。
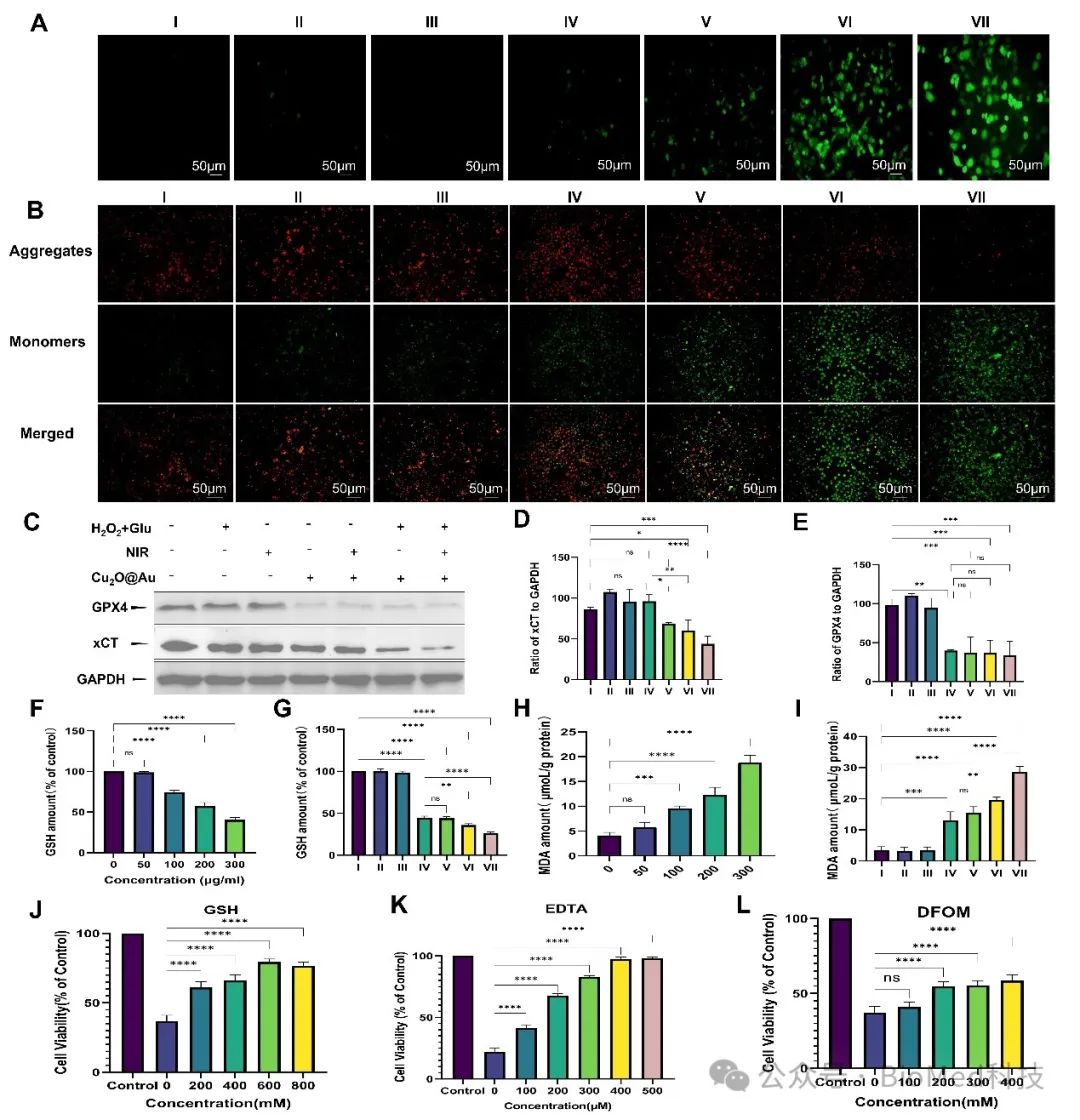
图3. Cu2O@Au纳米酶引发铁死亡反应的体外评价
【结论与展望】
本研究构建了Cu2O@Au纳米酶,具备三种类酶活性:类葡萄糖氧化酶(GOx)、类过氧化物酶(POD)和类谷胱甘肽过氧化物酶(GPx)。通过破坏肿瘤能量稳态,引发级联反应,在体外和体内实验中,Cu2O@Au纳米酶均表现出了较高的治疗效果,有望为癌症治疗提供有价值的见解和治疗策略。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c09982


