孙永涛教授:艾滋病抗病毒治疗的耐药管理
时间:2024-12-05 13:18:10 热度:37.1℃ 作者:网络
艾滋病作为一种严重的传染病,其抗病毒治疗一直是医学界关注的重点。然而,随着抗病毒药物的广泛应用,耐药性问题日益凸显,成为影响治疗效果和疾病控制的关键因素。耐药管理不仅关乎患者的生命健康,更涉及公共卫生安全的维护。近期,第四军医大学唐都医院孙永涛教授分享“艾滋病抗病毒治疗的耐药管理”,感染前沿特将精华部分整理成文,以飨读者。
我国HIV/AIDS病例报告(NCAIDS)
截至2022年底,报告现存活HIV/AIDS 122.3万例(68.9万+53.4万),累计报告死亡41.8万例。2022年新报告HIV/AIDS 10.78万例,50岁及以上病例占48.1%。2022年报告死亡3.0万,报告死亡比例为2.4%。
全国新报告HIV/AIDS病例人数呈现“两头翘”
新报告病例年龄构成提示,60岁以上和15-25岁年龄组报告人数较多。
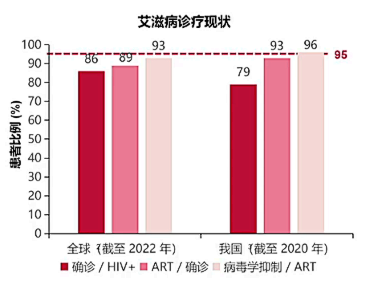
艾滋病全球防治目标与我国达成进展
联合国关于艾滋病检测、治疗和病毒抑制2025阶段性目标:95%感染者知晓自己的感染状态,95%确诊者接受抗反转录病毒治疗(ART),95%接受ART的患者达到病毒学抑制。
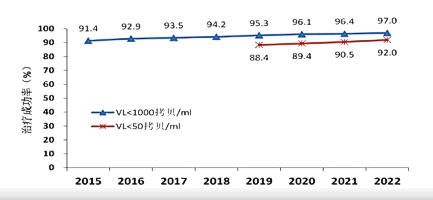
我国在不同检测标准下的治疗成功率
LLV的发生提高治疗失败以及耐药的风险
一项地坛医院8098例患者分析显示病毒学失败发生率随PLLV的病毒水平增加而增加。一项意大利1999-2012年间经治感染者12828份血浆样本回顾性研究,显示耐药比例随着LLV的病毒水平增加而增加。
关注HIV耐药趋势及危害
1 HIV抗病毒治疗的主要目标是实现持续病毒学抑制并减少耐药发生
FDA指南:持久地将血浆HIV RNA水平抑制维持在HIV RNA可检测水平以下。
DHHS指南:最大限度和持久地抑制病毒复制,以延迟和减少耐药突变的出现,维持和恢复CD4 细胞计数,并带来实质性的临床获益。
《中国艾滋病诊疗指南(2024年版)》:最大限度地抑制病毒复制,使病毒载量降低至检测下限并减少病毒变异。重建免疫功能、降低异常免疫激活、减少非艾滋病相关疾病的发病率和病死率,使患者获得正常的预期寿命,提高生活质量。
若经ART治疗无法实现持续病毒学抑制,则可能会对方案的一种或多种成分产生耐药突变。
2 HIV耐药是如何发生的
HIV本身存在较高的基因多态性,变异株多,且病毒在反转录过程中错配率高。HIV每天都进行多轮复制,在复制过程中,HIV能够且会产生突变,在抗反转录病毒药物压力下产生突变时,可能会发生耐药。
3 HIV耐药可根据发生机制分为两大类
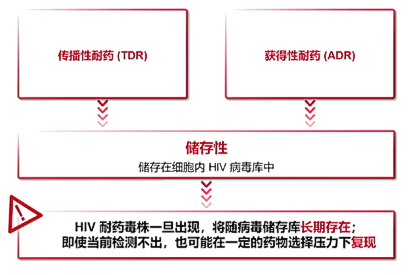
传播性耐药(TDR)
无ARV暴露史的ART初治感染者,感染耐药突变病毒株。未接受ART的情况下,许多耐药病毒株的适应能力低于野生型,复制能力降低,有几率可恢复为野生型主导。ART造成的选择压力可致突变株再次出现并成为主要毒株,进而导致病毒学失败。
获得性耐药(ADR)
未感染耐药突变毒株的感染者在接受ART的过程中,HIV发生耐药变异。发生在ARV水平不足的感染者中,可能的原因包括依从性不足,ARV耐药屏障低或存在DDI。可能导致对ART的应答减弱和病毒学失败。
4 中国HIV TDR流行率逐渐升高,主要由NNRTI耐药驱动
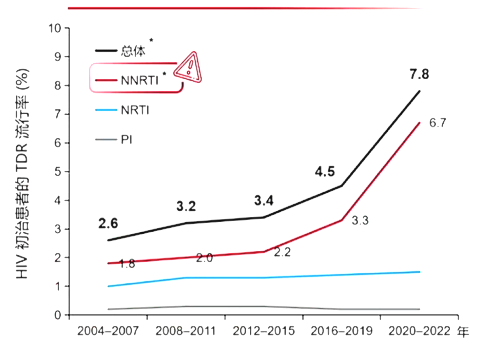
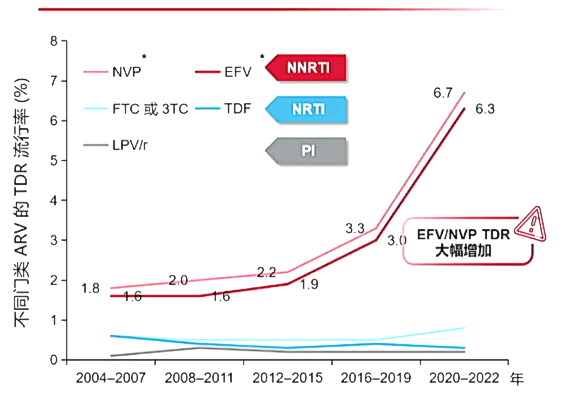
5 中国NNRTI TDR流行率大幅增长,呈现出高水平EFV和NVP耐药。
6 我们需要更加重视耐药发生的风险
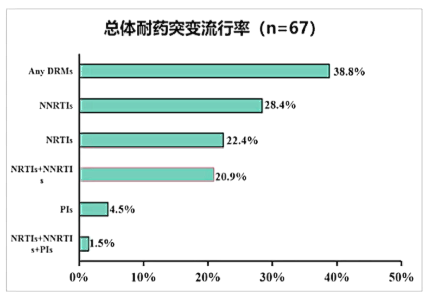
26例(38.8%)至少具有一个DRMs;单药:28.4%对NNRTIs耐药,22.4%对NRTIs耐药,4.5%对PIs耐药;双药:20.9%对NRTIs和NNRTIs双药耐药;三药:1.5%对NRTIs、NNRTIs和PIs均耐药。
最常见的NNRTIs相关的突变是K103N(10.4%);最常见的NRTIs相关突变是M184V(13.4%);最常见的PIs相关的突变是I54V(1.5%),M46MI(1.5%)等;INs相关的突变是Q148R(2.4%),E157Q(2.4%)等。
7 NNRTI TDR流行率影响方案选择,当TDR>10%,就不能作为一线方案启动治疗
临床实践中应根据当地人群中HIV耐药特点等综合考虑制定ART方案。
WHO 2021:在NNRTI治疗前耐药流行率>10%的国家和地区应避免使用基于NNRTI的ART作为初始治疗方案。
中国NNRTI TDR流行率呈上升趋势,部分地区流行率已超过10%,若贸然使用基于NNRTI的ART,可能导致治疗效果不佳甚至治疗失败。
导致HIV耐药的三大因素
1 追本溯源防治耐药,共筑高耐药基因屏障:HIV耐药相关三大因素

2 病毒具有多态性、高变异性及高复制性
多态性:HIV本身存在较高的多态性、突变株多。
高变异性:病毒在反转录过程中错配率高,在每一轮复制中,每个基因组平均引入一个替换。病毒高复制性同样增加病毒变异性。高变异性增加耐药风险。
高复制性:HIV感染进入潜伏期后,病毒持续高水平复制,每天约有100亿病毒产生和清除,病毒复制过程复杂,需要多种药物作用多个位点抑制病毒。
3 耐药一旦发生不可逆转,耐药株会储存在病毒库中,且在药物选择压力下复现
4 作为最常见的NRTI耐药位点,M184V/I真实检出率可能被低估
无药物选择压力下血液中可检测到的M184V/I突变率将迅速下降,随着感染时间的延长,M184V/I的报道流行率仅为真实流行率的1/33。
两项前瞻性队列研究:纳入75例急性期/早期HIV感染的未治/初治患者,共检出195个基线耐药突变。根据预测,两年后携带M184V/I的毒株被野生株替代的比例将达到100%。
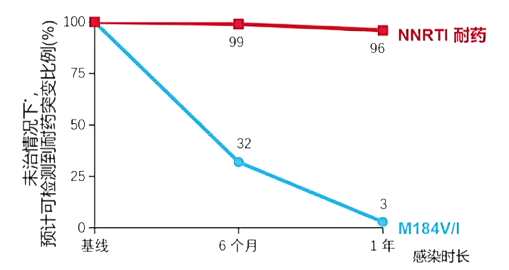
治疗亚洲耐药评估队列研究(TASER-S)模型预测:纳入2007-2010年间来自泰国、中国香港以及菲律宾多中心的458例近期HIV感染的未治/初治患者传播性耐药资料。
若血清转换后6个月行耐药检测:M184V/I报道流行率是真实流行率的1/3(1.1% vs. 3.4%)。
若血清转换后12个月行耐药检测:M184V/I报道流行率是真实流行率的1/33(1.1% vs. 36.4%)。
5 依从性不佳会增加耐药风险,研究显示长期治疗时依从性不佳更常发生
一项中国meta分析纳入40篇研究,共涉及11615例接受ART治疗的中国HIV感染者,探索抗病毒治疗的依从性。中国HIV感染者依从性不理想,治疗第3个月即出现大幅下降。
耐药管理和ART选择
1 指南推荐高耐药屏障方案,尤其在启动前未获得耐药检测结果的,要选择含二代INSTI或PI/b的三联方案

2 国际指南对基于NNRTI的治疗方案推荐次序下降
中国接受抗病毒治疗的HIV感染者中,95%曾使用或正在使用含NNRTI的免费ART。
DHHS指南自2015年开始,仅将基于NNRTI的方案(包括较新的DOR)推荐为备选方案,仅在特定条件下推荐使用。
不推荐首选NNRTI的主要考量:NNRTI耐药屏障较低,尤其在依从性不佳的患者中;EFV:中枢神经毒性不良反应发生率高,耐受度低;RPV:在高病载、低CD4细胞计数人群中疗效不佳。
EACS自2015年开始,仅将基于EFV的方案推荐为备选方案;在2020年也将基于RPV的方案从首选移至备选方案推荐;NNRTI方案中目前仅有基于DOR的方案被列为首选方案之一。
WHO自2019年开始,仅将基于EFV的方案推荐为备选方案;对于接受过NNRTI治疗的患者,应避免使用EFV。
3 我国NNRTI TDR大幅升高,启动前需耐药检测,但目前检测能力十分有限
耐药不是常规检测内容,在基层可及性低;现有耐药检测手段耗时耗力;耐药检测价格昂贵;难以向偏远地区推广;患者多需自行前往定点医院进行耐药检测。
4 NNRTI方案有诸多依从性挑战
多片剂方案:中国现有的基于NNRTI的ART方案基本为多片剂方案(MTR),相比单一片剂方案(STR),MTR使用者依从性更低,中断治疗风险升高60%。
不良事件风险高:一项中国前瞻性研究:接受EFV+TDF+3TC方案治疗者99.6%至少出现一次不良事件,以神经系统不良事件(95.6%)最为常见。
BIC的解离半衰期较长,对INSTI耐药突变株也具有较强的抗病毒效力,解离半衰期越长,预示抗病毒活性越强,耐药屏障可能越高。
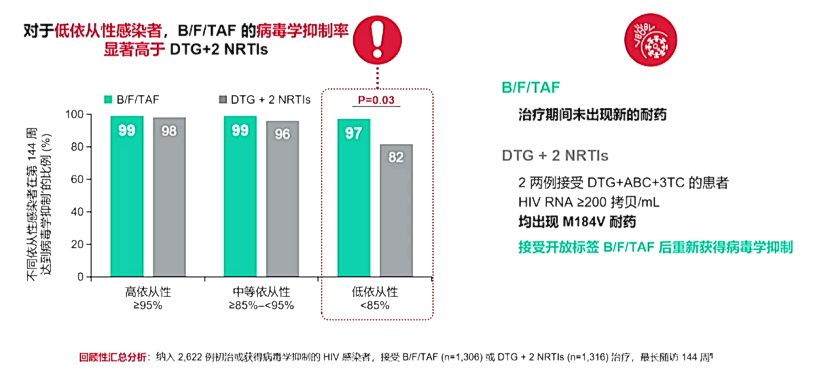
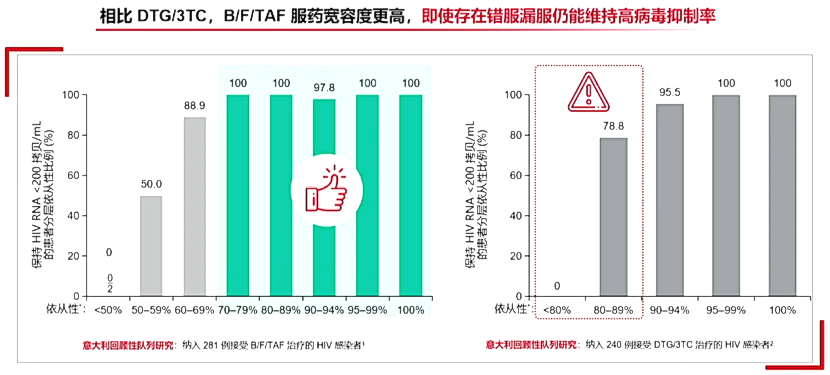
5 依从性欠佳的患者中,B/F/TAF的病毒学抑制率显著高于DTG+2 NRTIS
6 真实世界中B/F/TAF也有更高的服药宽容度,偶尔漏服仍维持100%病毒学抑制
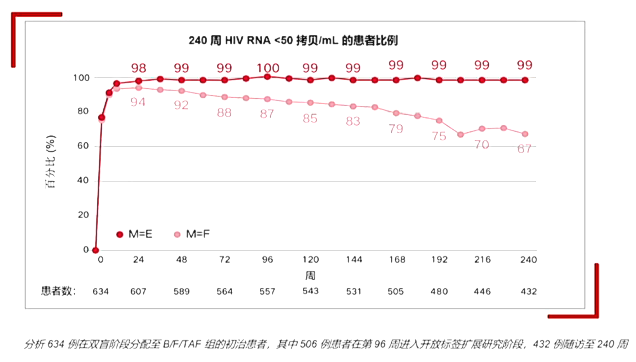
7 B/F/TAF 5年病毒学抑制率高达99%,未见治疗相关耐药
总结
关注HIV耐药流行趋势及危害
TDR对初始ART方案选择带来挑战,其中NNRTI TDR流行率逐年升高,M184V/I真实流行率被低估。
耐药是HIV防控的重要威胁,各大指南均推荐治疗前耐药检测,但我国耐药检测可及性低,不同的检测技术也存在局限。
耐药相关的三大因素
HIV耐药由多重因素导致,包括病毒因素、依从性不佳和ART耐药屏障低。
耐药管理和ART选择
中国常用的免费ART,如基于EFV等NNRT的方案,存在耐药屏障低、疗效不佳、患者依从性低等问题,在国际指南中推荐力度低。
DTG/3TC二联方案使用限制多,基线耐药情况不明的患者不推荐使用。
▼指南推荐高耐药屏障方案启动抗病毒治疗,如BIC/FTC/TAF:
耐药屏障高、半衰期长、结构优化、交叉耐药少、与FTC和TAF协同作用强。
真实世界BIC/FTC/TAF服药宽容度高,即使存在错服漏服仍能维持高病毒抑制率。
III期临床研究及大型真实世界研究BICSTaR均证实BIC/FTC/TAF病毒学抑制率高,治疗相关0耐药。


