女性不孕不育与自身抗体(综述摘译)
时间:2021-12-10 10:01:40 热度:37.1℃ 作者:网络
摘译自:Alban Deroux, Chantal Dumestre-Perard, Camille Dunand-Faure et al. Female Infertility and Serum Auto-antibodies: Systematic Review. Clinic Rev Allerg Immunol 2017; 53:78-86.
研究背景
不孕不育患者中,约10%的病因不明,在这些病例中自身免疫性疾病(如:系统性红斑狼疮、抗磷脂综合征等)占有一定比例。在过去的20年,对于不满足临床或生物学标准的不孕女性,如果血液样本中自身抗体阳性则被定义为特殊的自身免疫。这种自身免疫的直接发病机制目前尚不清楚,但在不明原因的原发或继发不孕不育的情况下使用免疫调节剂,可能利于生育。该研究以MESH(Medical Subject Headings,医学主题词表)中的 “不孕不育 ”“自身免疫 ”“生殖技术 ”“辅助生殖”“体外受精”等作为关键词,进行系统搜索,同时保留临床和生理病理学研究,这些研究适用于临床医生对与女性血清自身抗体相关的不孕症进行联合治疗。
研究方法
使用MESH检索词:“auto-immunity” “infertility” “reproductive technique” “in vitrofertilization” “assisted reproduction” “autoimmunity”通过PUBMED对文献进行回顾。保留临床和生理病理研究,剔除荟萃分析和综述(以避免重复);排除18岁以下的女性患者;保留队列设计相关研究;排除明确诊断自身免疫疾病和自体免疫伴反复流产的研究;排除男性不育的研究。
数据汇总
按照上述方法得到163篇文献,经过进一步筛选,最终得到符合要求的文献60篇。排除标准见图1,部分数据汇总见表1。
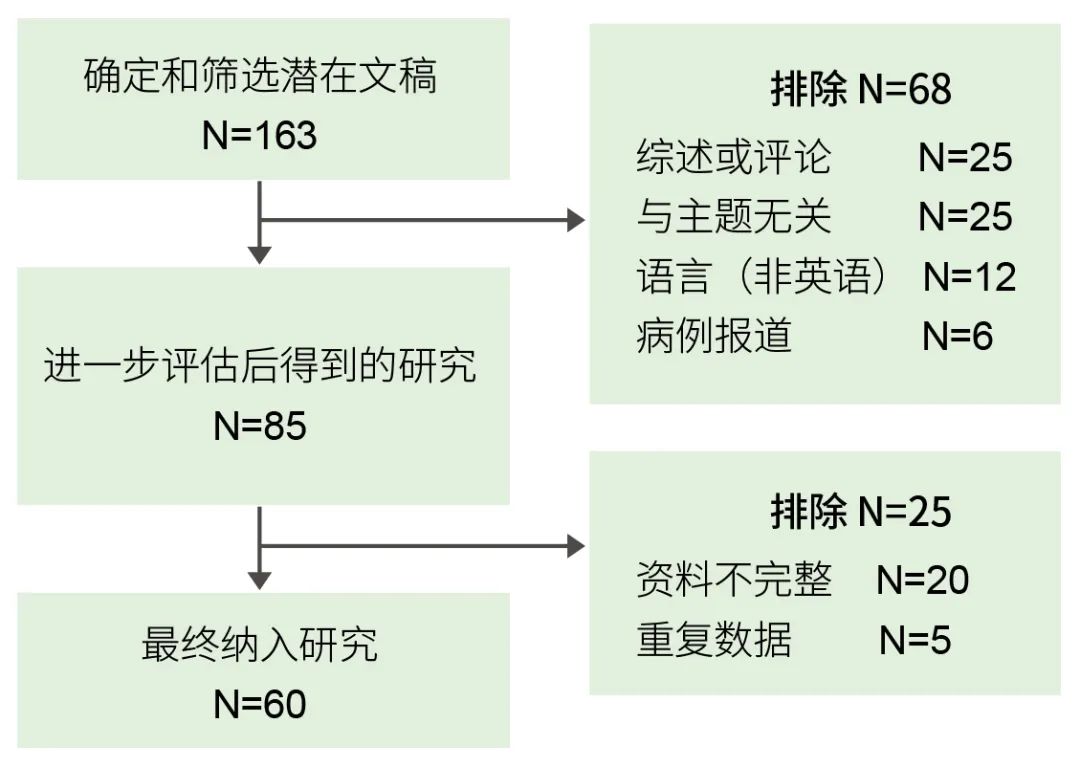
图1 研究入组排除标准图
N为研究数量
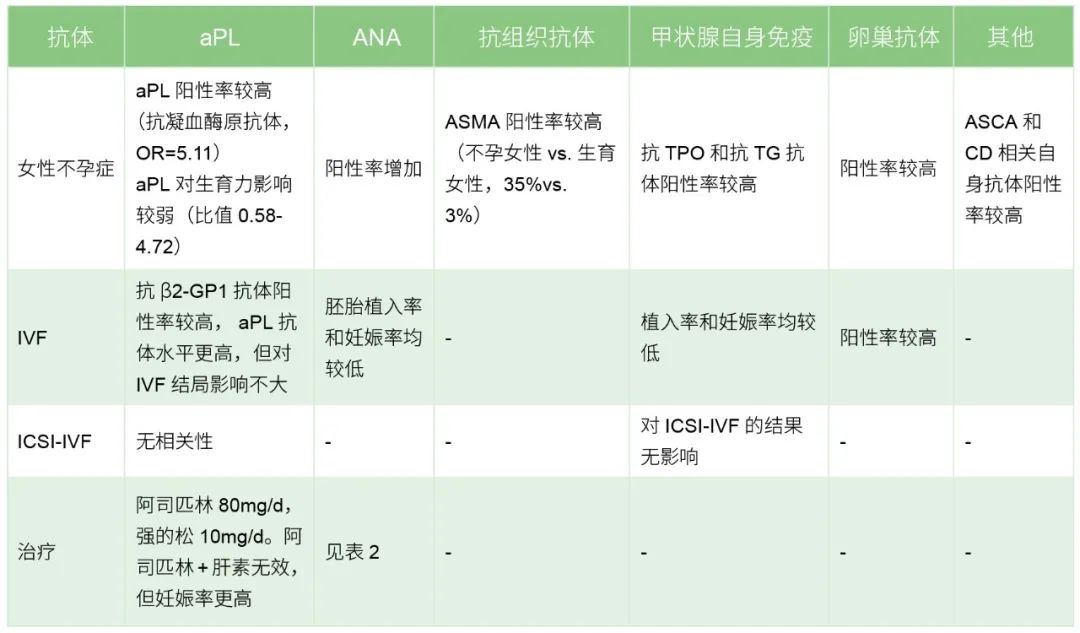
表1 不孕症、IVF或ICSI-IVF中,
血清自身抗体可用数据总结及治疗建议
注:aPL为抗磷脂抗体,ANA为抗核抗体,ASCA为抗小肠杯状细胞抗体,TPO为甲状腺过氧化物酶,TG为甲状腺球蛋白,CD为乳糜泻,IVF为体外受精,ICSI-IVF为卵胞浆内单精子显微注射技术,"—”为基于目前数据,未得出结果
1. 抗磷脂抗体(aPL)
根据1999年于札幌建立的抗磷脂综合征诊断标准,诊断产科抗磷脂综合征(OB-APS),需至少同时符合以下临床标准和实验室标准各一项。临床标准包括:至少1次不明原因的胎龄≥ 10周的胎儿死亡;或≥ 3次孕10周内不明原因自然流产;或≥ 1次孕34周前早产。实验室标准包括:间隔至少12周的免疫指标阳性(狼疮抗凝物/抗心磷脂抗体/抗β2-GP1抗体,抗β2- GP1抗体通过标准化ELISA检测)。在不满足以上标准的情况下,无法诊断产科抗磷脂综合征。
2006年,在一项对69名不孕女性与120名生育女性的队列研究中,发现不孕女性aPL的阳性率显著高于生育女性,特别是抗凝血酶原抗体(OR值5.11,阳性率分别为12%和2%,p<0.05)[1]。然而,大多数研究关注的是aPL在接受辅助生殖(AMP),尤其是接受体外受精(IVF)的不孕女性中的阳性率。一项对2053名因不孕而接受体外受精的女性进行的荟萃分析显示,其中703位(34%)女性血清aPL(抗心磷脂抗体或抗β2-GP1抗体)水平升高,但未发现aPL与体外受精结局之间存在关联[2]。2014年,一个法国研究小组发现,与一组有生育能力的女性相比,需要接受体外受精的不孕女性aPL水平增加(20%,p<0.0005),主要为抗β2-GP1抗体。尽管如此,胚胎植入的成功率和必要的体外受精次数似乎并无区别[3]。因此,与流产相反,aPL在体外受精中的作用依然存在争议。在2008年的一篇综述中,Cervera等人[4]报道了aPL阳性与aPL阴性患者的妊娠率比值在0.58~4.72之间,表明aPL对生育能力的影响较弱。
现在已证实aPL能识别合胞体滋养层的表面抗原。即使在无肉眼可见的血栓形成情况下,它们也是导致该结构发生功能障碍前受损的来源,而这一结构对妊娠的正常进行至关重要。
Kutteh等人[5]发现191例不孕症患者中aPL阳性率为18.8%。在36例aPL阳性的患者中,19例接受阿司匹林联合肝素治疗,妊娠率为52.6%;17例未经治疗的妊娠率为47%(无显著差异)。最大的治疗系列[6]发现,每天两次皮下肝素(5000 UI)注射与阿司匹林80mg/d治疗后,妊娠率显著升高(49%vs.16%,p < 0.05)。
根据札幌标准,与抗磷脂综合征的产科治疗相类似[7],低剂量阿司匹林联合肝素将是首选治疗方案。同样,如Mekinian等人[8]对宫内死胎和流产等的研究表明,羟氯喹(6mg/kg.d)可作为APS不孕女性的一种简单而有效的治疗方法。尽管aPL阳性率调查的结果相互矛盾,但生理病理学研究仍然表明aPL在不孕症病因中起到一定作用。
2. 非特异性抗核抗体(ANA)
血清非特异性ANA阳性是指ANA免疫荧光筛查为阳性,而通过其他靶抗原检测方法学(ELISA、Blot)未检测到任何确定的靶抗原,同时也缺乏确定疾病(SLE、SS、SSc等)的标准。
在1975年的一个系列研究中发现,与健康对照组相比,有卵巢早衰症状的女性ANA阳性率更高(阳性率分别为3%和20%,p<0.05)[9],同时有更多的研究也证实了这一结论(不孕女性ANA阳性率10%~20%,健康对照组为3%~4%)[10,11]。北美的一项研究显示,不孕不育症患者ANA阳性率与生育率呈负相关(OR=2.0,p=0.001) [12]。雌激素治疗(口服避孕药)不会改变ANA的阳性率。
一项更有趣的研究[13]调查了2012年至2014年接受IVF治疗的517名不孕女性,发现相较于对照组,IVF组血清ANA水平更高(39.45% vs.16.13%,p <0.001);ANA阳性患者相较于ANA阴性患者,其植入率(16.09% vs. 27.03%,p < 0.001)和临床妊娠率(27.72% vs.45.03%,p < 0.001)均较低,其水平取决于ANA滴度(1/100 vs. 1/320)。
多项治疗性研究总结见表2。强的松和阿司匹林的治疗并未降低抗核抗体的水平,且在治疗过程中观察到抗体水平的变化与体外受精的预后无关。
尽管皮质激素的作用太弱而不能降低抗体滴度,但其作用可归因为其他机制(如抗炎作用或减少子宫内膜自然杀伤细胞的数量)。同样,小剂量阿司匹林的抗血栓作用可以降低子宫和卵巢的血管阻力,提高卵母细胞的成熟和着床率。
与体外受精相关的一些回顾性研究显示,ANA阳性的女性,其胚胎植入率及妊娠率均明显降低。也有研究报告血清ANA水平与生育率之间存在正相关,然而该结论尚未在其他研究中得到证实。
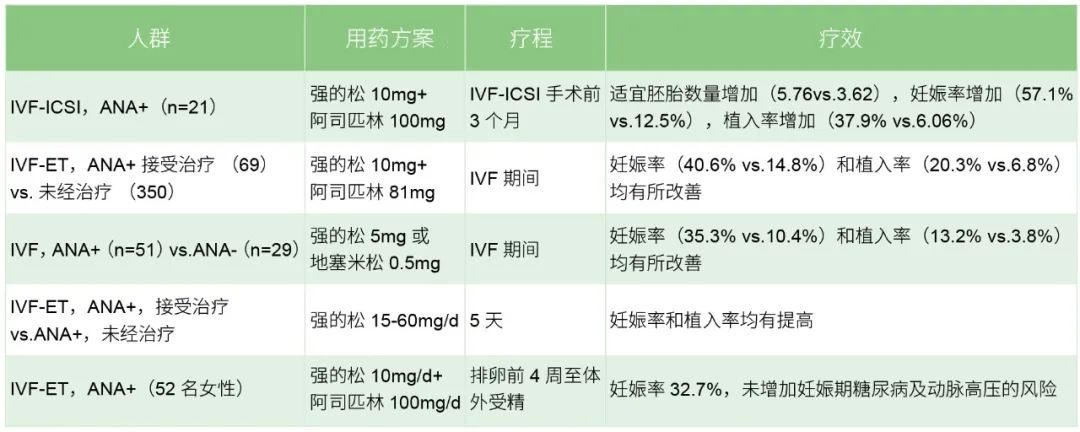
表2 ANA阳性不孕女性的治疗情况汇总
注:IVF为体外受精,ET为胚胎移植,IVF-ICSI为卵胞浆内单精子注射技术
3. 组织相关抗体
1975年的系列研究[9]显示,与健康对照组相比,不孕不育女性血清抗平滑肌抗体(ASMA)阳性率增高,但除了不孕不育外,无任何特殊的临床意义(35% vs. 3%,p<0.05)。同时,在2001年的一项研究[11]中亦得到类似的数据(27.8% vs. 5.1%,p<0.05),在该系列研究中,抗胃壁细胞抗体和抗线粒体抗体的水平也显示异常。然而据我们所知,尽管患病率升高,尚未进行治疗性研究。
4. 甲状腺自身免疫
患病率调查支持甲状腺自身免疫与不孕不育症之间存在关联,但目前尚无证据表明两者之间存在因果关系。患有自身免疫性甲状腺功能障碍的女性,其不孕不育患病率高达47%(Grave’s disease,Grave’s病)和52%(Hashimoto disease,桥本氏病)[14],然而这些高患病率尚未在其他研究中得到证实。不孕不育人群抗TPO抗体和抗TG抗体阳性率约为16%,其中抗TPO抗体阳性占5%,抗TG抗体阳性占4%,约8%的病例表现为双阳[15]。
2012年,一项关于676名不孕不育女性的队列研究中发现,相比甲状腺抗体阴性的女性,甲状腺抗体阳性的女性(90名)在受精、着床和妊娠方面的成功率都较低(64.3% vs.74.6%;17.8% vs. 27.1 %;33.3% vs.46.7 %)[16]。而在另一项研究中,抗TPO抗体和抗TG抗体阳性,但甲状腺功能正常的女性(835名),接受IVF-ICSI的结局与健康对照组相比无显著差异[17]。
Monteleone等人首次关于在卵巢卵泡中检测到抗甲状腺抗体的研究显示,甲状腺自身免疫似乎不会影响辅助生殖的结果,但对于甲状腺自身免疫的不孕女性,相较于传统的体外受精,IVF-ICSI可能是首选的辅助生殖方法[18]。因此,如果甲状腺激素对卵母细胞的成熟和月经周期至关重要,那么关于抗甲状腺抗体的不良作用则需投入更多的研究。几项流行病学[1,19]研究似乎支持这一明确作用,就像对小鼠进行的研究一样[20]。这些自身抗体更多的存在于卵巢功能早衰、Addison病、子宫内膜异位症或多囊卵巢综合征患者。
5. 卵巢和肾上腺免疫
卵巢早衰是指女性在40岁之前可获取的卵母细胞数量不足。除了感染或医源性原因外,还有上世纪90年代提出的自身免疫病因学,主要描述了患卵巢早衰女性体内的抗卵巢自身抗体、卵巢T淋巴细胞CD4+和CD8+、浆细胞和巨噬细胞浸润现象。在该人群中,ANA阳性率有所增加(10.5% vs.3.3%),同时伴有抗甲状腺抗体以及产生针对类固醇激素分泌细胞(肾上腺皮质、胎盘、卵巢等)的血清抗体[21]。抗卵巢抗体有几个公认的靶点,特别是卵浆、透明带(5.6%患有早期卵巢功能不全的女性可识别该靶点)、颗粒细胞和3β-羟基促性腺激素脱氢酶受体,这些靶点可能与体外受精的预后有关。在2004年一项关于爱迪森病(Addison's disease,一种自身免疫性肾上腺功能不全病)的研究中发现,在约60%患有卵巢早衰的女性体内,存在针对多种类固醇分泌细胞的抗体[22]。这可能有助于理解与卵巢相关的自身免疫在原发性卵巢自身免疫相关不孕女性亚群中的作用。虽然这些自身抗体检测目前尚未得到验证,但在甲状腺、肾上腺自身免疫和自身免疫内分泌疾病的背景下,将非常有趣。
6. 子宫内膜和滋养层自身免疫
Berkkanoglu等人的研究发现,子宫内膜异位症与器官特异性自身免疫之间存在显著的统计学关联[23]。对于子宫内膜异位症,靶抗原主要是子宫内膜、内皮或甲状腺抗原,更常见的是1型昆布氨酸,该蛋白在胚胎植入和器官发育的早期阶段干预细胞分化和内环境平衡。有趣的是,这些数据提示了子宫内膜异位症女性不孕的另一个原因。Seery[24]认为,炎症环境中凋亡的子宫内膜细胞清除的减少,可能是有自身免疫疾病遗传倾向女性体内自身抗体产生的源头。然而,目前还没有证据证明这些自身抗体的有害性。
7. 乳糜泻相关自身抗体
一项荟萃分析发现,不明原因不孕女性,其乳糜泻(CD)患病率高于一般人群(OR=5.06,2.13-11.35)[25]。Machado等[26]发现,10.3%的不明原因不孕女性的血清抗体(IgA型抗谷氨酰胺转胺酶或TG,肌内膜抗体)呈阳性,而缺乏CD的临床和组织学标准(亚临床CD),而在另一项研究中该比例为5.65%(对照组1.30%,有统计学差异)[27]。不育症的发病机制不仅与CD的吸收不良和营养缺乏有关,也与自身免疫机制有关。体外研究提出了胎盘损伤致病模型:抗TG抗体与滋养层细胞直接结合,并通过凋亡损伤来降低滋养层的侵袭力(滋养层细胞所具有的类似于肿瘤细胞迁移和浸润的能力)[28];此外,在小鼠体内模型中证实,内皮细胞上的抗TG抗体不利于子宫内膜血管生成[29]。TG可在子宫内膜细胞、间质和胎盘滋养层细胞中表达,因此它可能是乳糜泻孕妇自身抗体的一个靶点。
8. 其他血清自身抗体
Shoenfeld等[1]报道的一项流行病学研究发现在慢性炎症性肠道疾病中存在分离的和特异的高滴度抗酿酒酵母抗体(ASCA),在269名不孕妇女中OR为3.9。然而,这一结果在不孕不育领域中并未被重现。
04
结论
自身免疫性不孕症常与其他自身免疫疾病并存,常以生殖所必需的重要组织发生免疫介导损伤为特点。引起女性不孕症的自身免疫疾病与原发性卵巢功能不全(多囊性卵巢综合症)、卵巢早衰以及较为鲜见的自身免疫性卵巢炎等疾病有关。引起男性不育症的原发性自身免疫疾病主要包括原发性性腺功能低下和自身免疫性睾丸炎。关于这种自身免疫的直接发病机制目前尚不清楚,但针对不明原因的原发或继发不孕不育,使用免疫调节剂,可能有利于生育。与这些疾病相关的自身抗体,目前可以通过血清学方法进行检测。
相比健康女性,有生育障碍的女性其血清中某些自身抗体的阳性率相对较高。然而,应检测哪些自身抗体以及何时进行检测的问题仍需要更多的研究和案例支持。不同研究和实验室检测抗体(如aPL、ANA等)的相关论文亦需要同质化,以减小偏倚。同样,该综述也存在纳入研究时间早、样本数量少,以及存在不一致甚至矛盾数据的情况。因此在多中心、前瞻性和随机研究得出结论之前,还需要更多临床前和观察性的研究。在目前的知识状态下,开展自身免疫评估似乎很有意思(表3),正如Zhu等人在2013年所提出[30]。针对不明原因不孕或继发性不孕的女性群体也应获得更多的关注。
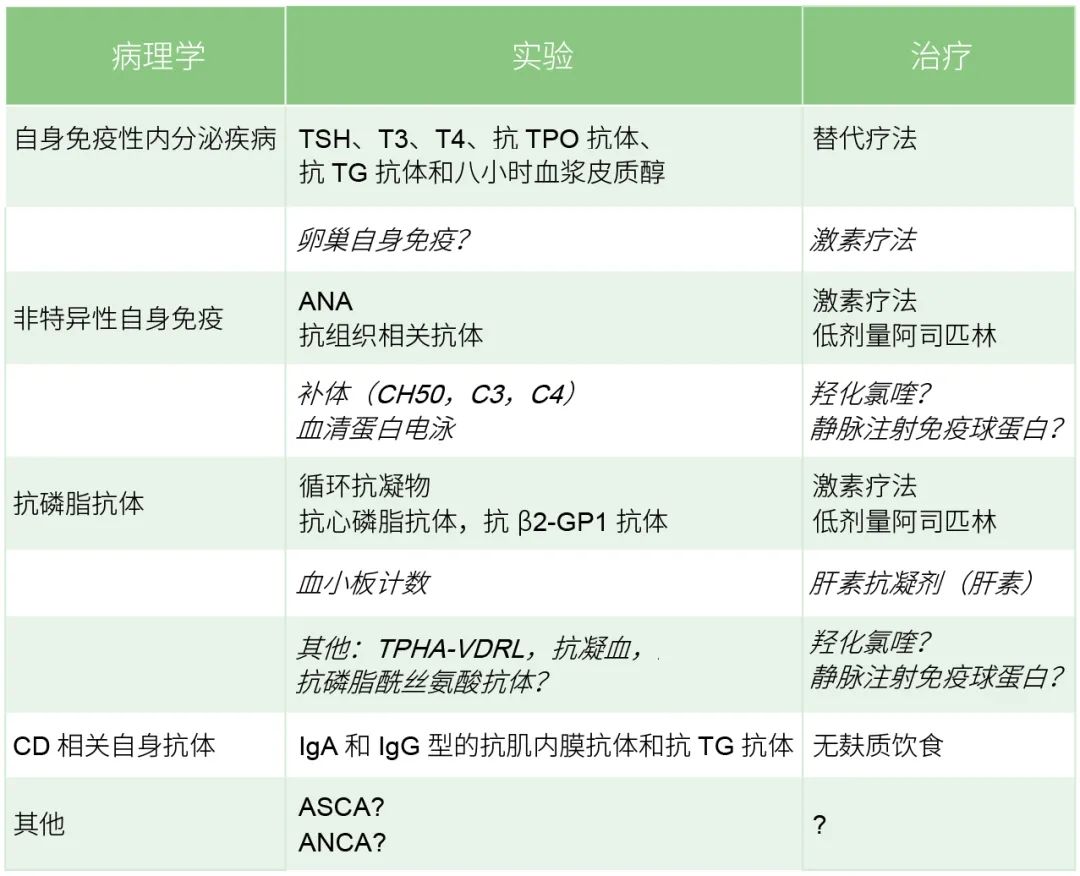
表3 为接受ART项目的不孕女性提出的
简化版自身免疫检测
注:ART为辅助生殖技术,TSH为促甲状腺素激素,T3为三碘甲状腺原氨酸,T4为甲状腺素。
斜体表示的推荐尚未被证明。
参考文献:
Shoenfeld Y, Carp HJ, Molina V et al. Autoantibodies and prediction of reproductive failure. Am J Reprod Immunol 2006; 56:337-344.
Hornstein MD, Davis OK, Massey JB et al. Antiphospholipid antibodies and in vitro fertilization success:a meta-analysis. Fertil Steril 2000; 73:330-333.
Paulmeyer-Lacrois O, Despierres L, Courbiere B et al. Antiphospholipid antibodies in women undergoing in vitro fertilization treatment: clinical value of IgA anti-β2glycoprotein I antibodies determination. BioMed Res Int 2014; 314704.
Cervera R, Balasch J. Bidirectional effects on autoimmunity and reproduction. Hum Reprod Update 2008; 14:359-366.
Kutteh WH, Yetman DL, Chantiles SJ et al. Effect of antiphospholipid antibodies in women undergoing in vitro fertilization:role of heparin and aspirin. Hum Reprod 1997; 12:1171-1175.
Sher G, Feinman M, Zouves C et al. High fecundity rates following antiphospholipid antibody seropositive women treated with heparin and aspirin. Hum Reprod 1994; 9:2278-2283.
Kovacs M, Hartwig M, Aleksza M at al. Antiphospholipid antibodies in relation to sterility/ infertility. Hum Immunol 2012; 73:726-731.
Mekinian A, Lazzaroni MG, Kuzenkoc A et al. The efficacy of hydroxychloroquine for obstetrical outcome in anti-phospholipid syndrome: data from a European multicenter retrospective study. Autoimmun Rev 2015; 14:498-502.
Wilson C, Eade OE, Elstein M et al. Smoothmuscle antibodies in infertility. Lancet 1975; 2:238-239.
Taylor PV, Campbell JM, Scott JS. Presence of autoantibodies in women with unexplained infertility. Am J Obstet Gynecol 1989; 161:377-379.
Reimand K, Talja I, Metskula K et al. Autoantibody studies of female patients with reproductive failure. J Reprod Immunol 2001; 51:167-176.
Parks CG, Miller FW, Satoh M et al. Reproductive and hormonal risk factors for antinuclear antibodies (ANA) in a representative sample of U.S. women. Cancer Epidemiol Biomarkers Prev 2014; 23:2492-2502.
Li Y, Wang Y, Ma Y, Lan Y, Jia C, Liang Y, Wang S (2015) Investigation of the impact of antinuclear antibody on the outcome of in vitro fertilization/intracytoplasmic sperm injection treatment.Taiwan J Obstet Gynecol 54:742–748.
Quintino-Moro A, Zantut-Wittmann DE et al. High prevalence of infertility among women with Graves' disease and Hashimoto's thyroiditis. Int J Endocrinol 2014:982705.
Unuane D, Velkeniers B, et al. Thyroglobulin autoantibodies: is there any added value in the detection of thyroid autoimmunity in women consulting for fertility treatment? Thyroid 2013; 23:1022-1028.
Zhong YP, Ying Y, Wu HT et al. Relationship between antithyroid antibody and pregnancy outcome following in vitro fertilization and embryo transfer. Int J Med Sci 2012; 9:121-125.
Tan S, Dieterle S et al. Thyroid autoantibodies per se do not impair intracytoplasmic sperm injection outcome in euthyroid healthy women. Eur J Endocrinol 2014; 170:495-500.
Monteleone P, Parrini D et al. Female infertility related to thyroid autoimmunity: the ovarian follicle hypothesis.AmJ Reprod Immunol 2011; 66:108-114.
Matalon ST, Blank M, Ornoy A, Shoenfeld Y. The association between antithyroid antibodies and pregnancy loss. Am J Reprod Immunol 2001; 45:72-77.
Matalon ST, Blank M, Levy Y et al. The pathogenic role of antithyroglobulin antibody on pregnancy: evidence from an active immunization model in mice. Hum Reprod 2003; 18:1094-1099.
Blumenfeld Z, Halachmi S et al. Premature ovarian failure. The prognostic application of autoimmunity on conception after ovulation induction. Fertil Steril 1993; 59:750-755.
Forges T, Monnier-Barbarino P, Faure GC et al. Autoimmunity and antigenic targets in ovarian pathology. Hum Reprod Update 2004; 10:163-175.
Berkkanoglu M, Arici A. Immunology and endometriosis.Am J Reprod Immunol 2003; 50:48-59.
Seery JP. Endometriosis associated with defective handling of apoptotic cells in the female genital tract is a major cause of autoimmune disease in women. Med Hypotheses 2006; 66:945-949.
Tersigni C, Castellani R, De Waure C et al. Celiac disease and reproductive disorders: meta-analysis of epidemiologic associations and potential pathogenic mechanisms. Hum Reprod 2014; 20:582-593.
Machado AP, Silva LR, Zausner B et al. Undiagnosed celiac disease in women with infertility.J Reprod Med 2013; 58:61-66.
Kumar A, Meena M, Begum N et al. Latent celiac disease in reproductive performance of women. Fertil Steril 2011; 95:922-927.
Robinson NJ, Glazier JD, Greenwood SL et al. Tissue transglutaminase expression and activity in placenta.Placenta 2006; 27:148-157.
Di Simone N, Silano M, Castellani R et al. Anti-tissue transglutaminase antibodies from celiac patients are responsible for trophoblast damage via apoptosis in vitro. Am J Gastroenterol 2010; 105:2254-2261.
Zhu Q, Wu L, Xu B et al. A retrospective study on IVF/ICSI outcome in patients with antinuclear antibodies: the effects of prednisone plus low-dose aspirin adjuvant treatment. Reprod Biol Endocrinol 2013; 11:98.


