【衡道丨病例】病理诊断——具有恶性潜能的肺乳头状腺瘤
时间:2025-02-08 12:09:39 热度:37.1℃ 作者:网络
临床资料
患者,男性,66岁,2022年10月体检胸部CT发现右肺下叶后段可见高密度结节影(图1 ),大小约1.7cm×1.0cm×1.2cm,边缘毛糙,完善所有常规检查后,建议手术切除。
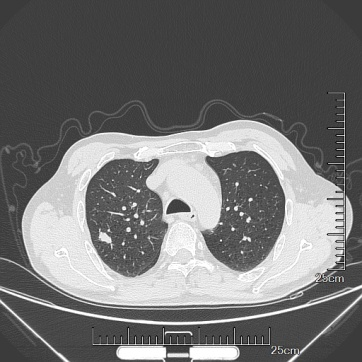
图1 肺乳头状腺瘤患者胸部CT检查
大体检查
术中快速冰冻大体观察,送检楔形切除肺组织一块,大小8 cm×2.5 cm×1.5cm,系线处见一肿块,大小1.5 cm×1.3 cm×1.2cm,紧邻胸膜,无明显包膜,切面灰白色,质稍硬,边界不清,未见钙化和囊性变,但有明显出血。
镜下所示
冰冻切片光学显微镜下观察:
肿瘤与周围边界不清,肺泡上皮增生显著,大量炎细胞浸润,可见腺管样结构和大量裂隙及乳头样结构,细胞有异型(图2A)。
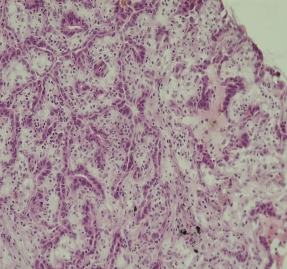
图2A 冰冻切片示肿瘤具有腺样、裂隙样结构区,细胞紧密排列,胞质透亮,中等大,胞核圆且有一定非典型性(肺乳头状腺瘤患者光学显微镜下观察结果 HEx200)
冰冻病理(右肺):
腺癌不能排除,待慢速(当时和手术大夫沟通,不再扩大手术范围,待慢速常规病理明确后进一步处理)。常规切片低倍镜下观察:肿瘤与周围肺组织界限不清楚,无明显纤维性包膜,肿瘤内可见大量炎细胞浸润,瘤组织主要表现为粗大乳头状(图2B)及腺样、裂隙样结构,高倍镜观察乳头示单层立方到柱状上皮细胞,细胞核圆形或卵圆形,细胞稍拥挤,有一定异型性,肿瘤周围未见肌上皮细胞包绕;乳头内间质疏松水肿,周围肺间质内纤维组织增生和血管增生扩张充血,其内可见大量炎细胞;腺样结构区示肺泡上皮细胞紧密排列,胞质透亮,中等大小,胞核圆且也有一定非典型性,局灶可见胞质偏嗜酸性的“合体样”细胞突向腺腔,可能是乳头状肺泡上皮向腔内反折所形成;乳头外肺组织表现间质水肿、疏松,内有大量成熟浆细胞浸润和少量嗜酸性Rusell小体混杂,并可见局灶胆固醇结晶及含铁血黄素沉积。
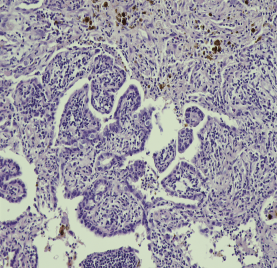
图2B 肿瘤由一级粗大乳头构成,被覆单层立方或柱状上皮,细胞核呈圆形或卵圆形,细胞排列稍拥挤,有一定异型性(肺乳头状腺瘤患者光学显微镜下观察结果 HEx200)
免疫组织化学染色结果:
CKpan、TTF-1(图3A)、Napsin A、细胞角蛋白CK7(图3B)、EMA(图3C)、均阳性,p63 、CK5/6 、p40均阴性,Ki-67阳性指数20%(图3D)。
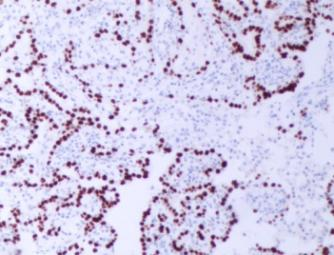
图3A TTF-1弥漫强阳性(肺乳头状腺瘤患者免疫组织化学结果 SP x200)

图3B CK7弥漫强阳性(肺乳头状腺瘤患者免疫组织化学结果 SP x200)
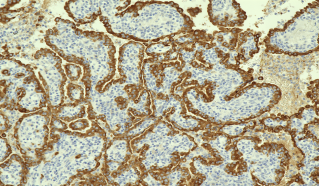
图3C EMA弥漫强阳性(肺乳头状腺瘤患者免疫组织化学结果 SP x200)
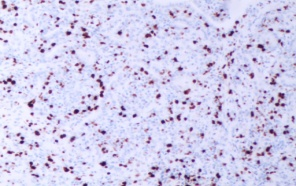
图3D Ki-67阳性指数20%(肺乳头状腺瘤患者免疫组织化学结果 SP x200)
最终诊断
病理诊断(右肺):HE结合免疫组织化学结果 ,符合肺乳头状腺瘤,但局部区域肺泡上皮细胞异型显著,倾向具有恶性潜能,建议密切随诊,如有条件建议行基因检测以明确有无突变。
讨论
肺乳头状腺瘤起源于具有双相分化的支气管肺泡上皮干细胞,超微结构证实由Ⅱ型肺泡细胞和克拉拉细胞(Club 细胞)组合构成,是极为罕见的良性肿瘤,具有恶变倾向的更为少见,目前已报道的具有恶变的病例仅10余例[1-2],需结合影像和病理特征谨慎诊断。肺乳头状腺瘤的肿瘤细胞通常无显著异型,缺乏有丝分裂且Ki-67增殖活性低。在世界卫生组织(WHO)第5版的呼吸系统肿瘤分类的ICD编码依然是0[3]。近年有文献报道其具有恶性潜能,会在血管和支气管内以及脑发生转移,故有学者建议对其命名应更正或新添加为恶性潜能不明的肺乳头状腺瘤[4]。
临床特征:
肺乳头状腺瘤发病年龄宽泛(2个月~80岁)均有报道[5],大多患者无临床表现,多在体检CT偶然发现,多表现为位于肺周边界限清楚的孤立的、类圆形肿块,增强扫描多显示轻度不均匀强化,部分病例可合并肺炎、支气管扩张和胸膜下间质纤维化。本例患者影像学显示为边缘毛糙的高密度结节,邻近胸膜有牵拉,故CT结果提示不排除恶性可能。
镜下特征:
冰冻切片光学显微镜示肿瘤细胞具有一定异型性,可见腺管样结构和大量裂隙及乳头样结构;常规切片示肿瘤与周围肺组织界限尚清,瘤组织主要表现为粗大乳头状及腺样结构;高倍镜观察乳头示单层立方到柱状上皮细胞,细胞核圆形或卵圆形,细胞稍拥挤,有一定异型性,但细胞异型度没有冰冻切片显著,其原因可能因为冰冻切片制作的局限性,即急速冷却可能导致细胞变形、结构扭曲以及技术员切片水平差异。但免疫组织化学结果显示Ki-67增殖指数20%与文献报道的良性肺乳头状腺瘤的低增殖不一致[6],故最终病理依据形态学和免疫组织化学的结果诊断符合肺乳头状腺瘤,但局部区域肺泡上皮细胞异型显著,倾向具有恶性潜能,建议密切随诊。
肺乳头状腺瘤的发病机制尚不明确,一些学者认为可能与肺部炎症刺激有关,一些学者认为可能与多能干细胞的分化有关[7-8],但乳头状腺瘤组织形态和生物学活性学总体偏向惰性。光学显微镜下乳头具有纤维血管轴心,分支少,缺乏三级结构,并可见立方或柱状的呼吸性上皮细胞围绕轴心排列,瘤细胞呈圆形、椭圆形,细胞质嗜酸性或透明,未见显著的核异型性。
免疫组化特征:
免疫组织化学结果:TTF-1、Napsin A、CK7、表面活性蛋白、EMA、广谱细胞角蛋白均阳性,p40、CK5/6、p63均阴性,Ki-67阳性指数20%。
分子遗传学特征:
总结已报道的肺乳头状腺瘤恶变病例,发现影像学均提示结节边缘粗糙;免疫组织化学提示Ki-67阳性指数15%~20%,且分子检测未发现EGFR、KRAS或BRAF突变[9]。
治疗和预后
肺乳头状腺瘤首选手术完整切除,术后无需辅助放疗或化疗,少见复发或转移,预后较好。我院这例因其细胞形态的异型性和Ki-67的高增殖率,认为其具有恶性潜能,且基因检测也未发现有突变,临床建议无需其他后续治疗,密切随诊即可。鉴于目前报道恶变的病例有限,缺乏大宗病例分析,恶变概率、危险因素以及是否需要进一步治疗有待深入研究。目前患者每隔半年复查一次,2023年4月随访时预后良好。综上所述,肺乳头状腺瘤大多数生物学行为良性,增殖活性低(不超过10%),而对于Ki-67指数高于10%的建议多学科治疗讨论,依据病理形态学和影像学特征等进行综合诊断。
鉴别诊断
1.肺乳头状腺癌:
肿瘤主要表现为乳头状生长模式、由复杂的二级、三级等多级分支乳头状结构构成,瘤细胞浸润性生长,围绕具有真纤维血管轴心单层或多层排列,偶尔乳头状结构会脱落并漂浮在肺泡腔内,细胞异型性显著,可见坏死,核分裂象易见,间质促纤维组织增生明显,与肺乳头状腺瘤鉴别关键主要在乳头状腺癌会表现更大程度的炎细胞浸润、细胞核的异型及浸润性生长。而肺乳头状腺瘤虽然具有乳头状簇,但瘤细胞表现温和,细胞核最多轻度异型,不会表现出核的多形性。
2.硬化性肺细胞瘤:
肿瘤在大体上与周围肺组织界限清楚,切面呈实性或海绵状,由表面立方细胞核间质圆形两种细胞以及乳头状、实性、出血、硬化四种结构构成,有时增生的肺泡上皮也会具有异型性,特别在取材局限时,两种细胞和四种结构不同时出现时会给诊断造成一定困难,但大多肺乳头状腺瘤具有包膜、缺乏硬化性间质,很少有泡沫组织细胞和含铁血黄素沉淀物且无血管瘤样增生和出血等特征,与经典的硬化性肺鉴别容易。而当肺乳头状腺瘤镜下结构是单一的、位于表面的一层立方/柱状上皮乳头结构,且有纤维血管核心时与硬化性肺细胞瘤极易混淆,尤其是在术中冰冻和穿刺活组织检查。因此多区域取材是病理精准诊断的保证,必要时利用免疫组织化学检查,并充分了解患者的临床资料、影像资料有助于鉴别。
3.肺泡性腺瘤:
此肿瘤通常具有包膜,以多个囊腔为特征,与周围肺组织界限分明,囊壁内衬典型的低立方/梭形的Ⅱ型肺泡细胞,内含颗粒状物质,间质多见炎细胞浸润,腔内可见嗜酸性蛋白液体积聚,整体缺乏乳头状结构,此特征是与乳头状腺瘤最大的差别。
4.细支气管腺瘤:
主要病变发生在细支气管外的肺实质内,虽病变与周围肺组织分界清楚,但未见有明显的纤维性的包膜,镜下肿瘤细胞常呈现乳头状/或沿肺泡壁(贴壁状、平坦型)生长,由分布在腔面的支气管型良性上皮(黏液细胞、纤毛细胞和clara细胞等),及腔外缘基底层细胞(p63、p40连续表达)的双层结构组成,免疫组织化学结果显示p40、p63、CK5/6连续阳性表达可帮助与其鉴别。
5.良性肺乳头状腺瘤:
一般细胞形态温和、无异型且Ki-67的增殖指数低,文献报道Ki-67的低增殖(10%以下)和EGFR的阴性表达的乳头状腺瘤,具有良性的生物学行为。
参考文献及书籍
[1] Dessy E, Braidotti P, Del Curto B, et al. Peripheral papillary tumor of type-II pneumocytes: a rare neoplasm of undetermined malignant potential[J]. Virchows Arch, 2000, 436(3):289-295. DOI: 10.1007/s004280050043
[2] 王凤华, 李宁, 杨江辉. 肺乳头状腺瘤临床病理观察[J]. 现代肿瘤医学, 2011, 19(1):58-60. DOI: 10.3969/j.issn.1672-4992.2011.01.020.
[3] WHO Classification of Tumours Editorial Board. WHO classification of tumours. Thoracic tumours[M]. 5th ed. Lyon: IARC Press, 2021.
[4] 张著学, 龙艳丽, 洪琴, 等. 肺乳头状腺瘤1例临床病理观察[J]. 贵州医药, 2015, 39(12):1084-1086. DOI: 10.3969/j.ISSN.1000-744X.2015.12.010.
[5] 邓娟, 刘显旺, 薛彩强, 等. 肺乳头状腺1例[J].中国医学影像技术,2020, 36(1):31-32.
[6] Lin XY, Wang Y, Fan CF, et al. Pulmonary sclerosing hemangioma presenting with dense spindle stroma cells: a potential diagnostic pitfall[J]. Diagn Pathol, 2012, 7:174. DOI: 10.1186/1746-1596-7-174.
[7] Available N. Pathology and genetics of tumours of the lung, pleura, thymus and heart (IARC/World Health Organization Classification of Tumours)[J].Intl Agency for Research on Cancer, 2015.
[8] WohlschlägerJ, Welter S, Stamatis G, et al. Glanduläres papillom des rechten hauptbronchus : nachweis einer exon-2-mutation des KRAS-Gens (c.35G>A) (Kasuistiken) = glandular papilloma of the right main bronchus : detection of an exon 2 mutation of the KRAS gene (c.35G>A) (Kasuistiken)[J].Der Pathologe,2013,34(4):338- 342.DOI:10.1007/s00292-012-1725-2.
[9] Ma HF, Wang YL, Chen P, et al. Pulmonary papillary adenoma with malignant transformation: report of one case and review of the literature[J]. Int J Clin Exp Pathol, 2020, 13(4):792-798.


