【论著】| 5-氨基酮戊酸光动力治疗Olsen 3级日光性角化病的疗效评估及影响因素分析
时间:2025-01-25 12:08:45 热度:37.1℃ 作者:网络
[摘要] 背景与目的:日光性角化病(actinic keratosis,AK)是具有皮肤鳞状细胞癌发展潜力的癌前病变,5-氨基酮戊酸光动力疗法(5-aminolevulinic acid photodynamic therapy,ALA-PDT)因其清除率高和美容无创的优势,已成为治疗AK的新选择,但其对以角化过度为特征的Olsen 3级AK病变的疗效仍存在争议。本研究旨在探讨ALA-PDT治疗Olsen 3级AK的疗效、安全性及影响疗效的因素。方法:对2020年1月—2023年7月在复旦大学附属华山医院皮肤科就诊的Olsen 3级AK患者进行连续4次ALA-PDT治疗,并随访至治疗后1年(伦理审批号:2019-491)。所有患者符合入组标准及排除标准。通过治疗后3个月的初始完全清除(initial complete clearance,ICC)和治疗后12个月的持续完全清除(sustained complete clearance,SCC)来评估疗效。同时收集患者治疗前的临床及病理学特征,采用单因素和多因素逻辑回归分析探讨Olsen 3级AK患者ALA-PDT治疗失败的危险因素,通过亚组分析进一步探索导致治疗抵抗和复发的危险因素。本临床试验在中国临床试验注册中心注册(注册号:ChiCTR1800019213)。本研究严格遵循《加强流行病学中观察性研究报告质量》(Strengthening the Reporting of Observational Studies in Epidemiology,STROBE)指南中的各项条目。结果:共有38例患者纳入本项研究,其中病例组8例,对照组29例,1例患者在治疗后6个月失访。治疗后3个月,86.84%的患者达到ICC(33/38),随访至12个月,87.88%达到ICC的患者维持SCC(29/33),治疗及随访期间无严重不良反应发生。多因素逻辑回归分析表明,病灶位于多个解剖亚单位是ALA-PDT治疗失败的独立危险因素(P=0.02,OR=28.43),亚组分析证实该因素与治疗抵抗相关(P=0.03,OR=97.54)。结论:ALA-PDT对Olsen 3级AK患者疗效良好且安全性高,为该类患者提供了一种无创的治疗选择。然而,病灶位于多个解剖亚单位的患者更容易出现治疗失败,提示对此类患者的治疗应提高警惕。
[关键词] 日光性角化病;Olsen分级;5-氨基酮戊酸;光动力疗法;治疗抵抗;复发
[Abstract] Background and purpose: Actinic keratosis (AK) is a precancerous condition with the potential to develop into cutaneous squamous cell carcinoma. 5-Aminolevulinic acid photodynamic therapy (ALA-PDT) has emerged as a new treatment option for AK due to its high clearance rates and non-invasive cosmetic advantages. However, its efficacy in treating Olsen grade 3 AK, characterized by hyperkeratosis, remains controversial. This study aimed to investigate the efficacy and safety of ALA-PDT in treating Olsen grade 3 AK and to identify factors influencing treatment outcomes. Methods: A total of 38 patients with Olsen grade 3 AK who visited the Department of Dermatology, Huashan Hospital, Fudan University, between January 2020 and July 2023 underwent four consecutive sessions of ALA-PDT and were followed up for one year post-treatment (ethics number: 2019-491). All patients met the inclusion and exclusion criteria. Treatment efficacy was assessed by the initial complete clearance (ICC) at 3 months and the sustained complete clearance (SCC) at 12 months after treatment. Baseline clinical and pathological characteristics were collected. Univariate and multivariate logistic regression analyses were performed to explore risk factors for treatment failure in Olsen grade 3 AK patients receiving ALA-PDT. Subgroup analyses were conducted to further investigate risk factors associated with treatment resistance and recurrence. This study was registered on Chinese Clinical Trial Registry (chiCTR1800019213). The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) checklist was followed for this study. Results: A total of 38 patients were included in this study, including 8 in the case group and 29 in the control group. One patient was lost to follow-up 6 months after treatment. At 3 months post-treatment, 86.84% of patients achieved ICC (33/38). At the 12-month follow-up, 87.88% of the patients who achieved ICC maintained SCC (29/33). No serious adverse reactions were reported during treatment and follow-up. Multivariate logistic regression analysis indicated that lesions located in multiple anatomical subunits was an independent risk factor for treatment failure (P=0.02, OR=28.43). Subgroup analysis confirmed that this factor was independently associated with treatment resistance (P=0.03, OR=97.54). Conclusion: ALA-PDT is effective and safe for treating Olsen grade 3 AK, offering a non-invasive treatment option for these patients. However, patients with lesions located in multiple anatomical subunits are more prone to treatment failure, warranting increased clinical attention in this population.
[Key words] Actinic keratosis; Olsen grade; 5-aminolevulinic acid; Photodynamic therapy; Treatment resistance; Recurrence
日光性角化病(actinic keratosis,AK)以表皮内不典型角质形成细胞增生为特征,是老年人中最常见的皮肤癌前病变,具有皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,cSCC)发展潜力。据报道,27%~65%的cSCC源自AK病灶,而AK患者发生cSCC的风险每年约增加 1.92%[1-2]。AK多见于老年人头面部等曝光部位,依据皮损肥厚和角化程度可分为Olsen 1~3级[3]。鉴于无法准确预测预后,建议对所有AK进行治疗[4]。
5-氨基酮戊酸光动力疗法(5-aminolevulinic acid photodynamic therapy,ALA-PDT)是一种通过光敏剂选择性地在AK皮损内聚集,在特定波长的光照射下被激活,从而定向破坏病变组织的治疗方法。与其他疗法相比,ALA-PDT不仅具有较高的清除率,还有无创的美容优势,已在国内外得到广泛应用[4-5]。然而,关于ALA-PDT治疗Olsen 3级AK的疗效尚存争议。既往一些小样本研究[6-7]表明,伴有明显角化过度的Olsen 3级AK往往对ALA-PDT反应欠佳,仅有一项包含头皮部位Olsen 1~3级AK患者的随机双盲对照试验显示ALA-PDT治疗的总体清除率可达87%。有鉴于此,目前多项已开展的光动力治疗临床试验[8-9]将Olsen 3级AK排除在外。一些国际指南或共识也不推荐将ALA-PDT作为Olsen 3级AK的初始治疗方案[10]。目前仍然依赖冷冻、手术等破坏性治疗手段来治疗Olsen 3级AK,亟待探索更加有效且非创伤性的治疗选择。本研究旨在进一步探讨ALA-PDT治疗Olsen 3级AK的疗效和安全性,并分析影响其疗效的临床及病理学特征,为临床决策提供更多参考依据。
1 资料和方法
1.1 研究对象
以2020年1月—2023年7月在复旦大学附属华山医院皮肤科门诊接受治疗的成年患者为研究对象,Olsen分级依据临床皮损厚度及角化程度[10]:1级(轻度可触及,砂纸样触感),2级(中等厚度伴角化),3级(非常肥厚伴显著角化)。所有入组患者均具有1个及以上经临床及组织病理学检查确诊为AK的病灶,取材部位位于皮损最为肥厚或角化显著区域。若患者存在多个AK病灶,则通过皮肤镜辅助诊断后同时纳入。所有入组的病灶均由两位医师共同判定为Olsen 3级。排除标准包括:病理学检查结果提示癌变、具有免疫缺陷或光动力治疗禁忌证的患者。所有入组患者签署知情同意书,研究方案经复旦大学附属华山医院伦理审查委员会批准(伦理审批号:2019-491)。
1.2 一般资料
收集患者的临床信息包括性别、年龄、非黑色素瘤皮肤肿瘤病史、AK病灶数和病灶部位。病灶分散于多个解剖亚单位(如颊部、颞部等)的患者被归类为“多部位”组。在治疗前,对患者每个AK病灶进行拍照和标记。收集患者的组织病理学信息,包括AK病理学亚型,如苔藓样型、增生型、色素沉着型、棘层松解型、鲍温样型或萎缩型等。依据Roewert-Huber Keratinocytic Intraepidermal Neoplasia(KIN)病理学分级标准,将所有患者分为KIN Ⅰ~Ⅲ级[4]。
1.3 治疗方案
使用莫匹罗星软膏(中美天津史可制药有限公司)封包目标皮损1 h,然后将皮损表面的鳞屑和痂皮去除。沿皮损周围扩大1 cm所达面积为目标进行治疗,将5-氨基酮戊酸(上海复旦张江生物医药股份有限公司)配制成20%浓度的新鲜溶液,将裁剪后的药棉浸入其中,取出放置在皮损表面避光封包3 h。采用波长633 nm的艾拉LED治疗仪(LED-IB,武汉亚格光电技术股份有限公司)照射,光源输出功率80~100 J/cm2,照光20 min。所有患者均接受4次治疗,每次间隔1~2周。在治疗结束后1、3、6和12个月时进行随访。每次随访由同一位医师比照治疗前的照片对皮损部位进行专科和皮肤镜检查,并评估不良反应。对所有可疑病灶均在访视阶段进行病理学检查。
1.4 疗效评估
初始完全清除(initial complete clearance,ICC)指治疗后3个月时,治疗区域内所有AK病灶均完全清除的患者。如治疗后3个月治疗区域内仍残留有一个或以上经病理学检查证实为AK病灶的患者判定为治疗抵抗(treatment resistance)[11]。只有达到初始完全清除的患者继续随访至治疗后12个月,若治疗部位再次出现病灶且经病理学检查证实为AK后判定为复发(recurrence),否则判定该患者达到持续完全清除(sustained complete clearance,SCC)[11]。病例组定义为治疗失败患者,包括所有治疗抵抗和复发的患者;而对照组则定义为在12个月随访结束时既未出现治疗抵抗也未出现复发的患者。
1.5 安全性评估
每次治疗后即刻评估患者疼痛程度,采用患者自我评估的数字评分法(numerical rating scale,NRS) 进行评估,评分范围为0~10分,分数越高表示疼痛程度越剧烈。同时在每次随访中记录患者治疗区域红斑、色素改变、疤痕、新发肿瘤等不良反应。
1.6 统计学处理
ICC和SCC依据意向性分析(intention-to treat,ITT)进行评估,纳入所有2020年1月—2023年7月在复旦大学附属华山医院皮肤科入组接受ALA-PDT治疗的AK Olsen 3级患者。影响AlA-PDT治疗AK患者的疗效因素分析采用符合方案分析(per-protocol,PP),排除失访患者。本文定量资料用x±s表示,定性资料用率(或百分比)表示。如果连续性定量资料经正态性检验符合正态分布,且方差齐,则采用Student t检验,若方差不齐,则采用Welch's t检验;如不符合正态分布,则采用Wilcoxon秩和检验。采用单因素、多因素逻辑回归分析方法探讨影响ICC、SCC的临床及病理学因素。所有显著性检验均为双侧,P<0.05为差异有统计学意义。分析使用Stata17(StataCorp LLC)进行。
2 结 果
2.1 患者基线特征
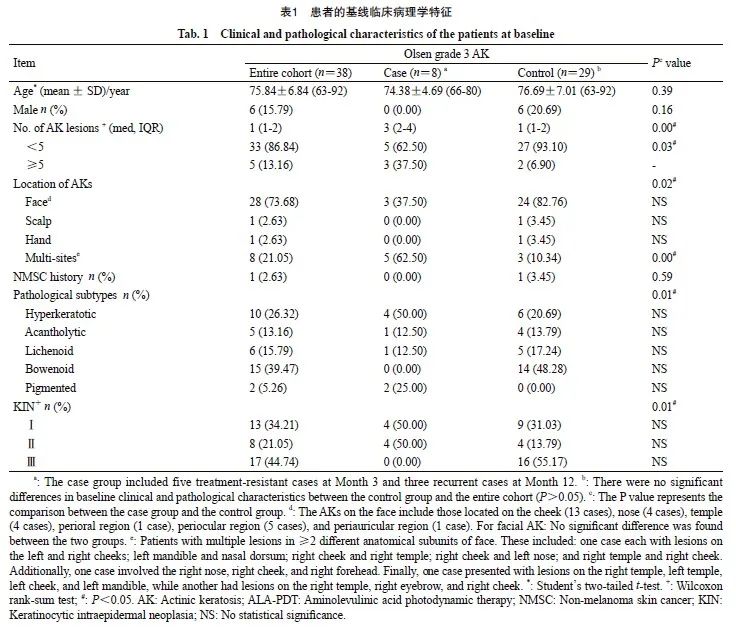
共有38例患者纳入本项研究,其中病例组8例,对照组29例,1例患者在治疗后6个月失访(图1)。总队列、病例组及对照组的基线临床及病理学特征见表1。对照组在基线时的各项特征与总队列相比差异无统计学意义(P>0.05)。
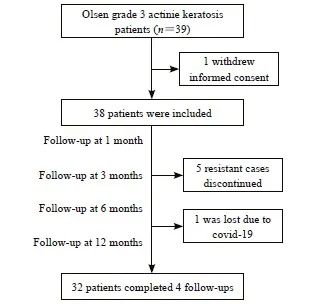
图1 日光性角化病患者入组及随访流程图
Fig. 1 Actinic keratosis patient enrollment and follow-up flowchart
2.2 疗效
33例患者在治疗后3个月达到ICC(33/38, 86.84%)。除1例失访患者外,其他32例患者全部随访至12个月,其中3例患者分别在治疗后第6个月、第9个月和第10个月时出现复发,87.88%(29/33)的患者在12个月时达到SCC。
2.3 安全性
患者疼痛程度评分为4.12±2.15(范围:2~7)分,所有患者的疼痛感在治疗结束后1 h内缓解。治疗后即刻,所有病灶都会出现红斑、水肿,其中1例患者在治疗后出现糜烂,经过对症处理后局部反应均可自行消退。治疗后12个月随访时,6例患者仍有轻微红斑,4例患者出现色素减退,2例患者合并色素沉着。整个随访期间未见瘢痕产生,其中2例患者在治疗区域外出现新发肿瘤,包括1例AK和1例基底细胞癌。
2.4 疗效影响因素
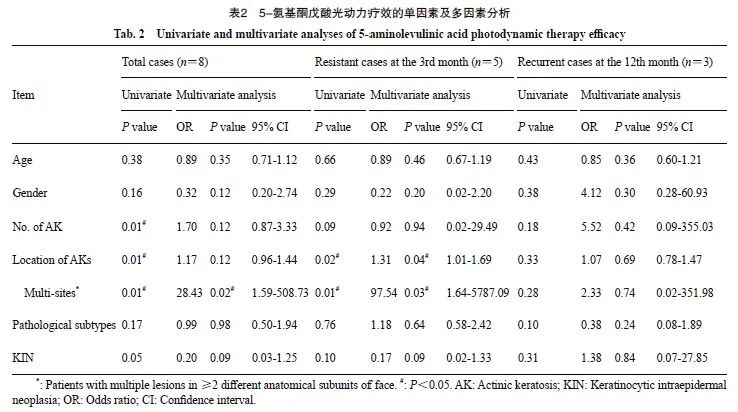
单因素统计分析显示,治疗失败的总病例组与对照组分别在AK数量、AK病灶部位、病理学亚型及KIN分级上差异有统计学意义(P<0.05,表1),然而纳入年龄、性别和以上多个变量的多因素回归分析显示,只有病灶位于多个解剖亚单位是治疗失败的独立危险因素(P=0.02,OR=28.43,95% CI:1.59~508.73,表2)。在进一步的亚组分析中,该因素被证实与治疗抵抗显著相关(P=0.03,OR=97.54,95% CI:1.64~5 787.09)。未发现影响复发的危险因素。
3 讨 论
AK是老年患者中最常见的皮肤癌前病变,其发病与紫外线暴露有关,好发于美观要求较高的面部、头部等部位[12-13]。Olsen分级是使用最为广泛的AK临床分级系统,依据皮损肥厚和角化可分为1~3级,被用来评估病变的严重程度[10]。已有研究[14]证实,该分级与cSCC发展风险密切相关,即使是已接受过治疗的Olsen 3级AK病灶,在4年间进展为cSCC的总风险率仍然是其他Olsen等级病灶的5倍,高达20.9%。
AK的治疗包括外涂咪喹莫特、5-氟尿嘧啶、维A酸等药膏,或刮除、冷冻、CO2激光、光动力治疗、手术等方法。与Olsen 1~2级AK不同,多项研究[4-5]结果显示,传统的AK外用药物,如咪喹莫特、5-氟尿嘧啶等均对Olsen 3级AK疗效不佳,因此目前仍然推荐冷冻、刮除或手术等有创性手段来治疗该类皮损,但这些方法往往会遗留美容或功能损害并且不适用于大面积病灶。与以上治疗手段相比,光动力治疗因其对AK具有远期清除率高、美容效果卓越、安全性高等优点而在临床获得广泛运用,尤其适用于面部和头皮的多发或大面积AK病灶的治疗[5,15]。然而,对于ALA-PDT治疗Olsen 3级AK的疗效仍然存在困惑。Dijkstra等[16]报道接受δ-ALA-PDT治疗的4例Olsen 3级AK患者中仅50%获得完全缓解;而由另一种光敏剂——甲基化氨基酮戊酸酯(methyl-aminolevulinate,MAL)介导的光动力治疗对Olsen 3级AK的缓解率仅为32.5%[7]。这种对光动力治疗应答欠佳的原因推测与过度肥厚的皮损或显著增生的鳞屑、痂皮阻碍了光源的穿透力或药物的弥散有关。其后,多项有关光动力治疗AK的临床试验均将Olsen 3级AK排除在外,国外指南也不推荐将光动力作为Olsen 3级AK的初始治疗方案。然而,一项包含头皮部位Olsen 1~3级AK的随机双盲对照试验证实,在通过凡士林封包充分去除痂皮后,ALA-PDT仍然可以使87%的患者达到总体完全清除[6]。同样,一项同时纳入Olsen 1~3级AK患者的回顾性研究[17]显示,接受3次ALA-PDT治疗后的完全清除率仍然可超出90%。McLoone等[18]通过冷冻静态切片和放射性同位素追踪技术发现皮肤角质层的厚度与ALA弥散深度无关,也提示ALA-PDT可用于较为肥厚的Olsen 3级AK。
在本研究中,86.84%的Olsen 3级AK患者在治疗后3个月达到ICC,其中87.88%的患者在治疗后12个月仍然维持SCC,均高于既往小样本研究[7,16]的结果。可能的原因是:① 通过病理学检查排除该类病灶存在的潜在癌变;② 本研究中对所有皮损进行预处理,特别是采用软膏封包的方式去除鳞屑和痂皮,有利于药物和光的渗透、吸收;③ 增加了连续治疗的次数,所有患者均接受间隔1~2周的连续4次治疗,这与研究[17]报道的治疗达3次及以上将显著提高AK清除率相符。从安全性方面来看,整个治疗过程中未发现严重不良反应,与既往研究一致,仅部分患者出现持久红斑或色素改变。
目前,影响ALA-PDT对AK疗效的因素仍不清楚。部分病例报道显示KIN Ⅲ级的AK病灶更易对ALA-PDT出现治疗抵抗或在治疗后复发。然而,本研究未能发现KIN Ⅲ级与ALA-PDT治疗失败之间的显著相关性。单因素及多因素回归分析显示,拥有分布于多个解剖亚单位的Olsen 3级AK病灶的患者更易出现治疗失败,进一步的亚组探讨提示,这类患者更多表现为对ALA-PDT的治疗抵抗,猜测原因之一可能与这类患者病灶数量较多导致治疗覆盖不全,或与这类患者个体以及免疫状态差异相关。由于本研究样本量小,因此以上结果有待大样本量的临床研究进行验证。
本研究的局限性包括单中心病例、样本量较小且缺乏AK病灶的面积和厚度等。此外,尽管活检取材部位选择了病灶最为肥厚或角化最为明显的区域,但病理学表现仍可能无法完全代表整体情况。本研究提示ALA-PDT对Olsen 3级AK患者具有良好的疗效和安全性,为该类患者提供了一种无创的治疗选择。然而,病灶分布于多个解剖亚单位的患者更容易出现治疗失败,对此类患者的治疗需要提高警惕,制订更为合理的治疗和随访方案。
致谢:本研究得到了复旦大学附属华山医院皮肤科陈虎艳医师、黄琼教授、陈连军教授的协助。
利益冲突申明:所有作者均声明不存在利益冲突。
作者贡献声明:
朱沁媛:起草并修改论文,实施研究过程,收集数据,分析结果并整理文献。马文涓、栾菁:收集数据。吴文育:提出研究方向和基本框架。陈淑君:提出研究方向,实施研究过程,审核并修改论文。
[参考文献]
[1] KIM Y S, SHIN S, JUNG S H, et al. Genomic progression of precancerous actinic keratosis to squamous cell carcinoma[J]. J Invest Dermatol, 2022,142(3): 528-538.
[2] MADANI S, MARWAHA S, DUSENDANG J R, et al. Ten-year follow-up of persons with sun-damaged skin associated with subsequent development of cutaneous squamous cell carcinoma
[J]. JAMA Dermatol, 2021, 157(5): 559-565.
[3] EISEN D B, ASGARI M M, BENNETT D D, et al. Guidelines of care for the management of actinic keratosis [J]. J Am Acad Dermatol, 2021, 85(4): E209-E233.
[4] KANDOLF L, PERIS K, MALVEHY J, et al. European consensus-based interdisciplinary guideline for diagnosis, treatment and prevention of actinic keratoses, epithelial UVinduced dysplasia and field cancerization on behalf of European Association of Dermato-Oncology, European Dermatology Forum, European Academy of Dermatology and Venereology and Union of Medical Specialists (Union Européenne des Médecins Spécialistes) [J]. J Eur Acad Dermatol Venereol, 2024, 38(6): 1024-1047.
[5] 中华医学会皮肤性病学分会光动力治疗研究中心, 中国康复医学会皮肤病康复专业委员会, 中国医学装备协会皮肤病与皮肤美容分会光医学治疗装备学组. 氨基酮戊酸光动力疗法皮肤科临床应用指南(2021版) [J]. 中华皮肤科杂志, 2021, 54(01): 1-9.
Photodynamic Therapy Research Center, Chinese Society of Dermatology; Chinese Association of Rehabilitation Dermatology; Photomedicine Therapeutic Equipment Group, Committee on Shin Disease And Cosmetic Dermatology, China Association of Medical Equipment. Chinese guidelines for clinical application of aminolevulinic acid-based photodynamic therapy in dermatology(2021 edition) [J]. Chin J Dermatol, 54(1): 1-9.
[6] MOLONEY F J, COLLINS P. Randomized, double-blind, prospective study to compare topical 5-aminolaevulinic acid methylester with topical 5-aminolaevulinic acid photodynamic therapy for extensive scalp actinic keratosis [J]. Br J of Dermatol, 2007, 157(1): 87-91.
[7] KO D Y, JEON S Y, KIM K H, et al. Fractional erbium: YAG laser-assisted photodynamic therapy for facial actinic keratoses: a randomized, comparative, prospective study [J]. J Eur Acad Dermatol Venereol, 2014, 28(11): 1529-1539.
[8] TSCHEN E H, WONG D S, PARISER D M, et al. Photodynamic therapy using aminotaevulinic acid for patients with nonhyperkeratotic actinic keratoses of the face and scalp: phase Ⅳ multicentre clinical trial with 12-month follow up [J]. Br J of Dermatol, 2006, 155(6): 1262-1269.
[9] DIRSCHKA T, RADNY P, DOMINICUS R, et al. Long-term (6 and 12 months) follow-up of two prospective, randomized, controlled phase Ⅲ trials of photodynamic therapy with BF-200 ALA and methyl aminolaevulinate for the treatment of actinic keratosis [J]. Br J of Dermatol, 2013, 168(4): 825-836.
[10] DE BERKER D, MCGREGOR J M, MOHD MUSTAPA M F, et al. British Association of Dermatologists' guidelines for the care of patients with actinic keratosis 2017 [J]. Br J Dermatol, 2017, 176(1): 20-43.
[11] WONG T H, MORTON C A, COLLIER N, et al. British Association of Dermatologists and British Photodermatology Group guidelines for topical photodynamic therapy 2018 [J]. Br J Dermatol, 2019, 180(4): 730-739.
[12] HUANG J, ZHANG L, SHI L, et al. An epidemiological study on skin tumors of the elderly in a community in Shanghai, China[J]. Sci Rep, 2023, 13(1).
[13] 高潇,王冰,姚佳,等. CBP棕榈酰化位点的突变对皮肤鳞状细胞癌A431细胞生物学行为的影响 [J]. 中国癌症杂志, 2018, 28 (12): 906-914.
GAO X, WANG B, YAO J, et al. Biological effects of CBP palmitoylation site mutation on cutaneous squamous cell carcinoma A431 cells in vitro [J]. China Oncology, 2018, 28 (12): 906-914.
[14] AHMADY S, JANSEN M H E, NELEMANS P J, et al. Risk of invasive cutaneous squamous cell carcinoma after different treatments for actinic keratosis a secondary analysis of a randomized clinical trial [J]. JAMA Dermatol, 2022, 158(6): 634-640.
[15] STEEB T, WESSELY A, PETZOLD A, et al. Evaluation of long-term clearance rates of interventions for actinic keratosis: a systematic review and network meta-analysis [J]. JAMA Dermatol, 2021, 157(9): 1066-1077.
[16] DIJKSTRA A T, MAJOIE I M L, VAN DONGEN J W F, et al. Photodynamic therapy with violet light and topical δ-aminolaevulinic acid in the treatment of actinic keratosis, Bowen's disease and basal cell carcinoma [J]. J Eur Acad Dermatol Venereol, 2001, 15(6): 550-554.
[17] ZHANG G, CAO Z, WANG P, et al. Comparison of efficacy, adverse effects and costs between 20 % ALA-PDT and 10 % ALA-PDT for the treatment of actinic keratosis in Chinese patients [J]. Photodiag Photodyn, 2020, 31:101605.
[18] M C L O O N E N , D O N N E L L Y R F , W A L S H M , e t a l . Aminolaevulinic acid diffusion characteristics in 'in vitro'normal human skin and actinic keratosis: implications for topical photodynamic therapy [J]. Photodermatol Photo, 2008, 24(4): 1831-1890.


