中山大学附属第一医院刘辉教授《自然·通讯》:一种CD26+ 肌腱干/祖细胞有助于肌腱修复和异位骨化
时间:2025-01-22 12:09:49 热度:37.1℃ 作者:网络
肌腱是一种独特的连接肌肉和骨骼的结缔组织,具有特定的机械特性,使其能够适应肌肉传递的负荷。肌腱损伤可能导致严重的残疾,包括剧烈疼痛、残疾以及给社会带来昂贵的医疗成本。异位骨化(Heterotopic Ossification, HO)是一种受伤后发生的病理过程,其中骨头在非骨骼组织如肌肉和肌腱中形成,导致疼痛并限制活动范围。HO 是肌腱受伤后最严重的并发症之一,可导致严重的疼痛、畸形和关节挛缩。愈合的肌腱很少能够恢复到未受损状态的机械特性,相关的并发症通常视病情进一步恶化。明确负责肌腱愈合和HO的干/祖细胞对于阐明其潜在机制和开发改善肌腱修复的治疗策略至关重要。
中山大学附属第一医院刘辉教授团队在Nature Communications上发表了题为A CD26+ tendon stem progenitor cell population contributes to tendon repair and heterotopic ossification的研究论文。该研究发现了一种CD26+ 肌腱干/祖细胞对肌腱愈合和异位骨化有重要作用。此外,该研究揭示了 Tenascin-C(TNC)-Hippo 信号通路在 CD26+ 肌腱干/祖细胞的软骨分化和 HO 形成中的关键作用。总体而言,该发现为识别肌腱干/祖细胞及其潜在的细胞和分子机制提供新思路,证实了它们在肌腱愈合和异位骨形成中的关键作用。

该研究利用肌腱损伤异位骨化小鼠模型单细胞测序数据发现肌腱鞘膜上存在CD26+ 肌腱干/祖细胞,可能参与韧带损伤修复与异位骨化的形成。在体外,CD26+ 肌腱干/祖细胞具有自我增值和成骨、成软骨和成脂肪三向分化潜能,且具有独特的干细胞标志表达谱。在间质细胞群体中,存在CD26+肌腱干/祖细胞向Apoe+前体细胞和Sema5a+前体细胞的分化谱系。利用CD26荧光示踪小鼠模型和CD26+细胞条件性敲除模型证实,在肌腱损伤后,CD26+ 肌腱干/祖细胞可分化成为肌腱细胞和成软骨、成骨系细胞,参与肌腱损伤修复与异位骨化的形成。将CD26+肌腱干/祖细胞敲除后,肌腱损伤愈合以及异位骨化的形成均受影响。在探究CD26+ 肌腱干/祖细胞参与异位骨化的潜在分子机制过程中,发现细胞外基质蛋白TNC的表达在损伤局部显著上调,且其下游Hippo信号通路在CD26+ 肌腱干/祖细胞中显著富集。进一步在体内敲除TNC或抑制Hippo信号通路发现,异位成骨表型显著被抑制,提示TNC-Hippo 信号通路在 CD26+ 肌腱干/祖细胞的HO 形成中起关键作用。
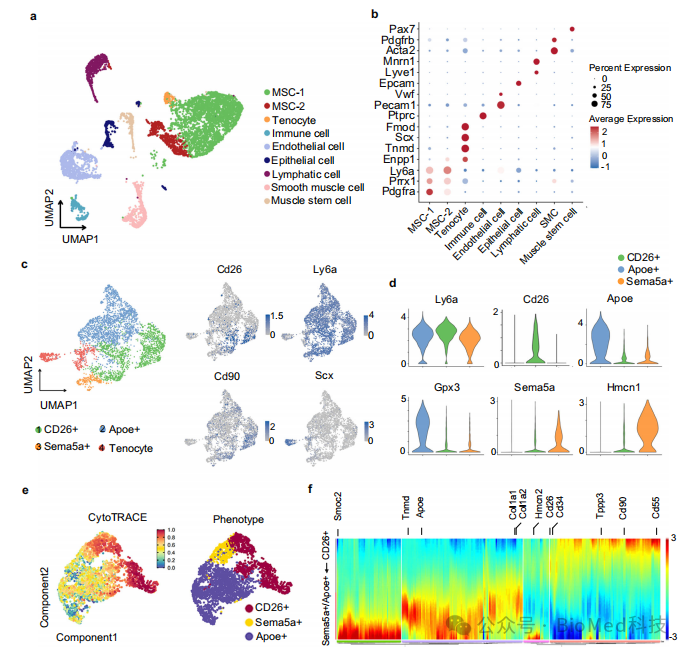
该研究通过肌腱损伤疾病模型的多组合测序分析策略和体内外验证方法,发现了一群既往既往未见报道的CD26+ 肌腱干/祖细胞及其在肌腱愈合和异位骨形成中的关键作用。研究揭示了肌腱损伤修复和异位骨化的干/祖细胞身份及微环境调控因素,为肌腱损伤修复及异位骨化的治疗提供潜在治疗靶点和思路,对肌腱损伤修复及异位骨化的机制研究有重要意义。
中山大学附属第一医院陈斯文博士后、悉尼大学林颖欣博士后、北京积水潭医院杨豪医生为论文共同第一作者。中山大学附属第一医院刘辉教授为通讯作者。
原文链接:


