罕见病专栏|系统性红斑狼疮伴微管聚集1例报告并文献复习
时间:2025-01-19 12:13:10 热度:37.1℃ 作者:网络
摘 要 微管聚集是肌肉活检中观察到的超微结构异常,可出现在多种获得性和遗传性疾病患者的肌肉活检标本中。现报告1例34岁男性系统性红斑狼疮患者,长期口服甲泼尼龙、羟氯喹、他克莫司等,药物调整过程中出现双下肢近端间歇性肌无力。肌酸激酶正常,抗U1-RNP/Sm 49.45 RU/mL增高,肌电图示左侧髂腰肌肌源性损害,肌肉病理见肌纤维内微管聚集现象,经基因检测排除遗传性微管聚集肌病。结合文献复习,探讨微管聚集的病因及临床特点,提高对微管聚集相关疾病诊断的认识。本例患者提示,系统性红斑狼疮患者可出现波动性肌无力以及肌肉病理微管聚集现象,调整SLE药物后症状可部分缓解。
关键词
系统性红斑狼疮;肌无力;肌肉活检;微管聚集;管聚集肌病;药物性管聚集肌病;混合性结缔组织病
微管聚集(tubular aggregates,TA)是肌肉活检中观察到的超微结构异常,起源于肌浆网(sarcoplasmic-reticulum,SR),主要存在于Ⅱ型肌纤维中[1-2]。TA可出现在多种遗传性和获得性肌肉病中[3]。微管聚集性肌病(tubular aggregate myopathy,TAM)指一组肌肉病理以TA为主要特征的罕见遗传性肌肉疾病,具有形态学特征性和临床表现异质性[4]。系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种慢性全身性自身免疫性疾病,4%~16%的SLE患者骨骼肌受累,临床表现为对称性肌无力(以近端为主)或肌痛。SLE患者肌肉组织病理学改变包括血管壁增厚、血管炎、炎性肌病、空泡性肌病、Ⅱ型肌纤维萎缩、神经源性肌纤维萎缩,以及少见的包涵体和罕见的TA等[5-7]。本文报告1例双下肢近端间歇性肌无力的SLE患者,肌肉病理见肌纤维内TA现象,结合文献复习,探讨TA的病因及临床特点,提高对TA相关疾病诊断的认识。
1 临床资料
患者,男,34岁,因“间歇性双下肢肌无力2年余”入院。患者2年来无诱因反复出现劳累后双下肢无力,站立困难,行走拖曳,每次持续2~7 d,休息后缓解,无肌痛、肌痉挛、肌萎缩、感觉障碍等。发作期间血糖、电解质、肌酸激酶未见异常。曾于精神心理科就诊,考虑躯体化障碍可能,予以帕罗西汀口服1个月,发作频率及持续时间等无明显变化,遂逐渐停药,并荐入神经内科进一步诊治。患者5年前于外院行肾穿刺活检后诊断为“狼疮性肾炎、肾病综合征”,长期口服甲泼尼龙、羟氯喹、他克莫司等。1年前,激素逐渐减量,加用贝利尤单抗治疗,隔日口服甲泼尼龙4 mg,SLE症状稳定。家族中无类似疾病史者。
神经系统查体:意识清楚,高级皮质功能正常。颅神经正常。双上肢肌力5级,双侧髂腰肌肌力4-级,双侧股四头肌肌力5级,双下肢远端肌力5级。双下肢肌张力略减低,腱反射正常,双侧巴氏征阴性,共济运动、深浅感觉正常。疲劳试验阴性。
辅助检查:抗核抗体颗粒1∶100(参考值1∶80),抗U1-RNP/Sm抗体阳性,49.45 RU/mL(参考值0~20 RU/mL)。类风湿因子、抗环瓜氨酸抗体、肌炎抗体、坏死性肌病抗体及重症肌无力抗体谱均阴性,血纸片α-葡萄糖苷酶活性正常。发作时及发作间期电解质、肌酸激酶、肌酸激酶同工酶、乳酸脱氢酶正常。血常规、血生化、甲状腺功能、肿瘤标志物、维生素水平等实验室检查无明显异常。下肢MRI,胸腰段脊髓、腰骶丛MRI平扫及增强均未见明显异常。肌电图显示左侧髂腰肌运动单位电位时限偏窄,募集差,提示左侧髂腰肌肌源性损害。运动和感觉神经传导速度正常,重复神经电刺激正常。长时程及短时程运动诱发试验、脑干听觉诱发电位和四肢体感诱发电位均正常范围。
左股四头肌活检,肌肉冰冻切片H-E染色可见散在个别小圆状萎缩肌纤维以及核内移现象。少数肌纤维膜下及中央见线状、块状、点状嗜碱性深染的颗粒样物质沉积和个别肌纤维内出现空泡。沉积物在MGT染色呈紫红色,NADH-TR深染,NSE染色深染(图1)。PAS染色未见糖原蓄积,ORO染色可见少数肌纤维内脂肪滴轻度增多。
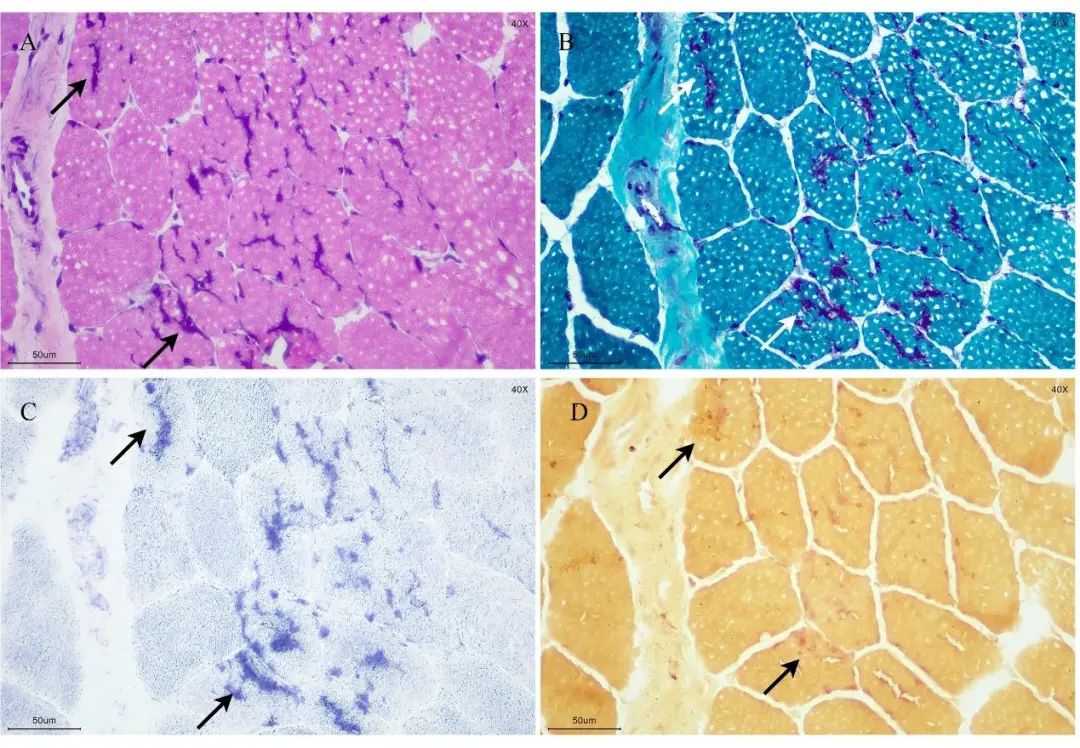
图1 左股四头肌活检 A.H-E染色可见少数肌纤维膜下及肌纤维中有嗜碱性沉积物(微管聚集现象);B.沉积物在MGT染色呈紫红色;C.NADH-TR深染;D.NSE染色深染。在所有图像中,箭头表示微管聚集。比例尺为50 μm。
免疫组织化学染色显示肌纤维膜Dystrophin(+)和Dysferlin(+),Desmin(+),沉积物和空泡上述3种抗体则均未着色;α/β/γ/θ-Sarcoglycan(+),α-Dystroglycan(+),P62(-)。MHC-1(血管内皮+,肌纤维膜-),MxA(-),C5b9(-)。CD3(-)、CD8(-)、CD20(-)、CD68(-)。
2 讨论
本文报告1例双下肢近端间歇性肌无力的SLE患者,肌肉病理发现肌纤维内TA现象,为诊断提供了关键线索。TA具有特征性病理改变,临床表现形式各异,可见于多种遗传性疾病和获得性疾病,诊断率低而误诊率高(表1)。
表1 肌肉活检中与微管聚集相关的疾病和本例患者的鉴别诊断Tab.1 Disorders associated with tubular aggregates in muscle biopsies and investigations to exclude the respective condition in our patient

据报道,目前有9个基因突变可导致TA,包括遗传性TAM、糖原累积病X型,先天性肌无力综合征和周期性麻痹等(表2)[8-14]。该患无家族史,全外测序未见明确致病基因,上述遗传性肌病伴TA暂不考虑[15]。患者明确SLE病史,临床表现为波动性肌无力,肌电图检提示肌源性损害,电解质、肌酸激酶、运动诱发试验、重复电刺激等未见异常,排除周期性麻痹、肌强直性疾病、肌无力综合征、重症肌无力等肌肉病。予以甲泼尼龙加量到4 mg每天1次,他克莫司0.5 mg每天2次,羟氯喹0.2 g每天1次调节免疫,补充维生素等对症治疗。随访2个月余,患者下肢无力发作频率减低及持续时间缩短,临床症状改善。
表2 微管聚集相关疾病的基因及临床表型Tab.2 Genes and clinical phenotypes associated with disorders with tubular aggregates

病理上,典型的TA表现为H-E染色呈嗜碱性深染的颗粒样物质沉积,沉积物在MGT染色呈紫红色,NADH-TR和NSE深染,SDH和COX染色未见异常,进一步证实TA缘于SR而不是线粒体或线粒体相关蛋白[16-17]。关于TA形成机制主要存在几种假设:SALVIATI等认为TA具有隔离钙的能力,能够调节肌动蛋白和肌球蛋白相互作用,是肌肉损伤后的修复体现,可防止肌纤维过度收缩和坏死[10, 18]。SCHIAFFINO[19]认为TA是一种特殊类型的蛋白质聚集体,由SR膜蛋白的错误折叠和聚集引起,类似于神经退行性疾病。TA还需与柱状螺旋体(cylindrical spirals,CS)鉴别,光镜下很难与TA区分,需进一步使用电子显微镜或特殊的免疫组化抗体(如T-tubule,TT和SR相关蛋白)协助鉴别[2]。
本例SLE患者长期用免疫调节药物,药物性TA不能完全排除。然而,既往研究仅在一些长期服用镇静镇痛药物及抗精神病药物的患者中发现TA,如哌替啶、巴比妥类、吩噻嗪类药物、地西泮等[20]。患者长期大量应用激素,可能致代谢性肌病,表现为周期性麻痹-发作性肌无力,其病理改变为Ⅱ型肌纤维萎缩和少数肌纤维变性,并非TA[21],停药4个月后行左股四头肌活检未发现TA[22]。Lambert-Eaton肌无力综合征患者的Ⅱ型纤维中,以及在3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methyl-glutaryl-CoA reductase,HMGCR)抗体相关的坏死性自身免疫性肌病中报道过TA[24-25]。本例患者抗U1-RNP/Sm 阳性,提示存在混合性结缔组织病的可能[23],这也是TA出现的诱因之一。本例SLE患者双下肢无力以及肌肉病理TA的形成可能是继发的非特异性病理改变。
目前TA的治疗主要为对症及针对原发病的治疗。既往研究在一些伴随TA的肢带性重症肌无力患者中发现乙酰胆碱酯酶抑制剂治疗反应良好[26-27]。免疫抑制剂对TA也有一定疗效,可能与膜稳定维持、酶调节作用、底物有效性改变和核遗传调控有关[22, 28]。近年有研究发现白藜芦醇可减少鼠的骨骼肌TA数量,这与抗氧化、抗炎、抗增殖的特性有关,TA的形成可能被抑制或延迟[29]。这些研究结果进一步说明TA与机体免疫和代谢异常息息相关。
本文报道了1例肌肉活检出现TA的双下肢无力SLE患者,若肌肉病理以TA为主要病变,除了遗传性肌病之外,需考虑更多获得性因素。SLE患者在治疗期间,尽管指标趋于稳定,但仍可出现肌无力的临床表现以及肌肉病理的TA现象,通过免疫调节治疗可以部分改善。
参考文献:
1. ENGEL W K, BISHOP D W, CUNNINGHAM G G. Tubular aggregates in type II muscle fibers: Ultrastructural and histochemical correlation[J]. J Ultrastruct Res, 1970, 31(5-6): 507-525.
2. BRADY S, HEALY E G, GANG Q, et al. Tubular aggregates and cylindrical spirals have distinct immunohistochemical signatures[J]. J Neuropathol Exp Neurol, 2016, 75(12): 1171-1178.
3. 刘秀娟, 徐春晓, 袁云, 等. 肌病伴管聚集的疾病谱系和病理改变分析[J]. 中华神经科杂志, 2016, 49(10): 753-757.
4. FAN Q, GWATHMEY K, DU X, et al. Tubular aggregate myopathy causing progressive fatiguable weakness[J]. Pract Neurol, 2024, 24(2): 137-140.
5. LIANG Y, LENG R X, PAN H F, et al. Associated variables of myositis in systemic lupus erythematosus: A cross-pal study[J]. Med Sci Monit, 2017, 23: 2543-2549.
6. TINIAKOU E, GOLDMAN D, CORSE A, et al. Clinical and histopathological features of myositis in systemic lupus erythematosus[J]. Lupus Sci Med, 2022, 9(1): e000635.
7. NIAKAN E, HARATI Y, DANON M J. Tubular aggregates: Their association with myalgia[J]. J Neurol Neurosurg Psychiatry, 1985, 48(9): 882-886.
8. OH S J, PARK K S, RYAN H F, JR, et al. Exercise-induced cramp, myoglobinuria, and tubular aggregates in phosphoglycerate mutase deficiency[J]. Muscle Nerve, 2006, 34(5): 572-576.
9. MORIN G, BIANCALANA V, ECHANIZ-LAGUNA A, et al. Tubular aggregate myopathy and Stormorken syndrome: Mutation spectrum and genotype/phenotype correlation[J]. Hum Mutat, 2020, 41(1): 17-37.
10. BOHM J, LAPORTE J. Gain-of-function mutations in STIM1 and ORAI1 causing tubular aggregate myopathy and Stormorken syndrome[J]. Cell Calcium, 2018, 76: 1-9.
11. BELAYA K, FINLAYSON S, COSSINS J, et al. Identification of DPAGT1 as a new gene in which mutations cause a congenital myasthenic syndrome[J]. Ann N Y Acad Sci, 2012, 1275: 29-35.
12. COSSINS J, BELAYA K, HICKS D, et al. Congenital myasthenic syndromes due to mutations in ALG2 and ALG14[J]. Brain, 2013, 136(Pt 3): 944-956.
13. MATSUMOTO C, MORI-YOSHIMURA M, NOGUCHI S, et al. Phenotype of a limb-girdle congenital myasthenic syndrome patient carrying a GFPT1 mutation[J]. Brain Dev, 2019, 41(5): 470-473.
14. STERNBERG D, MAISONOBE T, JURKAT-ROTT K, et al. Hypokalaemic periodic paralysis type 2 caused by mutations at codon 672 in the muscle sodium channel gene SCN4A[J]. Brain, 2001, 124(Pt 6): 1091-1099.
15. GANG Q, BETTENCOURT C, BRADY S, et al. Genetic defects are common in myopathies with tubular aggregates[J]. Ann Clin Transl Neurol, 2022, 9(1): 4-15.
16. FUNK F, CEUTERICK-DE GROOTE C, MARTIN J J, et al. Morphological spectrum and clinical features of myopathies with tubular aggregates[J]. Histol Histopathol, 2013, 28(8): 1041-1054.
17. 刘洁晓, 钱芸, 蒲传强, 等. 管聚集肌病的临床与病理特点[J]. 中华神经科杂志, 2014, 47(11): 776-780.
18. PECHE G A, SPIEGELHALTER C, SILVA-ROJAS R, et al. Functional analyses of STIM1 mutations reveal a common pathomechanism for tubular aggregate myopathy and Stormorken syndrome[J]. Neuropathology, 2020, 40(6): 559-569.
19. SCHIAFFINO S. Tubular aggregates in skeletal muscle: Just a special type of protein aggregates?[J]. Neuromuscul Disord, 2012, 22(3): 199-207.
20. DORIGUZZI C, MONGINI T, JEANTET A, et al. Tubular aggregates in a case of osteomalacic myopathy due to anticonvulsant drugs[J]. Clin Neuropathol, 1984, 3(1): 42-45.
21. 周磊, 赵重波, 朱雯华, 等. 类固醇肌病的临床和病理特点分析(附10例报道)[J]. 中国临床神经科学, 2011, 19(6): 583-587, 605.
22. GILCHRIST J M, AMBLER M, AGATIELLO P. Steroid-responsive tubular aggregate myopathy[J]. Muscle Nerve, 1991, 14(3): 233-236.
23. STYPINSKA B, LEWANDOWSKA A, FELIS-GIEMZA A, et al. Association study between immune-related miRNAs and mixed connective tissue disease[J]. Arthritis Res Ther, 2021, 23(1): 19.
24. MADIGAN N N, LIEWLUCK T, MILONE M, et al. Necrotizing autoimmune myopathy with tubular aggregates[J]. Neurology, 2019, 93(7): 313-314.
25. CORDTS I, FUNK F, SCHULZ J B, et al. Tubular aggregates in autoimmune Lambert-Eaton myasthenic syndrome[J]. Neuromuscul Disord, 2016, 26(12): 880-884.
26. LUO H Y, ZHAO L, MAO C Y, et al. Novel compound heterozygous GFPT1 mutations in a family with limb-girdle myasthenia with tubular aggregates[J]. Neuromuscul Disord, 2019, 29(7): 549-553.
27. RODOLICO C, TOSCANO A, AUTUNNO M, et al. Limb-girdle myasthenia: clinical, electrophysiological and morphological features in familial and autoimmune cases[J]. Neuromuscul Disord, 2002, 12(10): 964-969.
28. SEEMAN P M. Membrane stabilization by drugs: Tranquilizers, steroids, and anesthetics[J]. Int Rev Neurobiol, 1966, 9: 145-221.
29. TONIOLO L, FUSCO P, FORMOSO L, et al. Resveratrol treatment reduces the appearance of tubular aggregates and improves the resistance to fatigue in aging mice skeletal muscles[J]. Exp Gerontol, 2018, 111: 170-179.
【引用格式】赖小梅,朱啸巍,张晓洁,等 . 系统性红斑狼疮伴微管聚集1例报告并文献复习[J]. 中国神经精神疾病杂志,2024,50(10):636-640.
【Cite this article】LAI X M, ZHU X W,ZHANG X J,et al.Tubular aggregates in systemic lupus erythematosus: A case report and review of literature[J]. Chin J Nervous Mental Dis,2024,50(10):636-640.
DOI:10.3969/j.issn.1002-0152.2024.010.013


