Nat Commun:上海交通大学李万万/于绪江合作研究发现高价铋(V)纳米平台可触发癌细胞死亡和抗肿瘤免疫反应
时间:2025-01-25 12:08:57 热度:37.1℃ 作者:网络
活性氧诱导的免疫治疗在肿瘤治疗中具有巨大的前景,但由于其依赖于外源性兴奋和/或内源性H2O2和O2,因此存在局限性。
2025年1月20日,上海交通大学材料科学与工程学院李万万、于绪江共同通讯在Nature communications 上在线发表题为“A high-valence bismuth(V) nanoplatform triggers cancer cell death and anti-tumor immune responses with exogenous excitation-free endogenous H2O2- and O2-independent ROS generation”的研究论文。研究报道了一种多功能的氧化五价铋(V)纳米平台(NaBiVO3-PEG)可在无激发和H2O2-和O2-独立的方式。
暴露于肿瘤微环境后,NaBiVO3-PEG通过电子转移介导的BiV-to-BiIII转化和晶格氧转化,经历连续的H+加速水解,并生成•OH和1O2。内吞后钠离子的同时释放触发caspase-1介导的细胞焦亡。NaBiVO3-PEG瘤内给药可对原发和远处肿瘤产生强大的治疗效果,并激活全身免疫反应以对抗肿瘤转移。NaBiVO3-PEG静脉给药可有效聚集于肿瘤部位,用于进一步的实时ct监测、免疫治疗或替代协同免疫放疗。总之,这项工作提供了一种基于高价铋(V)纳米平台的纳米药物,并强调了其在癌症免疫治疗中的巨大潜力。

免疫疗法利用保护性免疫系统来击败肿瘤,并正在彻底改变癌症治疗的格局。然而,大多数实体瘤高度复杂的肿瘤免疫抑制微环境,促炎免疫细胞频率低,极大地限制了免疫治疗的临床应用。因此,只有一小部分患者对免疫治疗有反应。活性氧(ROS)是关键的信号分子。最近的研究表明,ROS不仅可以通过过量破坏脂质、蛋白质和 DNA 直接导致细胞凋亡和坏死,还可以通过诱导免疫原性细胞死亡(ICD)来诱发免疫反应。然而,尽管放疗(RT)、光动力疗法(PDT)、声动力疗法(SDT)和化学动力疗法(CDT)等多种治疗技术已被广泛研究用于调节ROS的产生,但对外源性x射线、激光或超声和/或内源性H2O2的依赖严重阻碍了ROS的产生,并阻碍了基于ROS的直接清除肿瘤负荷和基于ROS的癌症免疫治疗。因此,迫切需要减少或不依赖外源性兴奋和内源性H2O2和O2的替代方法来产生丰富的ROS,提高肿瘤免疫治疗。
新出现的证据表明,高价氧盐能够基于高价元素的固有氧化还原反应性,通过各种反应生成 ROS。然而,尽管它们很有前景,但纳米系统要么在肿瘤特异性低的中性条件下迅速分解,要么需要外部刺激来放大 ROS 的产生和抗肿瘤效率。半金属铋(Bi)生物毒性低,对x射线、激光和超声的敏感性高,可以以三价态(BiIII)存在,形成多种稳定的化合物,并以五价态(BiV)存在,形成氧化铋。基于biiii的纳米药物已被广泛研究,在以下方面具有巨大潜力:基于计算机断层扫描(CT)和光声成像的体内成像,基于RT、PDT和SDT的直接切除肿瘤,以及相应的成像引导治疗。初步研究表明,铋酸钠晶体和本体材料在黑暗中对有机污染物具有光催化活性和氧化降解能力。然而,由于其不稳定性和缺乏简单的结构工程方法,基于biv的纳米药物在活性氧生成效率或直接清除肿瘤方面尚未被报道或系统研究,更不用说活性氧激活的免疫治疗或影像引导的癌症联合治疗。
在这项工作中,研究者提出了一种基于高价BiIIIOx纳米平台的无外源性兴奋和内源性H2O2和o2非依赖性的纳米平台,具有自发和大量的ROS生成,用于肿瘤免疫治疗。五价铋(V)纳米平台(NaBiVO3-PEG)是通过模板辅助蚀刻法从BiIIIOx纳米粒子合成的,具有均匀的多孔球形纳米花状结构,并使用聚乙二醇化磷脂外层进行修饰。NaBiVO3-PEG在中性条件下表现出较低的氧化能力和ROS生成能力。当分散在类似于肿瘤微环境或肿瘤细胞的酸性缓冲液中时,加速的水解发生了崩塌的结构,通过单个电子转移介导的BiV-to-BiIII转换,•OH和1O2的出现,晶格氧迁移和钠离子的释放。内源性H2O2使1O2生成率升高,•OH生成率略有下降,但与NaBiVO3-PEG竞争性氧化还原反应使1O2生成率升高,且无明显的缺氧副作用。同时ROS的产生和Na+的释放使caspase-1相关的细胞焦亡和促炎细胞因子的分泌增强,从而触发免疫应答。在肿瘤内给药时,NaBiVO3-PEG可有效抑制原发肿瘤,抑制远处肿瘤和肿瘤转移。实时CT监测显示NaBiVO3-PEG静脉给药后,通过长期增强的通透性和滞留效应,在肿瘤微环境(TME)中出现了大量的水解产物,在肿瘤部位富集。因此,由于ROS对DNA损伤修复蛋白的显著下调,单一的强效免疫治疗或协同免疫RT等多方面的治疗以极低的毒性强烈抑制了肿瘤进展。综上所述,基于五价铋(V)的纳米平台在肿瘤免疫治疗中具有广阔的应用前景,可以激发高效的肿瘤特异性但独立的高价纳米药物。
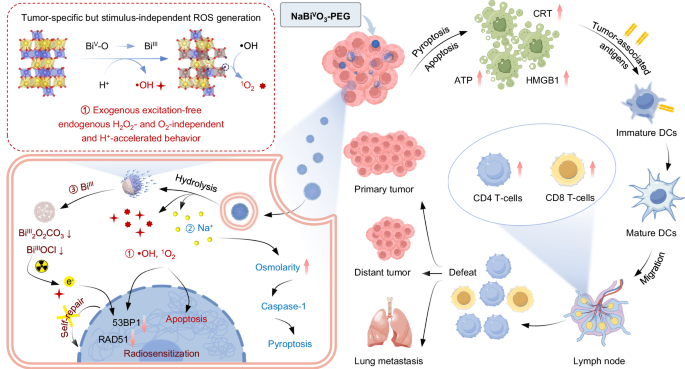
图1 用于肿瘤免疫治疗的无外源性兴奋性和内源性H2O2-和o2 -非依赖性NaBiVO3-PEG示意图(摘自Nature communications )
参考消息:
https://doi.org/10.1038/s41467-025-56110-7


