逆转衰老的密码藏在蛋白质里?《细胞》新研究:少吃它,全身器官可能“重置”年龄
时间:2025-11-03 12:12:46 热度:37.1℃ 作者:网络
你是否曾经幻想过,只需调整饮食,就能延缓衰老、保持年轻?这听起来像是科幻小说中的情节,但最新科学研究正一步步将这一梦想照进现实。2025年发表于《细胞》期刊的一项重磅研究,通过对小鼠41个器官、8个生命阶段的全面蛋白质组分析,揭示了“蛋白质限制饮食”如何在分子层面“重置”衰老进程,甚至逆转部分年龄相关的生理变化。今天,我们就来一起探索这项研究背后的科学故事,看看“少吃点蛋白质”是否真能成为我们对抗衰老的一把钥匙。

衰老:一场全身性的“分子叛变”
衰老不是单一事件,而是一场波及全身的“系统性危机”。从皮肤松弛到记忆减退,从代谢减缓到免疫功能下降,衰老几乎影响着我们身体的每一个角落。科学家早已提出衰老的“十二大标志”,包括基因组不稳定、端粒磨损、表观遗传改变、蛋白质稳态失衡等。然而,这些标志在不同器官中如何表现?它们之间又如何相互影响?这些问题一直是衰老研究中的“黑箱”。
更令人着迷的是,我们能否通过某种干预手段,延缓甚至逆转这些变化?饮食控制,尤其是“蛋白质限制”,近年来成为抗衰老研究的热门方向。早前的研究发现,限制蛋白质摄入可以激活一系列保护性信号通路,如胰岛素样生长因子1(IGF-1)和mTOR通路,从而延长模式生物的寿命。但这些发现多停留在整体层面或少数器官,蛋白质限制究竟如何在全身范围内“重塑”衰老?不同器官的反应是否一致?何时开始干预效果最佳?这些问题,正是本次研究试图回答的。
一场跨越生命周期的“蛋白质地图”测绘工程
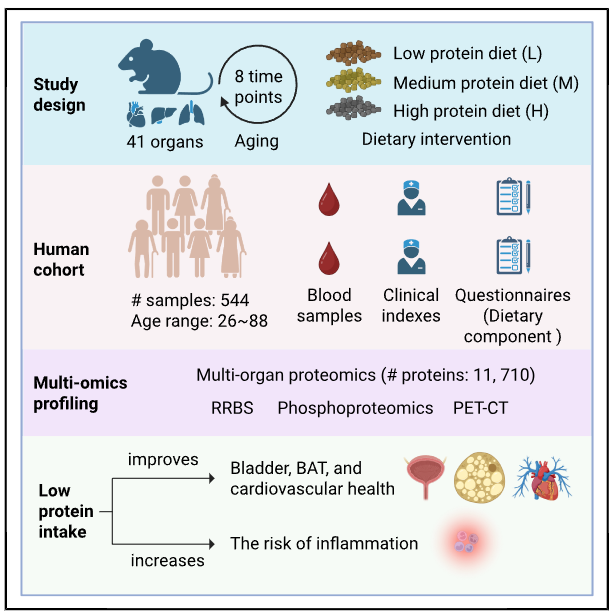
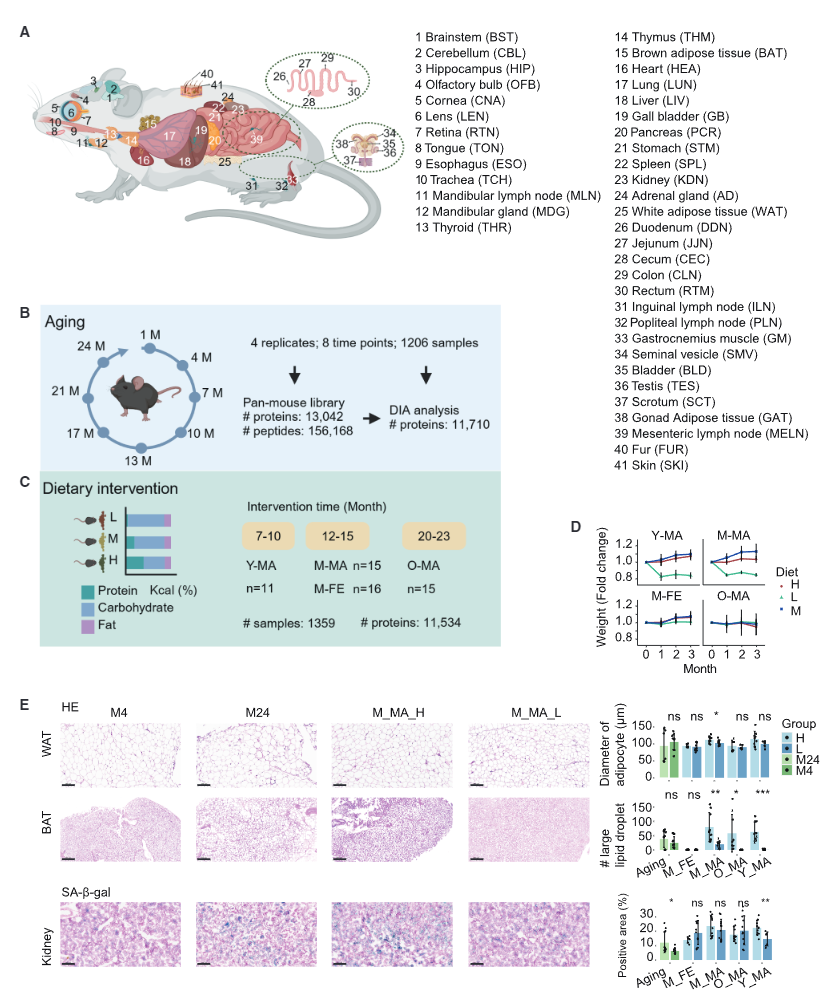
为了绘制出一张精细的“多器官衰老蛋白质地图”,研究团队进行了一场规模空前的实验。他们收集了小鼠从青春期到老年(1至24个月)共8个时间点的41种组织器官,涵盖了从大脑、心脏到淋巴结、膀胱等几乎全部关键系统。
更值得一提的是,他们在三个关键年龄段(青年、中年、老年)对小鼠进行了为期三个月的蛋白质限制干预,分别采用低蛋白(5%)、中蛋白(20.7%)和高蛋白(40%)饮食,以比较不同时机干预的效果差异。
在技术层面,研究采用了前沿的“数据非依赖性采集质谱技术”,对超过2,500个组织样本和近600个血浆样本进行了深度分析,量化了超过1.1万种蛋白质。此外,还结合了DNA甲基化测序、磷酸化蛋白质组学和病理学分析,构建出一幅多维度、全周期的衰老与干预响应图谱。
图文摘要
衰老不是同步的:器官之间的“时间差”
你有没有想过,你的肝脏和你的淋巴结,可能并不是以同样的速度在衰老?
研究发现,不同器官在衰老过程中表现出显著的“异质性”。例如,免疫器官(如脾脏、淋巴结)和生殖器官在衰老早期就出现大量蛋白质表达变化,而膀胱、肾脏等泌尿系统器官的变化则更多发生在中后期。脑区和免疫器官在蛋白质表达上形成了独特的“聚类”,说明它们在衰老过程中可能有共同的调控机制。
更有趣的是,研究人员发现了36种在至少9个器官中一致变化的“核心衰老蛋白”,其中包括多种免疫球蛋白和丝氨酸蛋白酶抑制剂。这些蛋白的变化甚至在小鼠仅1月龄时就开始出现,提示衰老的分子痕迹可能远比我们想象中更早出现。
蛋白质限制:不只是“少吃”,更是“巧吃”
那么,蛋白质限制饮食究竟是如何发挥作用的呢?研究发现,它并非简单地抑制衰老,而是通过“重新编程”多个关键生物学过程,实现对衰老的精准干预。
1. 逆转衰老蛋白表达
在低蛋白饮食的小鼠中,研究人员观察到热休克蛋白Hsp90ab1及其激活蛋白Ahsa1的表达在多个大脑区域和其他器官中被“挽救”回来。这两种蛋白是细胞应对应激、维持蛋白质稳态的关键角色。当它们在基因敲除实验中被抑制时,细胞出现衰老加速、凋亡增加和周期紊乱,进一步印证了它们在抗衰老中的核心地位。
2. 重塑表观遗传景观
衰老伴随着DNA甲基化模式的紊乱,而蛋白质限制能够显著缓解这一变化。在膀胱和肾脏中,低蛋白饮食逆转了多种肿瘤抑制基因的异常高甲基化,降低了与年龄相关的癌症风险标志物。这表明,蛋白质限制可能通过“重置”表观遗传时钟来延缓衰老。
3. 激活能量代谢开关
AMPK被称为细胞的“能量传感器”,在低蛋白饮食的小鼠中,多个器官的AMPK活性显著提升。特别是在棕色脂肪组织中,研究人员观察到葡萄糖转运蛋白Slc2a4的表达上升, glycogen synthase(Gys2)的磷酸化增强,提示细胞从储存能量转向燃烧能量。PET/CT成像也证实,低蛋白组小鼠的棕色脂肪活性更高,产热能力更强。
4. 促进脂肪“褐变”与代谢健康
白色脂肪的“褐变”是近年来代谢研究的热点。在低蛋白饮食组中,不仅棕色脂肪的产热关键蛋白Ucp1表达上升,白色脂肪中也出现了“褐变”迹象。同时,脂代谢关键酶(如Fasn、Acacb、Mgll)和胰岛素信号通路蛋白(如Insr、Slc2a4)的表达也同步上调,整体代谢健康得到显著改善。
研究设计及PR对衰老的影响
时机是关键:中年是干预的“黄金窗口”
你是否认为抗衰老越早开始越好?这项研究给出了一个反常识的答案:中年,可能是蛋白质限制干预的最佳窗口期。
研究发现,中年期(12–15个月,相当于人类45–50岁)开始低蛋白饮食的小鼠,在多个器官中表现出最显著的代谢改善与蛋白质表达逆转。相比之下,青年期干预效果较弱,而老年期干预虽有一定益处,但整体响应幅度下降。
此外,性别也在干预效果中扮演重要角色。例如,女性小鼠在低蛋白饮食后表现出更明显的心血管保护效应,而男性则在脂肪代谢改善方面更为突出。这提示我们,未来的抗衰老饮食策略可能需要“因人而异”。
从小鼠到人类:蛋白质限制的双面性
为了验证小鼠研究结果在人类中的适用性,团队分析了544名26–88岁成年人的血浆样本。结果显示,低蛋白摄入与较低的胰岛素、HbA1c和LDL-C水平相关,提示代谢与心血管健康的改善。IGF-1信号通路也在低蛋白人群中显著下调,这与小鼠中的发现高度一致。
然而,研究也发现了一个潜在风险:极端低蛋白摄入可能导致炎症反应上升。人类血浆中炎症标志物PTX3的表达与蛋白质摄入呈负相关,而抗炎蛋白SELENOP则随蛋白质减少而下降。这提示我们,蛋白质限制虽有益,但并非越低越好,平衡是关键。
未来之路:从“一刀切”到“精准抗衰老”
尽管这项研究为我们理解蛋白质限制的抗衰老机制提供了前所未有的视角,但仍有许多问题有待解答:
-
性别差异:本研究主要聚焦雄性小鼠,未来需更多关注雌性个体的响应机制。
-
长期效应:三个月的干预虽有效,但长期坚持是否安全?是否可持续?
-
个体化方案:如何根据基因背景、代谢状态、器官健康状况制定“量身定制”的蛋白质摄入建议?
-
组合策略:蛋白质限制能否与运动、药物或其他营养干预协同作用,实现“1+1>2”的效果?
我们离“饮食抗衰老”还有多远?
这项研究不仅为我们绘制了一幅精细的“多器官衰老地图”,更首次系统揭示了蛋白质限制如何在分子层面重塑衰老进程。它告诉我们:衰老不是不可逆的单行道,而是可以通过科学的饮食策略被“重新编程”的过程。
也许在不久的将来,我们不再需要盲目地追求“少吃”或“节食”,而是根据自身的生理状态与器官需求,精准调整蛋白质摄入的时机与比例,真正实现“吃出年轻”。
正如这项研究的领导者所说:“我们正站在一个新时代的门槛上——通过理解饮食与衰老的对话,重新定义人类的健康寿命。”
而这一切,或许就从你下一餐的蛋白质选择开始。


