Cancers:CAR-T细胞中的TNFRSF共刺激域
时间:2022-01-30 21:19:07 热度:37.1℃ 作者:网络
肿瘤坏死因子受体超家族(TNFRSF)是一个庞大而重要的免疫调节家族,为许多免疫效应细胞提供关键的共刺激信号。每一个共刺激TNFRSF成员在不同类型的细胞和免疫反应的不同阶段都有不同的表达谱和独特的功能影响。利用TNFRSF介导的信号传导进行肿瘤免疫治疗已成为一个重要的领域。
嵌合抗原受体(CAR)-T细胞治疗可能是过去十年免疫治疗中最重大的突破,随着CAR-T细胞技术越来越成熟,CAR结构的组成,特别是细胞内结构域也在不断进化。第一代(G1)CAR-T细胞结构包含肿瘤相关抗原的高亲和力单链抗体(scFv)、跨膜结构域和唯一的细胞内TCR-ζ或FcR-γ结构域。G1 的临床益处有限,主要是由于其增殖能力低和体内细胞毒性有限。为了克服这一缺点,第二代(G2)CAR结构配备了额外的细胞内共刺激结构域,最显著的是CD28或TNFRSF成员4-1BB。这些G2 CARs被证明是非常有效的,几种CAR-T产品在治疗血液瘤方面获得了监管部门的批准。
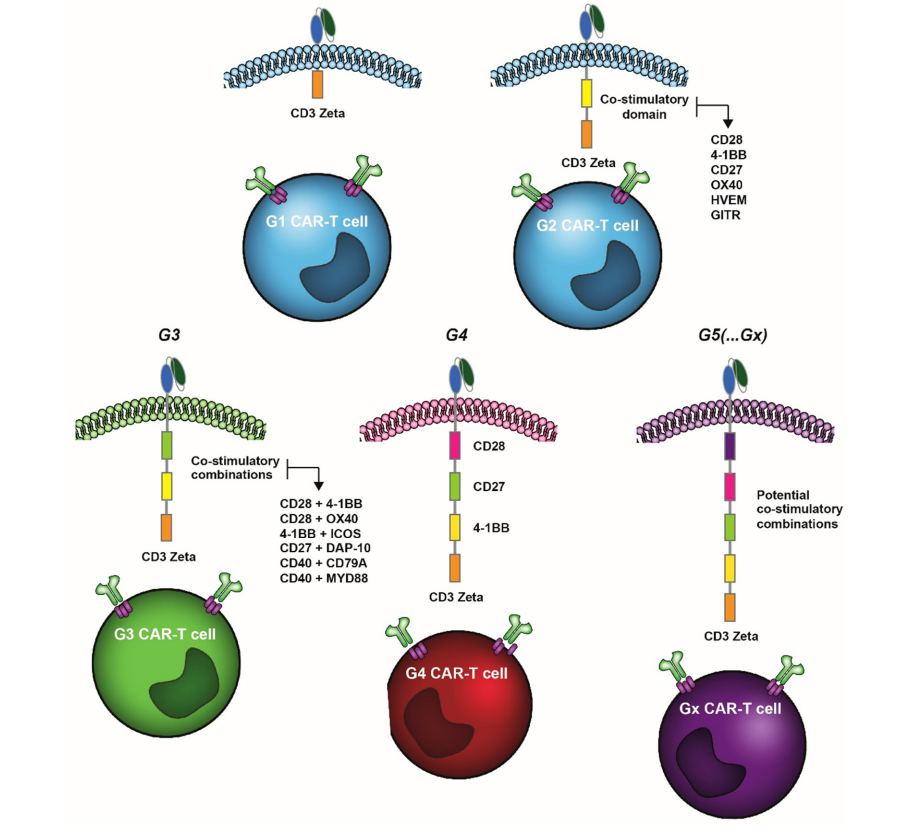
第三代(G3)CAR-T结构包含了共刺激结构域的组合,而第四代(G4)和第五代(G5)CAR-T细胞包含额外的共刺激结构域,在抗原识别时诱导表达细胞因子(例如IL-12),或包含某些细胞因子受体的细胞内结构域(例如,截短的IL-2受体β链和STAT3结合部分)。在此,我们来一起回顾了TNFRSF的细胞内共刺激结构域在增强和调节CAR-T细胞活性方面的应用。
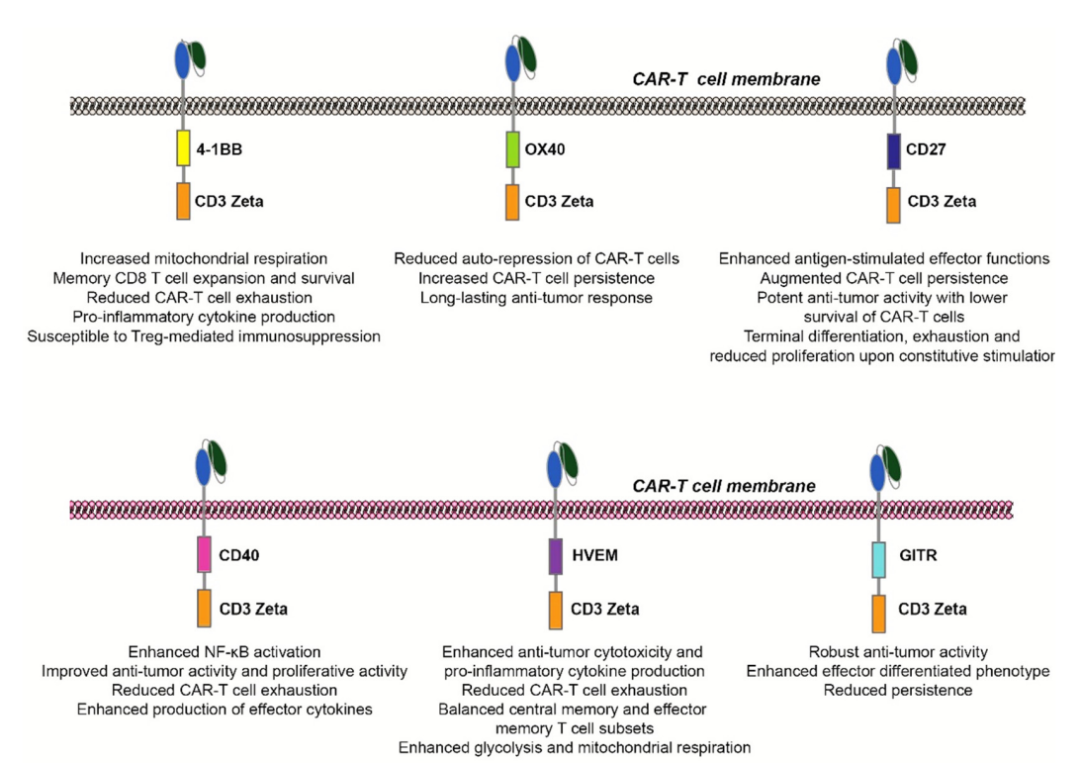
4-1BB的共刺激结构域4-1BB是一种关键的共刺激受体,在TCR-MHC相互作用时的T细胞上快速上调。其配体4-1BBL在抗原呈递细胞(如巨噬细胞和树突状细胞)上表达。4-1BBL与4-1BB的结合导致TRAF1、TRAF2和TRAF3向4-1BB的胞内结构域募集。随后,形成了包含多种蛋白质(包括激酶和泛素连接酶)的4-1BB信号复合体,并最终启动关键信号通路,如NF-kB和PI3K-AKT。最终,4-1BB信号诱导细胞毒性T细胞的增殖、促炎细胞因子的分泌以及效应和记忆T细胞(Tm)的扩增。
4-1BB的细胞质信号结构域是CAR-T细胞结构中应用最早、探索最多的TNFRSF成员。与CD28 CAR-T细胞相比,4-1BB共刺激产生具有明显代谢特征的CAR-T细胞,如T细胞表面GLUT1表达减少和线粒体呼吸增加。这些差异也反映在CAR-T细胞表型和功能上。例如,CD19靶向CAR-T细胞中的4-1BB共刺激在小鼠模型中产生了更有效的B-ALL清除,并且4-1BB CAR-T比CD28共刺激的CAR-T细胞持续时间更长。
目前,共有三种使用了4-1BB的CAR-T细胞产品,即Tisagenelecluel(Kymriah)、Liscabatagene-Maraluel(BREYANZI)和Idecabatgene-Vicluel(ABECMA),已获得FDA批准。Tisagenlecleucel是一种CD19靶向G2 CAR-T细胞,在93例DLBCL患者进行的临床试验中,其产生了强大的药效(52%,ORR;40%,CR;12%,PR)。此外,观察到强烈但可控的3级或4级副作用,如89.7%的患者出现可逆性细胞因子释放综合征(CRS),9名患者出现可逆性神经精神事件(31%)。
Liscabatagene-Maraluel是另一种CD19靶向的G2 CAR-T细胞产品,含有4-1BB结构域,额外表达表皮生长因子受体(EGFR)的截断版本。这种设计考虑到安全性,在需要时,可以使用Cetuximab清除CAR-T细胞。在对256例复发或难治性大B细胞淋巴瘤患者进行的临床试验中,其ORR和CR分别为73% 和53%。
第三种4-1BB CAR-T细胞产品IdecabtageneVicluel是FDA批准的第一种治疗多发性骨髓瘤的CAR-T细胞疗法,其靶向多发性骨髓瘤细胞上表达的B细胞成熟抗原(BCMA)。在难治性和复发性多发性骨髓瘤(rrMM)患者中的II期临床试验中,其ORR为73%,CR达到33%,26%的患者达到了最小残留病灶(MRD)阴性状态。此外,在另一项3期研究(NCT03651128)中,与标准治疗相比,Idecabtagene显著改善了ORR(76.4% vs 32.2%)、PFS(11.6vs 3.5个月)和OS(20.2 vs 14.7个月)。
为了将T细胞效应器功能与T细胞记忆诱导结合起来,并实现更持久的临床反应,已经开发出包含CD28和4-1BB共刺激结构域的G3CAR-T结构。与G2 CAR-T细胞相比,G3 CAR-T细胞的治疗触发了重要细胞内信号分子(如LAT、ZAP-70、SYK和ERK)的更多磷酸化。因此,G3 CAR-T细胞产生更多的IL-2,具有更高的增殖能力和更好的体内持久性。
几项研究探索了4-1BB G3 CAR-T细胞的临床应用,在四名复发性惰性B细胞或套细胞淋巴瘤(MCL)患者中进行了一项小型试验,以测试针对靶向CD20的CD28和4-1BB G3CAR-T细胞的安全性,该试验证明其总体上安全且耐受性良好。值得注意的是,其中2名患者CR,并且在12个月和24个月内没有进展,即使在输注后1年,血液中也能检测到CAR-T细胞。此外,针对其他靶点的G3 CAR-T细胞也进行了评估。例如,前列腺癌靶抗原(PSMA)G3 CD28和4-1BB CAR-T细胞也显示出强大的抗肿瘤活性。
总之,在CAR-T细胞结构中加入4-1BB共刺激结构域可改善CAR-T细胞的体内持久性,增强记忆形成,并降低耗竭标记物的表达。在结合4-1BB和CD28共刺激的G3 CAR-T细胞构建中,与G2 CAR-T细胞相比,获得了更高的增殖能力和更好的体内持久性。并且迄今为止发现CD28和4-1BB G3 CAR-T细胞安全且耐受性良好。然而,考虑到CAR-T细胞应用中的某些共刺激结构域用于治疗特定类型的癌症,因此,在得出明确结论之前应小心谨慎。
OX40的共刺激结构域另一个被探索作为CAR-T细胞共刺激剂的TNFRSF成员是OX40。OX40仅在MHC-TCR参与时在T细胞上上调,OX40信号增加T细胞的持久性并诱导记忆性T细胞(Tm)的形成。OX40信号还触发克隆扩增并上调抗凋亡蛋白的表达,如Bcl-2、Bcl-xL和Bfl-1,从而促进活化T细胞的存活。
OX40和4-1BB在功能上有许多相似之处,但它们在调节CD4+和CD8+T细胞反应方面存在明显的活性差异。OX40和4-1BB实际上在腺病毒感染时调节CD8+ T细胞克隆扩增方面具有相反的作用,OX40缺陷的CD8+T细胞显示CD8+T细胞扩增减少,而4-1BB缺陷的CD8+T细胞实际上表现出高反应性,导致CD8+T细胞数量增加。此外,T细胞分化为功能性效应细胞需要OX40,而4-1BB导致启动早期分化水平降低。
与CD28 G2 CAR-T相比,OX40G2 CAR-T细胞产生更多IFN-γ、同等水平的IL-2和类似的CAR-T细胞增殖反应。更重要的是,OX40 G2 CAR-T细胞产生的IL-10水平显著降低。相应地,与CD28 G2 CAR-T细胞相比,针对癌胚抗原(CEA)的G3 CAR-T细胞中CD28与OX40的联合刺激降低了IL-10的水平,并阻止了CAR-T细胞的自动抑制。此外,CD28/OX40共刺激使CAR-T细胞在重复抗原结合时免于激活诱导的细胞死亡。
许多早期证据表明OX40是一种很有希望用于CAR-T细胞的共刺激结构域。它能防止自身抑制,拯救活化诱导的细胞死亡,以及优越的细胞毒性活性。目前,靶向双唾液酸神经节苷脂(GD2)阳性实体癌(如黑色素瘤、神经母细胞瘤、骨肉瘤和一些其他肉瘤)的CD28/OX40CAR-T细胞是正在治疗转移性黑色素瘤的临床试验(NCT02107963)中进行评估。
CD27的共刺激结构域CD27的表达存在于CD4+和CD8+T细胞、NK细胞和启动的B细胞上。CD27的配体CD70在抗原呈递细胞上表达,包括DC和巨噬细胞。在激活T细胞上的CD27后,下游信号通过NF-κB诱导激活,导致T细胞活化、分化和克隆扩增。
与G1 CAR T细胞相比,在SKOV3人卵巢癌细胞-小鼠模型中,CD27 G2 CAR-T细胞具有增强的抗原刺激效应器功能、上调抗凋亡蛋白的表达、增强的体内持久性和增强的肿瘤消退。在该模型中,CD27 G2 CAR-T细胞和4-1BB或CD28 G2 CAR-T细胞之间未观察到差异。然而,与CD28介导的共刺激相比,CD27共刺激增强了CAR-T细胞的持久性。
临床上,在34例神经母细胞瘤患者中,以GD2为靶向的CD27/CD28 CAR-T细胞治疗产生15%的PR和38%的SD,一年生存率为74%。在另一项最近关于CD27/CD28 CAR-T细胞的临床研究中,CLL1靶向CAR-T细胞在AML患者中被证明是安全的。令人印象深刻的是,在这项研究的四名患者有3名显示CR,MRD阴性,可以继续进行造血干细胞移植(HSCT)。这些患者的副作用仅限于1至2级CRS。
值得注意的是,激活CD27也可诱导CD8+T细胞的终末分化、耗竭和凋亡。事实上,IL13Rα2靶向的G2 4-1BB CAR-T细胞表面组成性表达的CD27分子大大减少了CAR-T细胞的增殖,并诱导其耗竭和凋亡。
总之,CD27介导的共刺激可以增强不同的CAR-T细胞特征,如CAR-T细胞的持久性和细胞毒性。临床上,CD27/CD28共刺激组合在神经母细胞瘤、AML和淋巴瘤患者中产生了令人印象深刻的反应。然而,在CAR-T细胞结构中,CD27和其他共刺激分子的组合也应仔细考虑,以避免终末分化和耗竭。
CD40的共刺激结构域CD40在髓源性抗原呈递细胞上表达,如树突状细胞(DC)、粒细胞和巨噬细胞。CD40配体(CD40L)主要在活化的T细胞和NK细胞上表达。在APC上,CD40与CD40L的结合激活抗原呈递和共刺激信号,从而促进细胞毒性T细胞的激活和扩增。
在最初的研究中,无论是G2型还是带有CD28结构域的G3型,CD40或4-1BB CAR-T细胞之间的抗原特异性靶细胞杀伤均未观察到差异。然而,与4-1BB共刺激相比,CD40共刺激确实触发了更强的NF-κB激活。
为了增强共刺激信号,CD40 CAR-T细胞已与CAR结构中的其他共刺激分子结合,例如与B细胞信号部分的CD79A结合,这两种受体都激活下游的NF-κB、NFAT和AP-1信号。与CD28或4-1BB共刺激的CAR-T细胞相比,CD79A/CD40CAR-T细胞在体外与CD19表达细胞共培养时,NF-κB和p38活性升高,增殖更多。在接种Raji肿瘤细胞的小鼠中,与CD28或4-1BB共刺激的CAR-T细胞相比,CD79A/CD40共刺激的CAR-T细胞也具有更好的抗肿瘤活性和增殖活性。
HEVM和GITR的共刺激结构域HVEM和GITR最近也被纳入到CAR-T细胞结构中。HVEM具有免疫刺激和免疫抑制功能,并与配体CD160、BTLA、LIGHT和LTα相互作用。HVEM在各种免疫细胞上表达,包括T细胞、B细胞、NK细胞和树突状细胞。HVEM与LIGHT或LTα的结合导致T细胞活化和增殖,而HVEM与T细胞表达的BTLA的结合抑制T细胞活化。此外,HVEM还调节CD8+T细胞的效应器和记忆形成。
到目前为止,HVEM作为CAR-T细胞的共刺激结构域仅被报道过一次,与对照CD28或4-1BB G2 CAR-T细胞相比,HVEM G2 CAR-T细胞表现出增强的抗肿瘤细胞毒性和促炎细胞因子生成,例如IL-2、TNF-α和IFN-γ。此外,HVEMG2 CAR-T细胞中的CAR-T耗竭降低,并且检测到Tcm和Tem细胞的等效百分比。相比之下,在CD28和4-1BB CAR-T细胞中,Tem和Tcm亚群分别高度富集。因此,HVEM G2 CAR-T细胞似乎产生了更平衡的CAR-T细胞表型。有趣的是,在体外的HVEM CAR-T细胞中检测到糖酵解和线粒体呼吸水平增强。因此,HVEM共刺激似乎增加了能量代谢,这一特征与T细胞耗竭减少正相关。
CAR-T共刺激域的另一个TNFRSF成员是GITR。与4-1BB或OX40不同,GITR在T细胞上呈组成性表达,在CD4/CD25/Foxp3阳性Treg上的表达高于幼稚或记忆性T细胞。此外,在TCR激活后,效应T细胞上GITR的表达上调。GITR激动剂抑制Treg的抑制活性并提高效应T细胞的存活率。
在EGFR靶向的CAR-T细胞中,GITR共刺激产生的抗肿瘤活性与各种肿瘤细胞系中CD28或4-1BB G2 CAR-T细胞相当,甚至更强。靶向CD19的GITR G2 CAR-T细胞在体内也显著抑制了Raji肿瘤细胞的生长。此外,与共刺激CAR-T结构域DAP-10、CD28、4-1BB、ICOS和OX40相比,GITR共刺激在T细胞淋巴瘤和黑色素瘤模型体内表现出更强的细胞毒性。然而,与CD28 CAR-T细胞相比,GITR共刺激确实减少了TNF-α、IL-2和Th17相关细胞因子的分泌,并诱导了更分化的效应器表型,同时降低了体内持久性。
总结与展望在CAR-T细胞中添加的各种TNFRSF成员的共刺激域中,不同的TNFRSF成员之间具有明显优势和劣势。显然,通过选择和/或组合不同的共刺激域,可以极大地影响和驱动CAR-T细胞的效果。
在这方面,在最近的比较中,临床产品中通常使用的CD28和4-1BB共刺激结构域明显优于其它共刺激结构域,包括OX40、ICOS或CD27。因此,进一步工程化CAR-T细胞的细胞内结构域可能产生增强的功能。例如,OX40共刺激结构域类似于4-1BB,可用于增强CAR-T细胞的持久性,但与CD28共刺激结构域相比,其对效应器功能的激活减少。GITR共刺激结构域可用于驱动效应器功能,但与CD28一样,与持久性降低有关。此外,在激发持久的抗癌反应方面,OX40共刺激被证明优于4-1BB共刺激,而CD40 CAR-T细胞似乎对内源性免疫也有强烈的刺激作用。
特别是,G3或G4 CAR-T细胞中不同共刺激结构域的组合可能产生额外的临床益处,因为不同的CAR-T细胞功能可以组合以产生协同活性。例如,通过结合CD28和OX40共刺激结构域,早期效应器表型与持久性和持久性抗肿瘤反应相结合,优于CD28/4-1BB结合的CAR-T细胞。在另一种G3 CAR-T细胞方法中,CD28分别结合4-1BB和CD40的共刺激,后者显示出最有效的共刺激效应。
此外,除了确定要选择CAR-T细胞结构中TNFRSF家族的哪个成员外,还应注意ICD结构域的顺序、要选择哪个跨膜结构域以及铰链/间隔区的设计。共刺激域在CAR结构中的定位可以极大地影响CAR-T细胞的功能,并决定是否可以从共刺激域获得额外的益处。
最后,还要考虑TME的影响。最近的研究表明,用环磷酰胺预处理可有效地修饰免疫抑制性TME,从而在转移性前列腺癌和胰腺癌模型中产生靶向PSCA的4-1BB CAR-T细胞的持久治疗反应。此外,调节CAR-T也可能有助于修饰TME,OX40 G2 CAR-T细胞产生的抗炎分子IL-10水平明显低于CD28 G2 CAR-T细胞。与CD28 G2 CAR-T细胞相比,G3 CAR-T细胞中的CD28联合OX40刺激也降低了IL-10水平,并阻止了CAR-T细胞的自动抑制。因此,CD28和OX40联合刺激可能适用于靶向免疫抑制TME的CAR-T细胞。
不同TNFRSF成员的不同作用仍在探索中,我们对这一独特家族的理解可能还存在差距。尽管如此,这些成员的全部潜力被释放只是时间问题,无论是单独还是与其他TNFRSF成员联合使用。很明显毫无疑问,在下一代CAR-T细胞中,TNFRSF成员将继续发挥核心、多样和重要的作用。
参考文献:
1. The Implementation of TNFRSF Co-StimulatoryDomains in CAR-T Cells for Optimal Functional Activity. Cancers (Basel). 2022Jan; 14(2): 299.


