慢性血栓栓塞性肺动脉高压血管平滑肌细胞增殖和迁移相关新基因的鉴定
时间:2021-12-05 19:01:31 热度:37.1℃ 作者:网络

慢性血栓栓塞性肺动脉高压 (CTEPH) 是一种危及生命的疾病,其特征是近端肺动脉被管腔内血栓和纤维狭窄闭塞,导致远端肺动脉血管重塑。尽管 CTEPH 患者会出现肺血栓栓塞,但越来越多的临床证据表明肺动脉高压的发生和发展与血管闭塞没有直接关系。事实上,通常与 CTEPH 相关的最终病理变化,包括内膜增厚、丛状病变和肺动脉平滑肌细胞 (PASMC) 增殖,类似于与其他类型肺动脉高压相关的小肺动脉重塑的变化。此外,PASMC 增殖和迁移的变化在肺动脉重塑和决定 CTEPH 进展中起着重要作用。最近的工作表明肾素-血管紧张素系统调节 CTEPH 中的 PASMC 迁移,并且 EZH2 在 CTEPH PASMC 中高表达并促进它们的迁移。然而,在 CTEPH 中引起肺动脉血管重塑的细胞事件尚未完全阐明。
在这里,我们试图使用双管齐下的方法更全面地了解 CTEPH 血管重塑。首先,我们利用从基因表达综合 (GEO) 下载的公开可用微阵列数据来筛选 CTEPH 和对照样本之间的所有差异表达基因 (DEG)。我们在生物信息学方法中使用这些 DEG 来识别在 CTEPH 中运行的潜在差异功能和途径。其次,我们评估了关键基因、肿瘤坏死因子 (TNF)-α 和 FOS 对取自 CTEPH 患者和对照组的原代血管平滑肌细胞 (VSMC) 增殖和迁移的影响。肿瘤坏死因子α (TNF-α) 是一种具有多种功能的细胞因子。 TNF-α 信号通过两种结构相关的受体发生,包括可溶性肿瘤坏死因子受体 1 (sTNFR1) 和可溶性肿瘤坏死因子受体 2 (sTNFR2)。 TNF-α 以前与血管重塑有关。 FOS 调节细胞增殖和迁移,并在某些心血管疾病中上调。最近的研究表明 FOS 参与了闭塞性肺血管重塑。然而,TNF-α 和 FOS 在 CTEPH 中的作用尚未完全阐明。我们的结果揭示了 CTEPH 发展的分子机制,并可能为未来的实验研究和潜在治疗的设计提供信息。
研究方法:
从基因表达综合 (GEO) 下载 CTEPH 患者和健康对照的微阵列数据 (GSE130391),并筛选差异表达基因 (DEG)。使用基因本体论 (GO) 功能分析和京都基因和基因组百科全书 (KEGG) 通路分析对 DEG 进行功能注释。构建了蛋白质-蛋白质相互作用(PPI)网络来识别枢纽基因。最后,从 CTEPH 患者 ( n = 10) 和对照 ( n = 10)中采集肺动脉样本,并培养原代血管平滑肌细胞 (VSMC)。使用表达和敲低研究评估原癌基因 FOS 对 VSMC 增殖和迁移的影响。
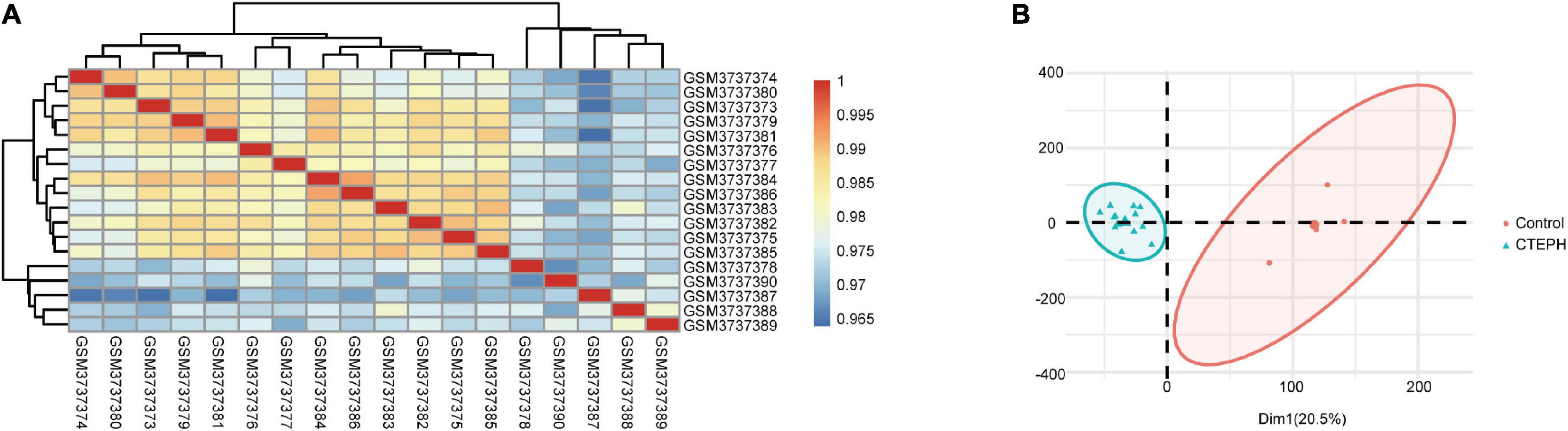
通过 Pearson 相关分析和 PCA 对 GSE130391 进行的样本内数据重复性测试(图上)。
研究结果:
我们共检测到 292 个 DEG,包括 151 个上调基因和 141 个下调基因。GO 分析揭示了 DEG 在信号转导、脂多糖反应、信号转导和髓样树突细胞分化的生物过程中的富集。
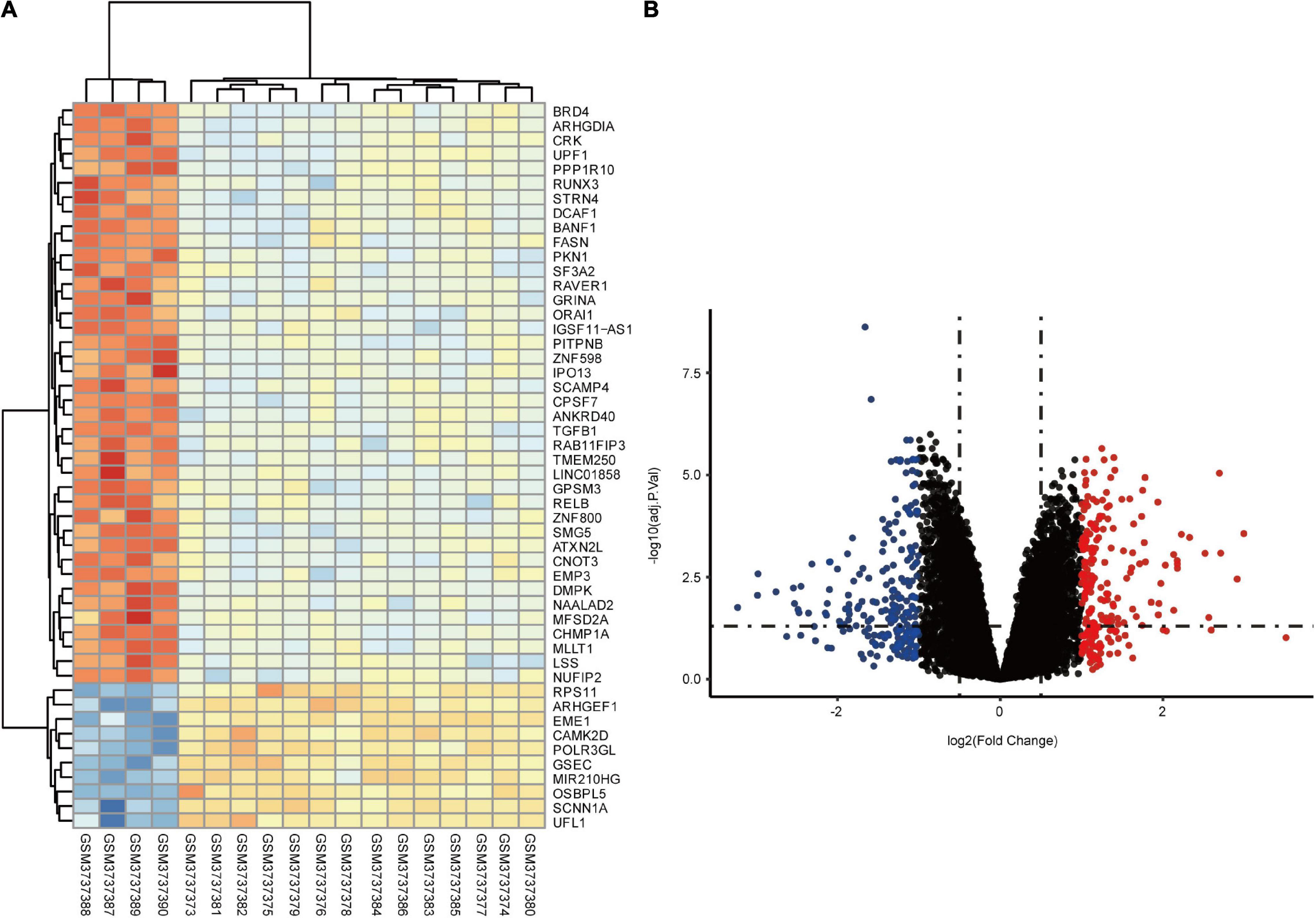
分子功能分析揭示了肿瘤坏死因子 (TNF) 激活的受体活性、转录激活剂活性和蛋白质同二聚化活性的富集。与对照组相比,CTEPH组TNF-α及其受体(sTNFR1和sTNFR2)的表达显着升高。KEGG 通路分析揭示了沙门氏菌感染、癌症通路、破骨细胞分化和细胞因子-细胞因子受体相互作用的富集。
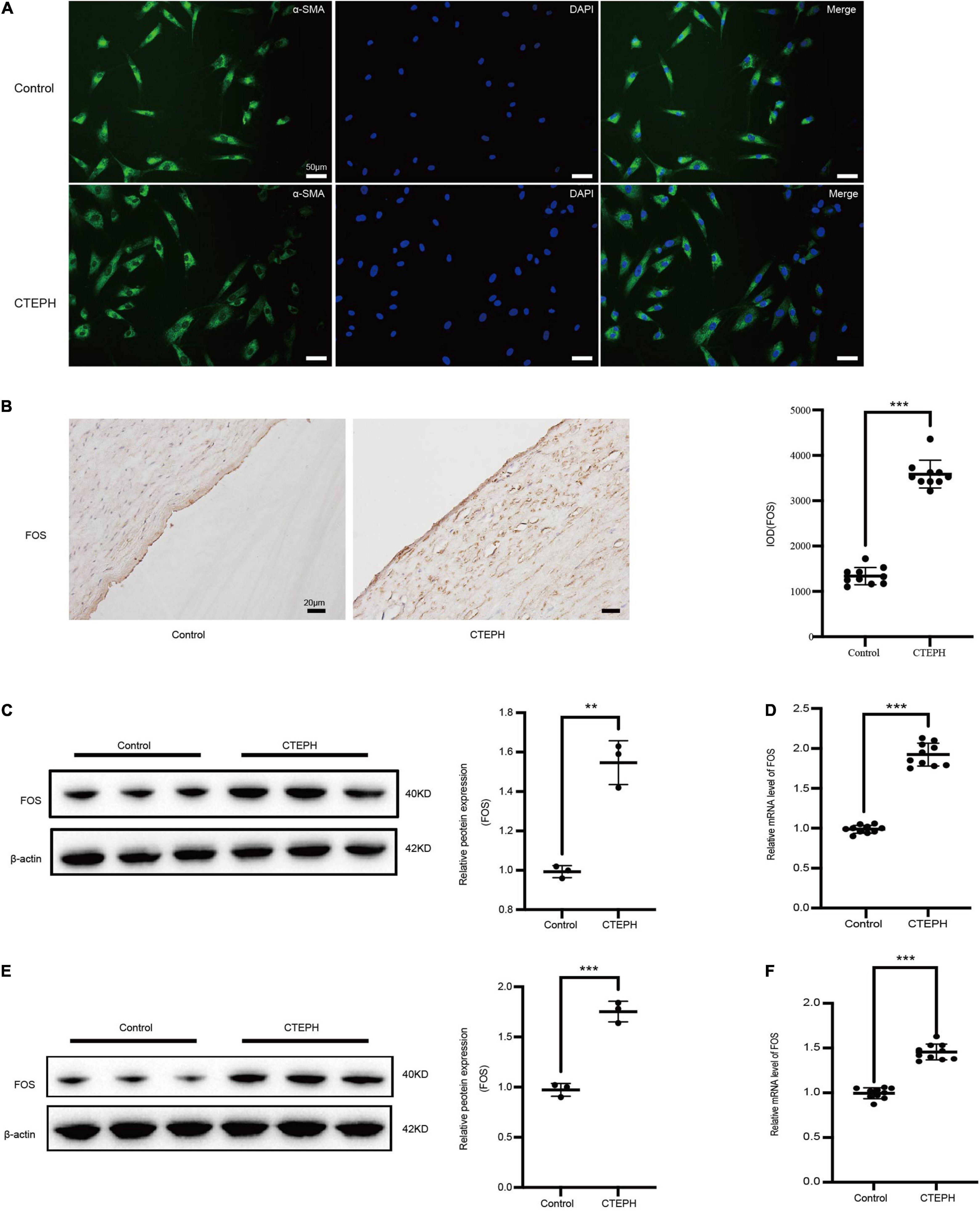
PPI 中的 Hub 基因包括 FOS,表明该基因在 CTEPH 的血管重塑中起重要作用。来自 CTEPH 患者的原代 VSMC 表现出增加的 FOS 表达和高增殖和迁移,这被 FOS 抑制减弱。在对照 VSMC 中,TNF-α 处理增加了增殖和迁移,而 FOS 抑制同样减弱。
总之,该研究表明,TNF-α 通过增加 FOS 表达促进 VSMC 的增殖和迁移,从而参与 CTEPH 的发病机制。这些结果表明 TNF-α 通路可能在 CTEPH 的血管重塑中起关键作用。他们还将 FOS 和 TNF-α 确定为预防血管重塑的潜在治疗靶点。研究显示了对照和 CTEPH 血管组织之间明显的转录组差异,例如 FOS 和 PCNA 在 CTEPH 样本中被上调。这些 RNA 的表征可能为理解 CTEPH 的诊断、进展和治疗提供新的目标。
文献出处:
Wang F, Sun C, Lv X, Sun M, Si C, Zhen Y, Guo J, Sun W, Ye Z, Wen J, Liu P. Identification of a Novel Gene Correlated With Vascular Smooth Muscle Cells Proliferation and Migration in Chronic Thromboembolic Pulmonary Hypertension. Front Physiol. 2021 Nov 11;12:744219. doi: 10.3389/fphys.2021.744219. PMID: 34858201; PMCID: PMC8632225.


