IJN:锐钛矿和金红石型纳米TiO2通过IGF-1信号通路诱导幼龄大鼠发生骨损伤
时间:2021-12-02 19:01:48 热度:37.1℃ 作者:网络

二氧化钛(TiO2)纳米颗粒广泛应用于食品、医疗产品、玩具上的白色油漆和个人护理产品等各个行业。在食品工业中,TiO2被用作食品增白添加剂,其中36%是TiO2纳米颗粒(粒径小于100 nm)。因此,许多食品中都添加了TiO2纳米颗粒,如脱脂牛奶、糖果和糖粉,所有这些儿童都会食用。随着纳米技术的不断提高,一项研究估计,儿童每天从各种产品中摄取约1-2mg/kg的TiO2纳米颗粒。因此,儿童是每天摄入剂量TiO2纳米颗粒最大的特殊人群。
越来越多的证据表明,纳米TiO2可以通过不同的途径被吸收。作为着色剂,纳米TiO2已被归类为2B类致癌物质。此外,欧洲食品安全局(EFSA)认为纳米TiO2对人体产生危害。因此,必须进一步评估纳米TiO2对人体健康的潜在危害。先前的研究发现,纳米TiO2可以在肝脏、肾脏和肠道中蓄积,造成毒性损害。然而,很少有研究探讨纳米TiO2对骨组织的影响。
纳米二氧化钛分为三种晶体类型:板钛矿型、锐钛矿型和金红石型。晶体类型对TiO2纳米颗粒的毒性有重要影响。锐钛矿型和金红石型纳米二氧化钛是仅有的商用晶体类型,这两种晶体类型都已批准用于食品。锐钛矿型TiO2纳米粒子比金红石型TiO2纳米粒子更广泛地应用于食品和其他工业中,因为前者比金红石型TiO2纳米粒子更软、更耐磨损。氧化能力方面,锐钛矿型TiO2纳米粒子比金红石型TiO2纳米粒子造成更严重的细胞损伤。然而,关于哪种二氧化钛纳米颗粒毒性更大的问题仍然存在争议。此外,只有少数研究探讨了锐钛矿型和金红石型TiO2纳米粒子对骨组织的毒性。
骨骼生长对儿童至关重要。纵向骨生长与儿童身高密切相关。骨量也是影响骨骼生长的重要因素。儿童期是骨骼积累的最重要时期,骨量在此期间迅速增加。一些研究还表明,环境因素可能会影响儿童时期的骨量和骨生长。Xu等发现,环境中的纳米材料可以损害幼鼠的骨组织。儿童比成年人更容易接触到纳米TiO2颗粒。然而,不同晶型的纳米TiO2,如锐钛矿型和金红石型,对骨骼,特别是儿童的毒性尚未得到评估。
与过去相比,现在的人们更关注发育迟缓和身材矮小。据报道,身材矮小的儿童胰岛素样生长因子-1(IGF-1)水平较低。 IGF-1由肝脏分泌,是调节骨骼细胞增殖和分化的重要生长因子。 IGF-1可以影响儿童时期的骨量和纵向生长。IGF-1水平低会导致骨骼长度缩短和骨量减少,进而导致体长缩短。在本研究中,我们进一步探讨了不同晶型的纳米TiO2是否会影响IGF-1。根据以往的报道,护骨素/核因子受体激活剂-κB配体(RANKL)/组织蛋白酶K(CTSK)通路与骨损伤密切相关。此外,IGF-1水平降低可导致OPG表达下降。因此,我们推测骨生长可能与血清IGF1和OPG/RANKL/CTSK通路有关。因此,我们重点研究了锐钛矿型和金红石型TiO2纳米颗粒对幼年大鼠骨生长的影响,并探讨了可能与IGF-1/OPG/RANKL/CTSK途径有关的可能机制。
方法:后代在出生后进行母乳喂养。断乳前,15只雄性幼鼠随机分为3组(n=5):对照组、锐钛矿型TiO2纳米颗粒组和金红石型TiO2纳米颗粒组(锐钛矿型和金红石型TiO2纳米颗粒染毒组,统称为暴露组)。他们在一个恒温25摄氏度的房间里被观察,有12小时的明暗周期,并有足够的水和食物。本研究以三周龄大鼠为实验对象。Weir等人估计,美国儿童每天摄入的二氧化钛纳米颗粒的最大摄入量为2mg/kg体重。根据人和实验动物药物剂量交换算法,大鼠的暴露剂量是人的100倍。因此,暴露组大鼠的灌胃剂量选择为200 mg/kg。对照组给予等体积超纯水治疗。染毒28天后,幼鼠用乙醚麻醉。很快摘除了眼球,并从眼静脉采集了血液样本。血液离心收集血清样品,−80°C保存,胫骨用中性组织固定剂固定。评估大鼠生长发育、肝功能、骨代谢和胰岛素样生长因子-1(IGF-1)水平。采用微型计算机断层扫描(Micro-CT)和免疫组织化学方法对胫骨进行评价。
结果:幼年大鼠生长发育指标差异不显著。在IGF-1水平、磷水平和肝功能方面有显著差异。显微CT显示骨质疏松症。Micro-CT数据支持同样的结果。骨免疫组织化学结果显示,骨保护素表达减少,核因子受体激活剂κB配体和组织蛋白酶K表达增加。

图1 纳米二氧化钛的表征。(A)锐钛矿型TiO2纳米粒子的透射电镜图像。(B)金红石型TiO2纳米粒子的透射电镜图像。(C)锐钛矿型TiO2纳米粒子的SEM图像。(D)金红石型纳米二氧化钛的扫描电镜图像。(E)锐钛矿型TiO2纳米粒子的粒径分布百分比。(F)金红石型TiO2纳米粒子的粒径分布百分比。
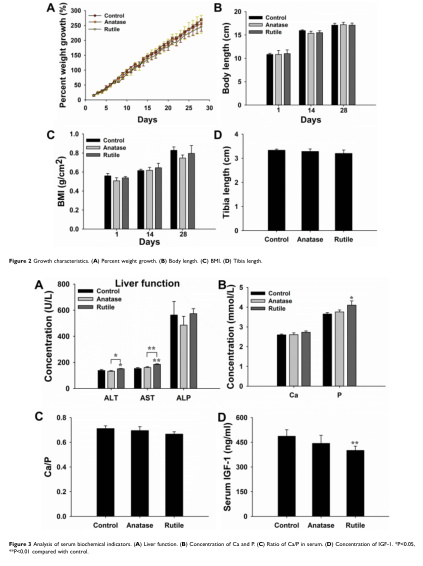
图2 血清生化指标分析。(A)肝功能。(B)钙、磷浓度。(C)血清Ca/P比值。(D)IGF-1浓度。*与对照组比较,**P<0.05,**P<0.01。
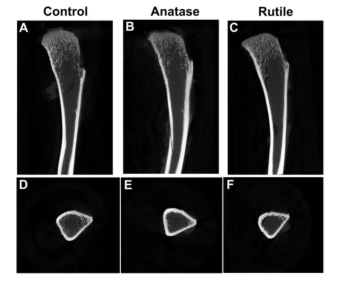
图3 未重建的胫骨图像。(A)对照组的骨矢状位图像。(B)锐钛矿型TiO2纳米粒组的骨矢状位图像。(C)金红石型TiO2纳米粒组的骨矢状图。(D)对照组骨骼横断面图像。(E)锐钛矿型TiO2纳米粒组的横断面图像。(F)金红石型TiO2纳米粒组的横断面图像。
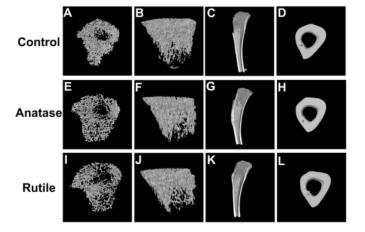
图4 胫骨的三维图像。(A)对照组骨小梁横断面图像。(B)对照组松质骨整体影像。(C)对照组的骨矢状位图像。(D)对照组皮质骨横断面图像。(E)锐钛矿型TiO2纳米粒组的骨小梁横断面图像。(F)锐钛矿型TiO2纳米粒组的骨小梁整体图像。(G)锐钛矿型TiO2纳米粒组的骨矢状位图像。(H)锐钛矿型TiO2纳米粒组皮质骨横断面图像。(1)金红石型TiO2纳米粒组骨小梁横断面图像。(J)金红石型TiO2纳米粒组松质骨整体图像。(K)金红石型TiO2纳米粒组的骨矢状位图像。(L)金红石型TiO2纳米粒组皮质骨横断面图像。
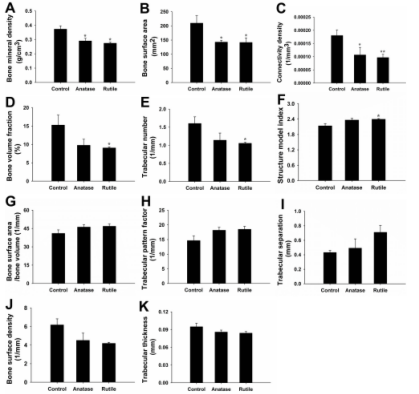
图5 骨小梁的形态学数据。(A)骨密度(BMD,g/cm3)。(B)骨表面积(BS,mm2)。(C)连接密度(Conn.Dn,1/mm3)。(D)骨体积分数(BV/TV,%)。(E)T小梁数(Tb.N,1/mm)。(F)结构模型指数(SMI)。(G)骨表面积/骨体积(BS/BV,1/mm)。(H)T小梁模式因子(Tb.Pf,1/mm)。(I)T小梁分离(Tb.Sp,mm)。(J)骨表面密度(BS/TV,1/mm)。(K)T小梁厚度(Tb.Th,mm),与对照组比较*P<0.05,**P<0.01
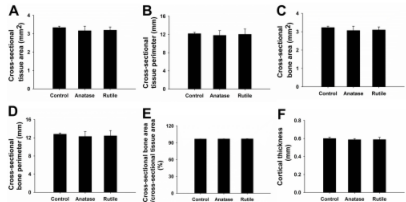
图6 骨皮质的形态学数据。(A)组织横截面积(T.Ar,mm2)。(B)组织横截面周长(T.pm,mm)。(C)骨横截面积(B.Ar,mm2)。(D)骨横截周长(B.Pm,mm)。(E)横截面骨面积/横截面组织面积(B.Ar/T.Ar,%)。(F)皮质厚度(Ct.Th,mm)。
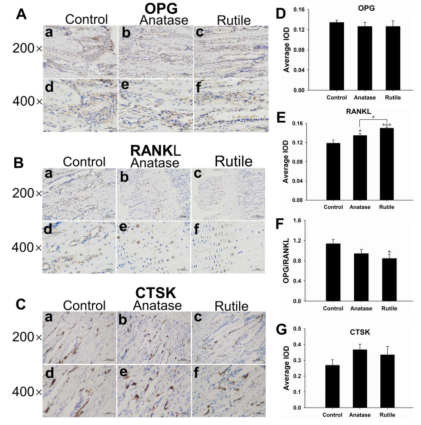
图7 骨免疫组化染色结果。(A)OPG在成骨细胞(200×、400×)中的表达呈棕黄色。(B)RANKL在成骨细胞(200×、400×)中呈棕黄色表达。(C)破骨细胞(200×、400×)CTSK表达呈棕黄色。(D)各组胫骨标本OPG表达的平均积分光密度值(IOD)。(E)各组胫骨标本RANKL表达的平均IOD值。(F)OPG/RANKL比率。(G)各组胫骨标本CTSK表达的平均IOD值。A)对照,b)锐钛矿型TiO2纳米颗粒,c)金红石型TiO2纳米颗粒(200×),d)对照,e)锐钛矿型TiO2纳米颗粒,f)金红石型TiO2纳米颗粒(400×)。*P<0.0001,*与对照组比较P<0.05,*P<0.05。

锐钛矿型和金红石型TiO2纳米粒子通过IGF-1/OPG/RANKL/CTSK途径损伤幼鼠骨骼结构的示意图。
结论:纳米TiO2可通过IGF-1/OPG/RANKL/CTSK途径损伤幼鼠的骨组织。此外,金红石型TiO2纳米颗粒比锐钛矿型TiO2纳米颗粒对骨骼的损伤更严重。
原文出处:
Cheng W, Xu X, Lang Y,et al.Anatase and Rutile TiO Nanoparticles Lead Effective Bone Damage in Young Rat Model via the IGF-1 Signaling Pathway.Int J Nanomedicine 2021;16


