刘从容教授:“卵巢癌检测报告”的临床病理解读
时间:2021-10-11 12:01:40 热度:37.1℃ 作者:网络
【编者按】近年来,随着PARPi 的临床应用,有效延长了卵巢癌患者生存,打破了卵巢癌患者的治疗格局。且生物标志物检测能够指导临床合理用药及评估患者预后,尤其是HRD检测,具有指导临床进行精准治疗、精准预防、精准预测等多项意义。那么,如何更加科学、全面地理解卵巢癌HRD检测报告?北京大学第三医院病理科刘从容教授在本文中对此给予详细解读。
一、理清概念——HRR vs. HRD
同源重组修复(HRR)
细胞核中能被碱性染料染成深色的物质叫做染色体,它由DNA和蛋白质两种物质组成,DNA是遗传信息的载体,一个DNA分子上有许多基因,基因是具有特定遗传信息的DNA片段。在生活环境中,身体每一个细胞中的DNA每天都会发生成千上万次的损伤,从而出现DNA中碱基配对错误、DNA单链或双链上DNA片段缺失等情况。当然,身体自带的强大修复能力,会很快将这些损伤修复。
当发生DNA单链损伤时,通常以对侧链为模板进行复制、修复。当发生DNA双链损伤时,就失去了以一条链为模板“复活”另外一条链的机会,此时该怎么办?我们知道,人类染色体有两条,一条为父源,一条为母源,即同源染色体。两条染色体交叉在一起的部分称为着丝粒,当其中一条染色体上的DNA发生双链断裂时,比如“父源”染色体上发生DNA双链断裂,虽然两条DNA链彼此间不能复制,但可以借鉴“母源”染色体上正常的DNA双链形态、构造,进行“父源”染色体DNA双链损伤的复制和修复,就像是“抄作业”。这种通过“抄作业”的方式对DNA双链损伤进行高保真修复的生理功能,称为“同源重组修复(HRR)”。

在DNA单链损伤中,依靠PARP酶,以对侧链为模板,使DNA单链损伤修复至正常状态,即碱基切除高保真修复方式。
在DNA双链损伤中,通过“抄作业”的方式,借鉴另一条染色体DNA双链,对缺损的DNA双链进行高保真修复,这一过程称为HRR。在HRR修复过程中,主要的工作团队称为HRR复合体,HRR复合体中的核心是BRCA1/2蛋白。这种是以同源染色体DNA为模板进行修复的高保真修复方式。
此外,还有一种低保真的修复方式,在DNA双链发生断裂后,由于无法通过“抄作业”的方式进行修复,便通过非同源末端接合的方式,使缺损断端生硬连接在一起,修复后的DNA双链为低保真,可有各种各样的问题,或过短或过长,俗称“瘸腿”。

同源重组修复缺陷(HRD)
所谓HRD,即无法通过“抄作业”的方式对DNA双链缺损进行修复的生理功能缺陷,比如,BRCA1/2突变。
二、HRD检测的意义
由于无法通过“抄作业”对DNA双链缺损进行修复,因此只能通过低保真的修复方式,导致大量的“瘸腿”DNA积累,使DNA遗传物质严重受损,长此以往,对生物体产生致死性影响。
PARP抑制剂
当肿瘤DNA存在HRD时,相对而言,只存在一种高保真修复方式——单链高保真修复,如若再用PARP抑制剂使其DNA损伤无法进行单链修复,进而演变为DNA双链断裂,此时便只剩下低保真修复这一种DNA修复方式,而生成的“瘸腿”DNA难以存活,对细胞有致死性影响,这就是所谓的“联合致死”。
因此,使用HRD检测的一个重要机制是,一旦确认肿瘤中存在DNA损伤“抄作业”修复缺陷后,便通过PARP抑制剂阻断DNA单链高保真修复,使其很快蓄积成DNA双链损伤,由于本身的缺陷无法进行DNA双链同源重组高保真修复,只能通过非同源末端接合低保真修复产生大量的“瘸腿”DNA,进而导致肿瘤细胞很快死亡,而人体正常细胞因为不存在HRD,所以应用PARP抑制剂后,依然可以存活。这也是一种精准的治疗方式。
铂敏感+PARP抑制剂敏感
目前,临床上很多医生根据临床经验,多将铂敏感作为PARP抑制剂应用原则之一,那么,铂敏感是否就存在HRD?铂敏感是否就是PARP抑制剂敏感?首先,了解铂类药物对DNA的影响。铂类药物的损害主要为DNA交联,其DNA修复方式包括核苷酸切除修复(NER)、跨损伤DNA合成(TLS)和同源重组修复(HRR),其中,HRR是铂类损伤后最重要的修复过程。也就是说“铂类损伤后的DNA修复过程,也是严重依赖HRR的过程”。由于卵巢癌铂敏感的主要原因是存在HRD——无法完成对铂类损伤的高保真修复,所以铂敏感患者中大部分存在HRD,也就对PARP抑制剂敏感。
那么,是否铂敏感患者只用PARP抑制剂治疗,就不需检查HRD?答案是否定的。实际上,虽然相当一部分铂敏感肿瘤患者因为存在HRD,所以对铂敏感,但还有少部分患者为HRR通路正常,核苷酸切除修复(NER)、跨损伤DNA合成(TLS)通路存在问题,所以对铂敏感,但对PARP抑制剂不敏感。
因此,HRD和铂敏感是两个独立的单元,虽然有所交集,但都有各自的独立领域。临床上如果没有HRD检测手段,对铂敏感的肿瘤患者,可尝试用PARP抑制剂治疗,但如果有HRD检测能力,还是要进行检测。
三、卵巢癌HRD检测临床病理意义
1. 指导精准治疗
HRD检测对术后铂化疗和PARP抑制剂靶向治疗的临床应用有指导意义,尤其是HRD一旦出现,则提示该肿瘤患者对PARP抑制剂的高度敏感性,可指导临床进行精准治疗。
2. 遗传咨询,精准预防
临床常见的检查结果有gBRCA突变、tBRCA突变。
gBRCA突变指生殖细胞具有突变,因此患者全身细胞均携带突变,须检测血液/正常组织,这类人群一半生殖细胞携带突变,具有遗传性。其意义主要体现在以下三方面:①卵巢癌患者gBRCA突变说明对铂类化疗敏感,预后较好,可以应用PARP抑制剂治疗;同时,gBRCA突变预示着患者患乳腺癌等风险较高。②如果为gBRCA突变携带者,建议25岁起每年进行MRI筛查,40岁后切除双附件+乳腺癌切除。③预防直系亲属遗传,检测BRCA胚系突变。
tBRCA突变指体细胞发生突变,生殖细胞不携带突变,不遗传,仅影响部分区域,须检测肿瘤组织。其意义主要为:①卵巢癌患者对铂类化疗敏感,预后较好,可以应用PARP抑制剂进行治疗,但患乳腺癌的风险与普通人群相同。②由于tBRCA突变患者生殖细胞不携带突变,所以直系亲属无须进行BRCA筛查。
因此,卵巢癌HRD检测尤其是gBRCA突变可以指导临床进行遗传咨询和精准预防。
3. 评估复发风险,进行精准预测
根据相关临床研究,就整体卵巢癌而言,tBRCA突变提示肿瘤预后差。如高级别浆液性卵巢癌患者多具有tBRCA突变,相比而言,往往预后较差。有人对死于乳腺癌/卵巢癌的患者比例进行分析后发现,在美国,BRCA1/2基因突变携带者、70岁以下患者死亡比例占56%~72%,而美国普通女性人群、70岁以下患者的死亡比例占11%。由此可见,具有BRCA1/2基因突变携带的乳腺癌/卵巢癌患者死亡比例明显较高。但还有研究表明,BRCA1/2基因突变携带者的预后好,其重要前提是,就高级别浆液性癌而言,BRCAm患者相对于BRCA野生型患者,对PARP抑制剂、铂类化疗敏感,所以预后好。
因此,对于卵巢癌预后的预测,需要通过HRD检测了解BRCA突变与否再进行判断。
四、如何进行HRD检测?
卵巢癌HRD检测可以指导临床进行精准治疗、精准预防、精准预测,那么,该如何进行HRD检测?
1. 导致HRD的原因
染色体一侧DNA双链断裂后,由BRCA1/2带领的修复工作团队(HRR复合体),以对侧DNA双链为模板,通过纷繁复杂的操作工序,最终以“抄作业”的方式使DNA双链得以修复。由此可见,BRCA突变可以导致HRD,但却不是唯一的原因,修复工作团队(HRR复合体)中的任何一个成员出现异常都会导致HRD。目前,导致HRD的原因主要包括BRCA1/2突变、其他HR通路遗传突变、启动子甲基化、未知原因。那么,从原因角度思考,进行HRD检测,是否可行?
仅使用NGS检测BRCA1/2突变
以高级别浆液性癌为例,有研究表明,其中与HRD相关的病例占42%,血液样本可检测出14%的病例,分别为gBRCA1突变8%、gBRCA2突变6%;如果为肿瘤样本检测,可使病例扩增至19%,除gBRCA突变外,还包括tBRCA1突变4%、tBRCA2突变3%。因此,对于治疗而言,BRCA检测的肿瘤样本优于血液样本。但是即便如此,仅使用NGS检测BRCA1/2突变,卵巢癌HRD检出率<50%,另外还有11%的甲基化BRCA1和11%的其他HRR基因无法检测出。因此,对于HRD检测,只检测BRCA1/2突变是远远不够的。
使用NGS检测HRR基因panel
同样以高级别浆液性癌为例,总共有42%的HRD相关病例,通过g/tBRCA1/2突变检测可涵盖19%的相关病例,通过HRR基因panel可以检测出其他HRR基因(11%)中的部分HRR基因突变。但是,其他HRR基因异常还包括基因大片段缺失、microRNA、转录因子等表达调控异常,蛋白降解等其他影响mRNA和蛋白的因素,这些都无法检测出,加上甲基化BRCA1(11%)也无法检出,因此,还有30%的HRD未检出。
所以,即便使用NGS检测HRR基因panel,卵巢癌HRD检出率<70%,覆盖率依然不全。
2. HRD导致的结局
既然从导致HRD原因的角度进行检测,无法完全覆盖,是否可以改变思路,从HRD导致的结果角度出发,逆向思维,通过检测结果反推是否存在HRD。HRD直接会导致两种状态——HRD功能缺陷和基因组不稳定,关于这两种HRD功能状态,目前全球无直接检测市售试剂盒。HRD功能缺陷和基因组不稳定进一步发展,其结局会导致HRD基因组瘢痕。目前已证实与HRD密切相关的“基因组疤痕”包括基因组杂合性缺失(LOH)、端粒等位基因不平衡(TAI)、大片段迁移(LST),且已有关于基因组瘢痕检测的市售HRD检测试剂盒。一是FOUNDATIONNE公司的试剂盒,覆盖tBRCA和28个HRR基因,可以检测LOH,并设定阈值(LOH/全基因组占比Cutoff≥16%),其HRR基因检测全面,但基因组瘢痕覆盖不全。另一个是MYRIAD公司的试剂盒,相比较FOUNDATIONNE公司而言,其HRR基因检测不全,仅检测g/tBRCA,但其基因组瘢痕覆盖较全面,三种基因组瘢痕都覆盖,LOH+TAI+LST的Cutoff设定在42分。这两种试剂盒既检测基因突变,又检测基因组瘢痕,虽然HRD检测较全面,但是都均为FDA认证,尚无SFDA认证。
因此,对于HRD的检查,原因检测存在漏诊,直接结果——HRD功能缺陷和基因组不稳定检测,目前没有试剂盒,以最终结果——HRD基因组瘢痕作为检测“内容”,设定Cutoff值,超过者给出具有HRD功能状态的“结论”,是目前应用较多的机理。PAOLA-1研究发现,通过HRR基因检测+HRD检测,可使tBRCAm 29%上升至HRD+ 48%。PRIMA研究中,通过HRR基因检测+HRD检测可发现51%的患者存在HRD+。这些大型临床研究结果说明,HRR基因检测+HRD检测可以令更多的患者获益,是目前最全面的卵巢癌PARP抑制剂标志物检测。
由此可以更加理解2020年卵巢癌诊疗NCCN指南中的首个建议,即所有卵巢癌、输卵管癌及原发性腹膜癌均建议进行遗传风险评估及BRCA1/2胚系和体细胞突变检测,且未发现BRCA1/2胚系和/或体细胞突变的患者应进行相应的HRD检测指导PARP抑制剂治疗。
五、HRD检测实践的常见困惑
1. 中国卵巢癌患者BRCA1/2突变率低于西方人?
这一固有认知实际上是错误的。最新数据表明, 中国卵巢癌患者BRCA1/2突变率实际上高于美国、澳大利亚和日本等国家的平均水平。所以,在我国进行HRD检测更具临床意义。
2. 所有的卵巢癌、输卵管癌和腹膜癌都要进行HRD检测吗?
是的。实际上所有的卵巢癌、输卵管癌和腹膜癌中HRD总频率是30%~50%,其中,20%为BRCA1/2突变导致的HRD,20%为BRCA1甲基化和其他HRR基因突变导致的HRD。近年来,也涌现出较多关于不同组织学亚型卵巢癌HRD状况的研究。根据中国和日本的数据库,不同组织学亚型卵巢癌HRD状况的多中心数据研究表明,不同组织学类型卵巢癌中BRCA1/2突变率和HR相关基因突变率均占一定比例,检测意义明确。所以,各种组织学亚型都要进行HRD检测。
3. BRCA变异分类的解读
BRCA基因变异按照风险程度由高至低分为以下5类:致病的(pathogenic),5类,致病概率为>0.99,可能致病的(likelypathogenic),4类,致病概率为0.95~0.99;意义不明确的(uncertainsignificance),3类,致病概率为0.05~0.949;可能良性的(likelybenign),2类,致病概率0.001~0.049;良性(benign),1类,致病概率为<0.001。
对于“意义不明确的3类BRCA基因变异”有两种解决方案,一是有条件的基因检测实验室可以通过动物模型进行VUS功能验证,二是不具备条件的基因检测实验室可以对患者家族中多个成员进行检测。
4. 检测样本获取
样本组织的获取可以是新鲜的,也可以是甲醛或石蜡固定的,可以是血液,也可以是唾液,具体如下图。

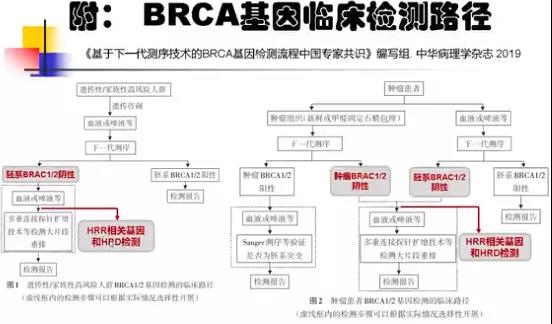
5. BRCA基因临床检测路径
2019年中华病理学杂志发表了《基于下一代测序技术的BRCA1/2基因检测指南(2019版)》,指南中BRCA基因临床检测路径如下图。值得注意的是,当在临床中发现BRCA1/2突变阴性时,无论是胚系还是体系,千万不要放弃,应当继续进行HRR相关基因和HRD检测。
综上所述,HRR是修复DNA双链损伤和维持基因稳定性的重要生理机制,导致HRD发生的机制多样,部分未明。BRCA1/2突变检测对于卵巢癌的“精准预防”意义重大,但仅满足约1/3的“精准治疗”。PARP抑制剂对卵巢癌的精准治疗依赖对HRD状态的全面检测,目前检测方法包括针对原因(BRCA等HRR基因突变)的检测和针对结局(基因瘢痕)的检测。


