硼中子俘获疗法(BNCT):下一代肿瘤治疗中的“黑科技”
时间:2021-09-21 13:01:30 热度:37.1℃ 作者:网络
硼中子俘获治疗(boron neutron capture therapy,BNCT)是2018年公布的核医学名词。
硼中子俘获治疗是一种具有“固有”安全性的生物靶向放射治疗模式,经过了理论发展阶段(1936~1950)、尝试失败阶段(1951~1970)、取得初步成效阶段(1971~2010)、加速器BNCT逐步兴起阶段(2011-)。先后有美国、日本、芬兰、瑞典、意大利、荷兰、阿根廷和中国等国家开展了BNCT临床治疗,对多恶性脑肿瘤、恶性黑色素皮肤癌、复发性头颈癌以及转移性肝癌等1000余名患者做了临床治疗(表1),取得了明显疗效。
2020年3月,世界上第一台加速器BNCT设备和硼药物正式获得了日本厚生劳动省的批准,并开始接受患者治疗。这是硼中子俘获疗法在世界上首次正式进入临床应用。
2020年8月,中科院高能所东莞分部成功研制我国首台自主研发加速器硼中子俘获治疗(简称BNCT)实验装置 ,启动了首轮细胞实验和小动物实验,为开展临床试验做好了前期技术准备。该装置的成功研制,为我国医用BNCT治疗装置整机国产化和产业化奠定了技术基础,将为我国肿瘤治疗带来技术性革新。
表1 BNCT临床治疗病例统计
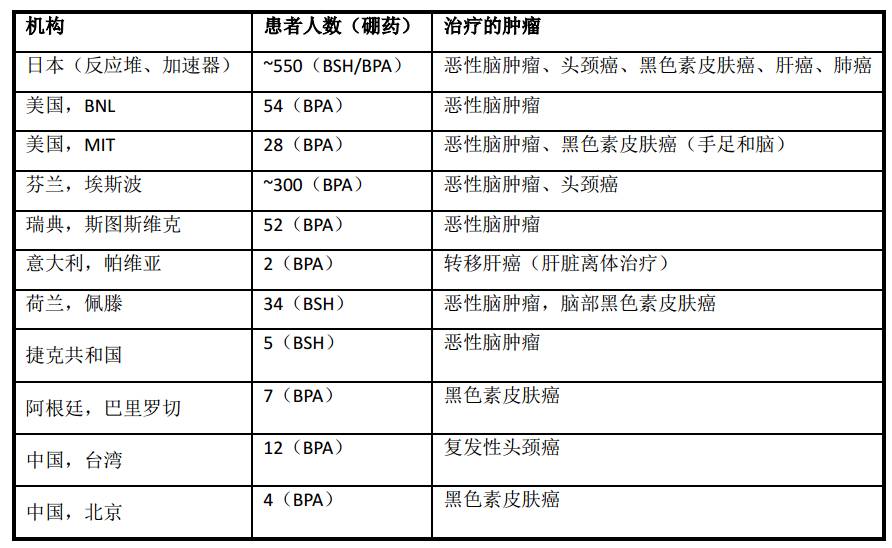
BNCT目前是多形性胶质母细胞瘤、恶性黑色素瘤和头颈部复发性肿瘤唯一的治疗手段,对于浸润型、弥漫型、结节型或有转移的肿瘤具有治愈的可能性。
随着BNCT技术的发展进步,尤其进入本世纪以来,逐步出现了一些BNCT的“黑科技”,本文将给大家介绍一些硼中子俘获疗法中出现的“黑科技”,它们是强流质子加速器技术、靶技术、混合辐射场测量技术、硼药技术-硼药与运输工具和硼浓度检测和成像技术。
BNCT是目前国际最先进的癌症治疗手段之一,可选择性地破坏癌细胞而避免对正常细胞造成严重损害。这种方法是治疗高度恶性肿瘤的有效方法,例如在脑肿瘤中,其中健康和肿瘤细胞常常混合在一起,这种治疗方式可以精准的杀灭癌细胞,而避免对正常细胞的伤害。
1、强流质子加速器技术
X射线放疗一般需要达到60-80Gy左右的总剂量,按照2Gy/天的分割剂量,治疗过程会持续一个月左右。好在每次照射几分钟就完事了,比如射波刀每分钟可以输出8Gy的剂量,刚躺下就治完了。
质子、重离子治疗一般需要达到100-200Gy左右的总剂量,一般需要分数次到数十次完成治疗,持续治疗一个月左右。质子、重离子设备的剂量率一般在2Gy/分钟,每次30Gy的剂量,需要照射15分钟。
BNCT放疗已经实现了自己的“小目标”,就是把照射时间控制在一个小时内。但还是让人有些揪心,接受BNCT治疗的患者在接受照射的一个小时内需要保持同一个姿势,可不能随便动一动,活动一下筋骨。不过,BNCT治疗的优势就是:只需治疗一次。
好在有了“强流质子加速器”这一“黑科技”,BNCT照射时间长的问题就基本不存在了。现在的低能强流质子加速器束流可到数十毫安(10-50mA),每毫安质子可以产生10^12-10^13中子/秒,加速器中子源的总中子产额在10^13-10^14中子/秒,在人体产生的等效剂量率可达几个Gy-Eq/分钟,那么单次照射时间和其他放疗就差不多了。
低能强流质子加速器有很广泛的用途,每一个高能质子加速器背后都有一个或几个低能强流质子加速器。比如,意大利的核能研究机构就想从用于核能研究(意大利ADS可行性研究项目)的高能质子加速器的低能段引出5兆电子伏特的质子,用来产生BNCT放疗用的中子,见图1。

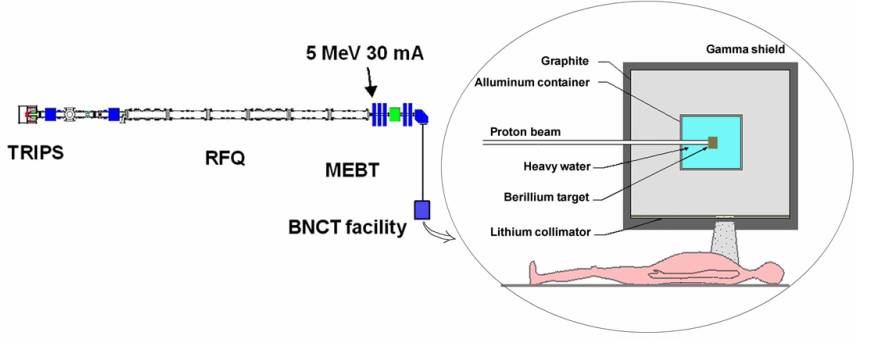
图1 意大利核能研究机构的加速器BNCT说明图(上:ADS加速器,下:BNCT装置示意图)
2. 靶技术
反应堆是靠中子轰击铀元素的易裂变同位素铀-235来产生多个中子,这些中子继续轰击铀-235产生更多的中子,通过这种链式核反应,在反应堆内形成稳定的中子场。一般来说,几十个千瓦到几个兆瓦热功率的核裂变反应堆都可以为BNCT治疗提供中子源。通过一个孔道将反应堆产生的中子引出来,经过设计好的中子减速体和反射体来调整中子的能量分布和角度分布,就可以用于给患者做BNCT治疗了。但反应堆是核设施,不便于建在人口稠密的城市中,所以我们已经看见基于加速器的BNCT有取代反应堆BNCT的节奏。
“靶技术”这一黑科技是加速器BNCT所必须的,参考图2。加速器只能加速带电的粒子,比如质子,或者氢原子核多一个电子的“负氢”等。BNCT需要的是中子,让低能质子打在金属材料上就会产生中子,我们称它为“靶”。要产生足够多数量的中子、运行稳定可靠、维护与维修方便,这可不是一件随随便便就能办好的事,靶技术是一项复杂的工程技术,靶上的热流密度达到每平方厘米1千瓦(kW/cm^2)量级,需要有好的材料工艺,以及靶冷却手段。
BNCT加速器可以选择金属锂或金属铍做靶的材料(图3),如果选择铍靶则质子能量需要至少大于4MeV,否则中子产额过低。此外,金属锂材料的熔点只有180摄氏度,可靠的固态锂靶工程实现难度大,有研究机构干脆采用液态锂来做产中子的靶。
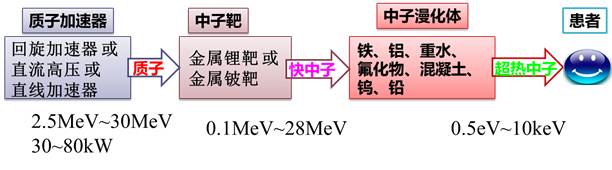
图2 加速器BNCT原理示意图(图中数值为质子或中子能量)


图3 靶系统(上:固体锂靶,下:铍靶)
3. 混合辐射场测量技术
X/γ射线放疗、质子、重离子等放疗手段所涉及到的辐射类型都比较单一,剂量测量及人体剂量分布计算相对比较简单。通过剂量测量水箱,测量不同能量射线的深度剂量分布以及离轴剂量分布,计算人体剂量分布时再引入一些有针对性的局部修正即可,计算方法一般采用基于经验的解析方法。
BNCT治疗的辐射场为混合场,牵涉到多种不同辐射与物质的作用,需考虑不同能量、不同种类的辐射物理特性和辐射生物效应,剂量测量以及剂量分布计算相当复杂。辐射场的测量需要同时针对伽马射线、快中子、热中子等的测量仪器;既需要测量射线的能谱分布,又需要测量不同射线所产生的剂量率大小,还需要考虑不同射线的相对生物效应以及不同介质的生物学效应。BNCT治疗过程中不仅有一次射线,比如伽马射线、快中子和热中子,还包括复杂的二次射线,包括阿尔法(Alpha,氦-4核)粒子、锂-7粒子、反冲质子、Beta射线(次级电子)以及次级光子等。混合辐射在人体组织中发生的能量沉积事件的数目、大小及空间分布上的不同都会造成不同的生物效应,不能简单使用平均吸收剂量大小来衡量。
根据BNCT治疗过程对混合辐射场测量的要求,利用微剂量学(microdosimetry)的理论和方法,完善了混合辐射场测量技术,研制了能够同时测量伽马射线、快中子、热中子等在人体组织剂量的组织等效正比计数器(TEPC),参考图4。
BNCT治疗前的人体剂量分布规划只能使用蒙特卡罗方法,使用电脑模拟放疗过程中各种射线与人体组织的作用过程来得到人体的剂量分布,同时还需要根据实施过程中射线监测和硼浓度检测结果进行修正。

图4 组织等效正比计数器(TEPC)
4. 硼药技术-硼药与运输工具
掺硼药物的好坏直接决定了BNCT治疗的效果,肿瘤细胞中的硼-10与热中子发生了反应才能生产杀伤效果,而且要杀死肿瘤细胞,其硼浓度必须在照射期间维持较高的浓度,每克肿瘤组织至少携带30微克的硼-10。这一点,对于目前在使用的硼药-氨基酸衍生物BPA、硼卡钠BSH来说不是个事。
有一点要求比较难于做到,就是健康组织和血液中的硼-10浓度要远小于肿瘤组织中的硼药浓度。对于BPA,肿瘤中的硼-10与血液中的硼-10浓度之比大约为3,就是说目前的BNCT技术从剂量安全的角度看有3倍安全因数。
开发出来的硼药可分为两大类,即小分子硼药和结合有硼的生物配合物。前者有含硼氨基酸衍生物、核酸衍生物、卟啉及其衍生物、碳水化合物以及含硼仿生体,后者主要有含硼聚合物、硼肽与抗体。为了更好地将硼-10送到肿瘤细胞中,还研制了硼药的运载工具和保护措施,比如给含硼多肽镀一层膜,防止它在被吸收前发生水解;还有利用脂质体把大量的硼-10包裹起来;为了增加亲肿瘤效果,给硼药分子嫁接上靶向特定肿瘤受体的配体,比如针对上皮生长因子受体和叶酸受体等。利用仙台病毒(HVJ)的外壳来包裹硼-10,并送到肿瘤细胞中的技术可真是一“黑科技”,下面顺便介绍一下HVJ病毒。
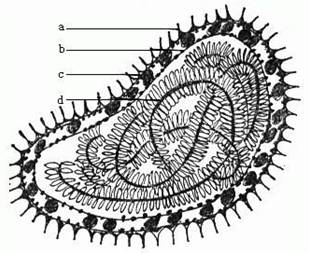
图5 仙台病毒病毒图(a. 套膜上的钉芒具有唾液酸苍酶和血球凝集活动;
b. 自细胞得来的病毒套膜;c.糖蛋白;d. 染色体)
仙台病毒是一种乙型副流感病毒,有包膜,其中含有分子量为6-7×10^6的RNA,但不是蛋白质合成的模板,直径150-600毫微。HVJ几乎可凝集所有种类的红血球,而且有溶血性,被感染的细胞株很易引起继发感染。因为具有融合各种细胞的能力,所以被广泛地用来进行细胞的异核体形成和培育杂种细胞。曾主要应用于细胞工程中的细胞融合技术,基本原理在于HVJ含有细胞表面受体的结合位点,可以促使不同细胞凝聚,最终使细胞膜相互融合。直接产生这种作用的部位是HVJ病毒的外壳,而不是内部的RNA。日本DNAVEC公司生产的艾滋病疫苗就是向HVJ病毒中植入可转录形成艾滋病病毒所持蛋白质的基因,将这种疫苗投入未感染者的鼻腔,仙台副流感病毒会在1至2周后消失,但由所植入基因转录形成的蛋白质,会促使人体免疫系统产生抵御艾滋病病毒的物质。
5. 硼浓度检测和成像技术
BNCT治疗实施过程中(照射前和照射中)除了需要实时对中子、伽马射线的通量、剂量率等参数进行检测和监控外,还需开展血液中硼浓度随时间变化的跟踪测量(每15分钟或半个小时取样测量一次)。此外,在BNCT照射前,需要给患者注射18F-BPA,并通过正电子断层扫描(PET)获取患者的PET影像数据,来获取患者肿瘤组织中与正常组织中硼浓度的比值(T/N),并作为患者BNCT治疗计划的重要输入参量。18F-BPA的合成有比较大的意义,硼药BPA亲肿瘤组织,又能通过PET设备对硼药进行体外成像。18F-BPA-PET可用来诊断肿瘤,确定硼药在患者体内的分布,还可用于治疗后的辐射效应、治疗效果跟踪等。
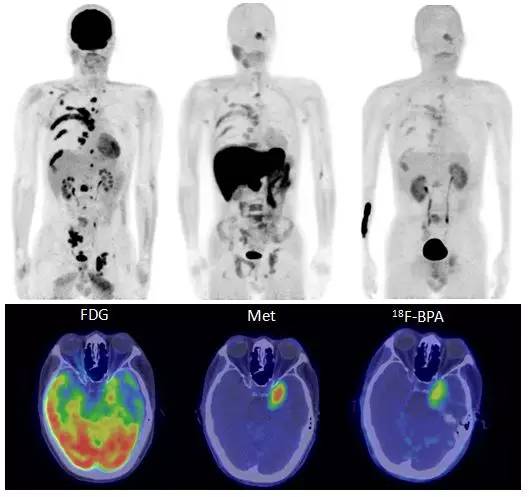
图6 PET影像
一般采用电感耦合等离子体原子光谱仪(ICP-AES)对血液样品中的硼浓度(血硼浓度)直接进行测量,再由患者的肿瘤组织与正常组织硼浓度之比(T/N)反推患者肿瘤组织中的实际硼浓度值。
此外,还可以使用其他一些手段来检测或对硼分布进行成像,比如:瞬发伽马中子活化分析技术(PGNNA)、伽马照相机、中子自动成像(neutron autoradiography)、次级离子质谱仪(secondaryion mass spectrometry)、电子能损谱仪(electron energy loss spectrometry)以及Alpha谱仪(Alphaspectrometry)等。
6、硼中子俘获治疗三大治疗特点
(1).仅一次照射(30-50分钟)
(2).癌细胞特异性作用
(3).可以预先检查硼化合物对靶向癌症的适应性
7、硼中子俘获治疗适合治疗多种癌症种类,包括晚期复发类癌症:
(1). 各种恶性原发性脑肿瘤;
(2). 黑色素瘤;
(3). 头颈部肿瘤(口腔癌,舌癌,咽癌,喉癌,甲状腺癌,腮腺癌,外耳癌,中耳癌症);
(4). 肝脏肿瘤(包括几个病灶);
(5). 膀胱癌;
(6). 局部复发性乳腺癌;
(7). 肺癌;
(8). 结肠癌;
(9). 间皮瘤。
8、肿瘤临床应用
(1).头颈部肿瘤
该理论诞生于1936年,至今已经有80余年的发展历史。 据日本京都大学、大阪大学的研究小组,于2015 年10月29日举行的日本癌症治疗学会(http://www.jsco.or.jp/jpn/),第53届学术集会上,发表的实例报告显示, 对37名头颈部末期癌症患者进行临床试验后,半数以上患者的癌细胞消失了。(2).脑瘤
从2005年6月至2011年9月,BNCT在20例复发性高级脑膜瘤中治疗28次。所有患者之前都接受了强化治疗,如多次手术和多次放疗。 其中19例患者接受硼中子俘获疗法,这些患者的原始肿瘤大小在4.3 cm³和109 cm³之间,治疗2个月后,平均肿瘤体积减少64.5%。中位随访时间为13个月。6名患者在研究发表时仍然活着。 目前,硼中子俘获治疗组和诊断后的中位生存时间分别为45.7个月(32.4~70.7个月)和14.1个月(8.6~40.4个月); 在有症状的病例中, 硼中子俘获治疗后,如偏瘫和面部疼痛得到显著改善。专家推测:硼中子俘获疗法对高级脑膜瘤可能特别有效。

