好文推荐 | ESRS评分联合炎症因子对青海地区CSVD预测价值的研究
时间:2025-02-08 12:10:44 热度:37.1℃ 作者:网络
摘要
目的 探讨ESRS评分联合炎症因子对青海地区眩晕患者发生脑小血管病(CSVD)的预测价值。方法 选取2022年6月—2023年6月青海省人民医院神经内科入院诊断为眩晕的394例患者为研究对象,其中中枢性眩晕患者201例,周围性眩晕患者193例,收集NLR、PLR、MHR、LMR等炎症相关指标,对所有患者进行ESRS评分和MRI检查。结果 201例中枢性眩晕患者有118例(58.7%)发生CSVD,193例周围性眩晕患者中有78例(40.4%)发生CSVD。单因素分析结果显示中枢性眩晕患者组和周围性眩晕患者组发生CSVD组与未发生CSVD组在收缩压、NLR、PLR、MHR、LMR、ESRS评分差异有统计学意义;中枢性眩晕CSVD组和周围性眩晕CSVD组在年龄、ESRS评分差异有统计学意义。中枢性眩晕患者ESRS评分低、中、高危组发生CSVD风险分别为25.49%、68.75%,100.00%,周围性眩晕患者ESRS评分低、中、高危组发生CSVD风险分别为32.10%、66.70%、100.00%。Logistic回归分析显示ESRS评分、NLR、PLR是眩晕患者发生CSVD的独立危险因素。中枢性眩晕组中ESRS评分、NLR、PLR对中枢性眩晕患者预测CSVD的AUC分别为0.790、0.721、0.635,三者联合的AUC为0.846;周围性眩晕组中ESRS评分、NLR、PLR对周围性眩晕患者预测CSVD的AUC分别为0.757、0.714、0.632,三者联合的AUC为0.816。结论 青海地区眩晕患者发生CSVD的风险随着ESRS评分增大而升高;青海地区眩晕患者发生CSVD的风险与NLR、PLR值正相关;ESRS评分联合NLR、PLR对青海地区眩晕患者发生CSVD的风险评估比单独使用上述指标评估更敏感;中枢性眩晕CSVD组的ESRS评分高于周围性眩晕CSVD组,提示中枢性眩晕患者可能更易发生CSVD。
高原平均海拔在1 000 m以上,其具有低氧、低压、高寒、昼夜温差大等一系列特征。有研究证明,高原脑血管病是威胁高原人群的主要疾病之一,高原特殊的环境是导致脑血管病发生的重要因素。目前国内外学者对高原脑血管病的研究日益深入。
眩晕是指因为人体自身对空间定位产生障碍而发生的一种运动性错觉或幻觉,其多有由前庭系统疾病引起。中华医学会神经病学分会将眩晕分为4种类型:中枢性、周围性、精神性、不明原因性。脑小血管病(cerebral small vessel disease,CSVD)是常见的慢性进行性血管疾病,主要为脑内小动脉、毛细血管、微动脉和微静脉病变所致的一组临床综合征。该病的神经影像学表现多样,主要包括近期皮质下小梗死(recent small subcortical infarct,RSSI)、推测为血管源性腔隙、推测为血管源性脑白质高信号(white matter hyperintensity,WMH)、血管周围间隙(perivascular space,PVS)、脑微出血(cerebral microbleed,CMB)和脑萎缩。在大量临床工作中发现眩晕患者发生CSVD的概率非常高,同时多项研究表明眩晕也是CSVD最常见的症状和主诉之一。目前,关于CSVD与眩晕症状之间的关系已受到国内外广泛关注。本研究旨在探讨ESRS评分联合炎症因子对眩晕患者发生CSVD的预测价值,为临床诊治提供参考。
1 资料与方法
1.1 一般资料
选择2022年6月—2023年6月青海省人民医院神经内科入院诊断为眩晕的394例患者为研究对象,中枢性眩晕患者201例,周围性眩晕患者193例。中枢性眩晕患者中男105例,女96例,平均年龄为(66.23±11.10)岁。周围性眩晕患者男84例,女109例,平均年龄为(57.84±12.61)岁。纳入标准:(1)入选者中枢性眩晕、周围性眩晕诊断符合中华医学会神经病学分会制定的眩晕诊断标准;(2)年龄≥18岁;(3)病史资料齐全,可完成ESRS评分,并能获取头部MRI、NLR、PLR、MHR、LMR等指标;(4)患者知情同意。排除标准:存在所有可能对本研究结果产生干扰因素者。
1.2 方法
收集患者的年龄、性别、既往血管疾病相关病史,记录患者淋巴细胞、中性粒细胞、血小板、外周单核细胞、高密度脂蛋白胆固醇等,并计算NLR(中性粒细胞/淋巴细胞)、PLR(血小板/淋巴细胞)、MHR(单核细胞/高密度脂蛋白胆固醇)、LMR(淋巴细胞/单核细胞)值。对所有患者进行(Essen Stroke Risk Score,ESRS)卒中风险评分量表,总分0~9分,并按照分数分为低(0~2分)、中(3~6分)、高(7~9分)3种危险分层。
1.3 质量控制
数据采用SPSS 28.0处理。计量资料符合正态分布以(x±s)表示,采用t检验,非正态分布以[M(P25,P75)]表示,行秩和检验;用多因素Logistic回归模型对眩晕患者发生脑小血管病的相关危险因素进行逐步分析;绘制ROC曲线分析ESRS评分和炎症因子对眩晕患者发生CSVD的预测价值,并确定检测指标的最佳截断值;以P<0.05为差异有统计学意义。
2 结 果
2.1 眩晕患者CSVD发生情况
共收集符合标准的眩晕患者394例,其中中枢性眩晕患者201例,男105例,女96例,中枢性眩晕CSVD组118例(58.7%),中枢性眩晕非CSVD组83例(41.3%)。周围性眩晕患者193例,男84例,女109例,周围性眩晕CSVD组78例(40.4%);周围性眩晕非CSVD组115例(59.6%)。
2.2 中枢性眩晕CSVD组和非CSVD组相关因素比较
中枢性眩晕组在收缩压、NLR、PLR、MHR、LMR、ESRS评分比较差异有统计学意义(P<0.05),在性别、饮酒、血脂异常、冠心病、舒张压方面差异无统计学意义(见表1)。
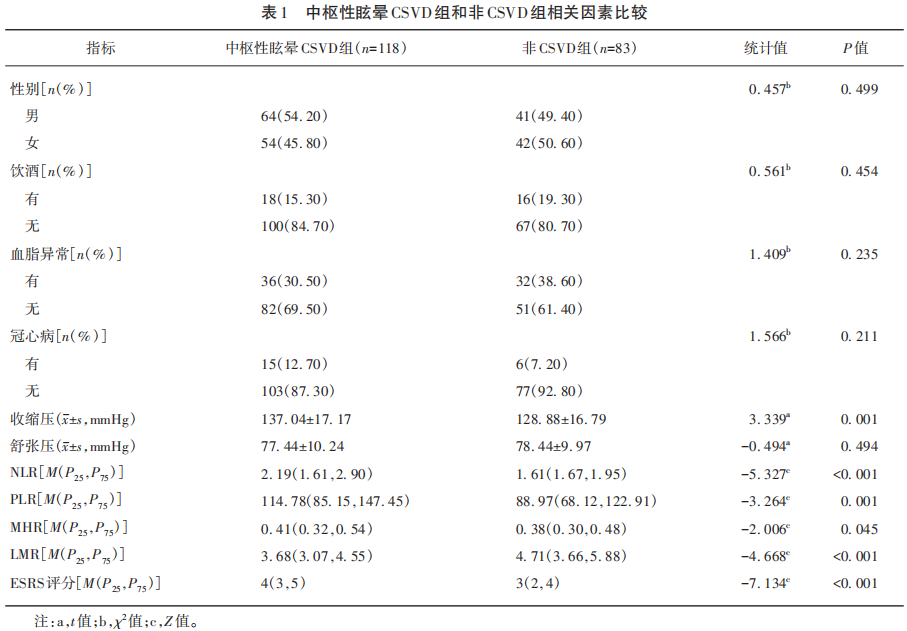
2.3 周围性眩晕CSVD组与非CSVD组相关因素比较
周围性眩晕组在收缩压、NLR、PLR、MHR、LMR、ESRS评分比较差异有统计学意义(P<0.05),在性别、饮酒、血脂异常、冠心病、舒张压方面差异无统计学意义(见表2)。
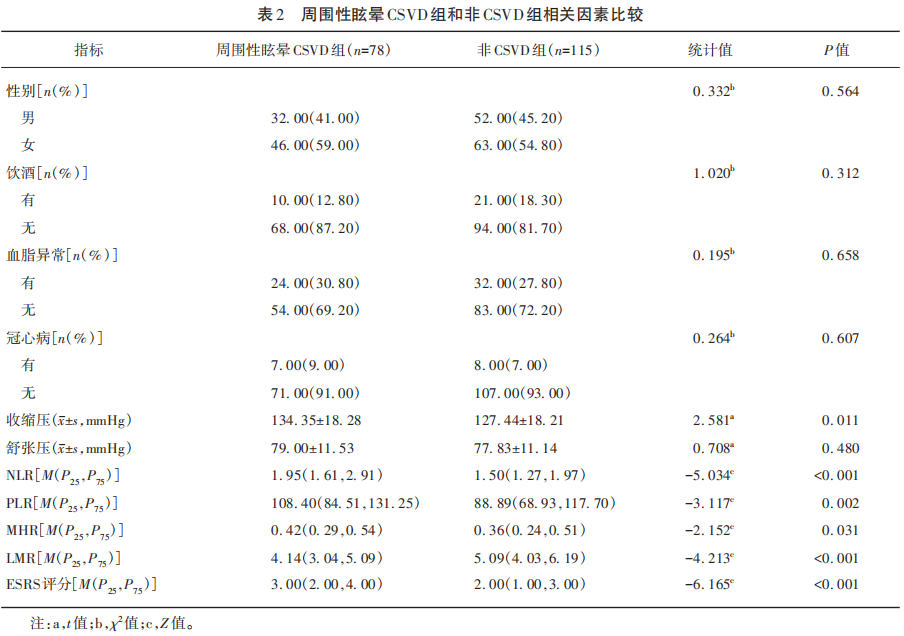
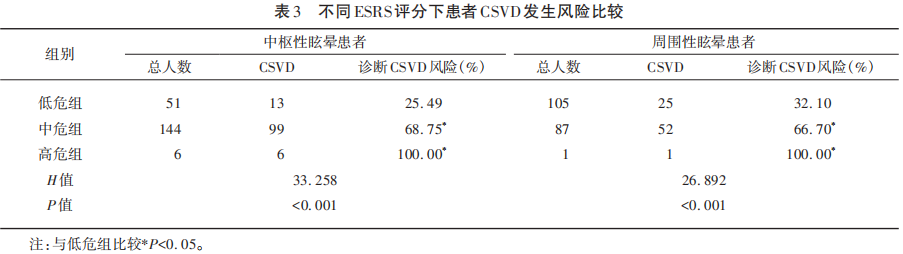
2.4 不同ESRS评分下患者CSVD发生风险比较
ESRS评分中、高危患者CSVD发生率显著高于低危组(P<0.05)(见表3)。
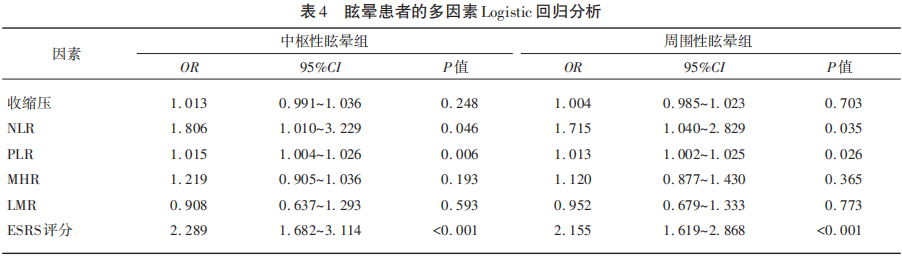
2.5 多因素Logistic回归分析
单因素分析显示中枢性眩晕组和周围性眩晕组在收缩压、NLR、PLR、MHR、LMR、ESRS评分与CSVD的发生显著相关(P<0.05),将单因素分析中有统计学意义的因素进行多因素Logistic回归分析显示,NLR、PLR、ESRS评分是预测眩晕患者发生CSVD的独立预测因素(P<0.05)(见表4)。
2.6 ESRS评分和炎症因子对眩晕患者发生CSVD的预测价值
中枢性眩晕组中ESRS评分、NLR、PLR预测中枢性眩晕CSVD的AUC分别为0.790、0.721、0.635,三者联合预测中枢性眩晕CSVD的AUC值为0.846(P<0.05);周围性眩晕组中ESRS评分NLR、PLR预测周围性眩晕CSVD的AUC分别为0.757、0.714、0.632,三者联合预测周围性眩晕CSVD的AUC值为0.816(P<0.05)(见表5)。
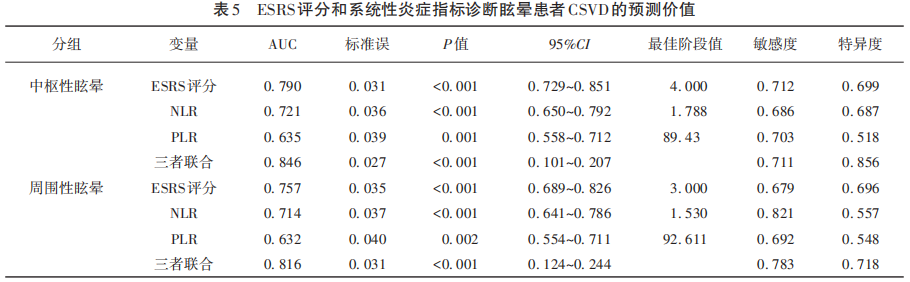
2.7 中枢性眩晕CSVD与周围性眩晕CSVD的比较
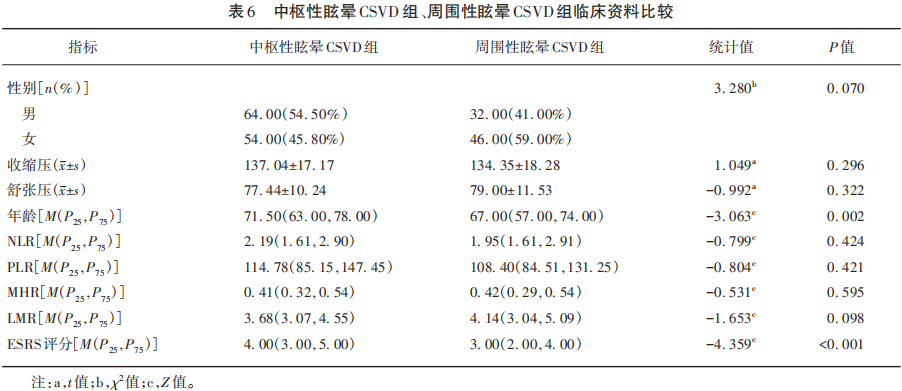
中枢性眩晕CSVD组和周围性眩晕CSVD组在年龄、ESRS评分比较中差异具有统计学意义(P<0.05),在性别、收缩压、舒张压、NLR、PLR、MHR、LMR差异无统计学意义(P≥0.05)(见表6)。
3 讨 论
眩晕是一组非特异性症状,在人群中的发病率较高,且其病因诊断复杂。近年来,随着对CSVD研究的逐渐深入,多项研究发现眩晕症状不仅与CSVD密切相关,而且与CSVD病变的严重程度存在一定的相关性。在本研究中,中枢性眩晕组中发生CSVD的患者118例,占中枢性眩晕组的58.7%,周围性眩晕组中发生CSVD患者78例,占周围性眩晕组的40.4%,周围性眩晕患者发生CSVD的概率低于文献报道的61.4%,这可能与病例的选择不同有关,其中中枢性眩晕患者发生CSVD的概率与文献报道相近。
Essen用于非心房颤动所引起的缺血性卒中患者,在预测卒中复发风险方面具有广泛的应用价值。ESRS评分越高,患者发生缺血性卒中以及心血管事件复发率越高。ESRS评分包括8种脑血管危险因素,这些高危因素彼此间可以起到协同致病的效应,使得该量表对眩晕患者发生CSVD的预测具有一定价值。本研究结果显示,采用ESRS评分预测中、高危眩晕患者CSVD发生率明显高于低危患者,这表明ESRS评分能有效识别不同CSVD风险的眩晕患者,且发生CSVD的可能性随着风险等级的升高而增加。其中对于中枢性眩晕患者ESRS评分≥4分及周围性眩晕患者ESRS评分≥3分的患者应尽快完成头部影像学检查,同时需及时进行CSVD危险因素评估及预防。
近年来,越来越多研究者发现,复合炎症标志物较单一炎症标志物更能反映体内炎症水平,其中NLR、PLR、LMR、MHR作为一类新型的炎症标志物,它们具有经济、易获取的特点,与缺血和出血性疾病密切相关。本研究首先单独用4个新型炎症指标对眩晕患者发生CSVD进行单因素分析,结果发现中枢性眩晕患者组和周围性眩晕患者组均显示NLR、PLR、MHR、LMR与CSVD相关,随后进行多因素分析发现NLR、PLR是影响眩晕患者发生CSVD的独立危险因素。NLR作为一种炎症指标,是周围性眩晕患者的一种新的潜在标志物,也是动脉粥样硬化斑块的存在和数量的重要预测因子,它有助于确定动脉斑块的风险,且与脑梗死预后及多种自身免疫性疾病密切相关。PLR与不稳定斑块的形成紧密相关,它是急性脑梗死的早期诊断和预后指标,可以反映神经功能受损的严重程度。因此,我们将NLR、PLR、ESRS评分三者单独及联合来对眩晕患者发生CSVD的风险进行预测,结果显示,三者联合对眩晕患者发生CSVD的预测价值均较单独使用ESRS评分或单独使用炎症因子的预测准确率高,其中三者联合对中枢性眩晕CSVD的评估较周围性眩晕CSVD更为敏感。
对中枢性眩晕CSVD组和周围性眩晕CSVD组进行比较,结果显示中枢性眩晕CSVD患者的年龄、ESRS评分明显高于周围性眩晕CSVD患者,其中中枢性眩晕CSVD组男女比例为1.185∶1,周围性眩晕CSVD组男女比例为0.696∶1,表明中枢性眩晕患者男性居多,周围性眩晕患者女性居多。我国研究者对不同类型眩晕进行比较发现中枢性眩晕患者平均年龄高于周围性眩晕患者,与本研究结果相似。中枢性眩晕CSVD患者的ESRS评分更高可能有以下两方面原因,一方面原因可能是中枢性眩晕男性患者居多,而性别是发生CSVD的不可控的危险因素,有研究表明男性更容易发生CMBs,目前机制暂不明确,但考虑与男性多有吸烟及嗜酒等不良生活嗜好有关;另一方面是,与周围性眩晕相比,中枢性眩晕患者存在更为明显脑血管结构和血流动力学异常。以上两点原因可能使得中枢性眩晕患者较周围性眩晕患者更易发生CSVD。
青海处于我国西北地区,平均海拔3 000 m以上,高原地区气候独特,大气压及氧分压较平原地区低,且存在高寒、干燥和强辐射等特征,这些都可引起血液流变学异常、血管炎性和基因多态性等多种表现。高原环境是导致脑血管病重要因素之一。首先,高原环境下血管内皮细胞低氧性损伤可导致慢性低灌注,脑组织反复灌注不足引起脑组织累积性损伤,引起髓鞘结构破坏、部分轴突缺失、血脑屏障功能障碍、小胶质细胞及巨噬细胞聚集从而导致CSVD的产生。其次,氧化应激反应水平的增高也与CSVD密切相关,高原条件下氧分压降低可导致氧化应激及体内无氧自由基的产生,其通过损伤内皮细胞、使NO的产生减少等多种机制,导致神经元退行性病变及白质传导纤维的破坏最终导致CSVD。综上,高原地区特殊且复杂的地理环境增加了发生CSVD的风险。因此,高原地区眩晕患者发生CSVD的发生率可能高于低海拔地区。
通过在青海地区进行的此研究结果,我们发现NLR、PLR联合ESRS评分对眩晕患者发生CSVD的预测具有较强的实用性,且简单易得,这对眩晕症状病因诊断及CSVD的预防及防控有一定意义。虽然我们认为NLR、PLR联合ESRS评分在评估眩晕患者发生CSVD风险的方面有一定临床价值,但它们仍不能替代影像学检查,入院患者应尽早完善头部CT及MRI。对于基层医疗机构,临床医生可以通过简单的NLR、PLR联合ESRS评分对眩晕患者发生CSVD风险作出初步评估,对高危患者尽早进行进一步评估、诊疗及预防,提高患者生活质量。本研究只是一个初步探索,存在一定局限性,单中心,样本量较少,这可能导致结果存在一定偏倚,有待今后进一步扩大深入研究,为临床诊治提供参考。
参考文献
[1]Niaz A, Nayyar S. Cerebrovascular stroke at high altitude[J]. J Coll Physicians Surg Pak, 2003, 13(8): 446-448.
[2]中国医药教育协会眩晕专业委员会, 中国医师协会急诊医师分会. 眩晕急诊诊断与治疗指南(2021年)[J]. 中华急诊医学杂志, 2021, 30(4): 402-406.
[3]中华医学会神经病学分会, 中华神经科杂志编辑委员会. 眩晕诊治专家共识[J]. 中华神经科杂志, 2010, 43(5): 369-374.
[4]Chojdak-Łukasiewicz J, Dziadkowiak E, Zimny A, et al. Cerebral small vessel disease: a review[J]. Adv Clin Exp Med, 2021, 30(3): 349-356.
[5]Litak J, Mazurek M, Kulesza B, et al. Cerebral small vessel disease[J]. Int J Mol Sci,2020,21(24):9729.
[6]Wardlaw JM, Smith EE, Biessels GJ, et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration[J]. Lancet Neurol, 2013, 12(8): 822-838.
[7]赵弘轶, 刘宇, 黄勇华. 脑小血管病相关头晕症状的研究进展[J]. 中国卒中杂志, 2019, 14(11): 1186-1189.
[8]Weimar C, Goertler M, Röther J, et al. Predictive value of the essen stroke risk score and akle brachial index in acute ischaemic stroke patients from 85 german stroke units[J]. J Neurol Neurosurg Psychiatry, 2008, 79(12): 1339-1343.
[9]Ahmad H, Cerchiai N, Mancuso M, et al. Are white matter abnormalities associated with “unexplained dizziness”?[J]. J Neurol Sci, 2015, 358(1-2): 428-431.
[10]Okroglic S, Widmann CN, Urbach H, et al. Clinical symptoms and risk factors in cerebral microangiopathy patients[J]. PLoS One, 2013, 8(2): e53455.
[11]Calic Z, Cappelen-Smith C, Cuganesan R, et al. Frequency, aetiology, and outcome of small cerebellar infarction[J]. Cerebrovasc Dis Extra, 2017, 7(3): 173-180.
[12]朱翠婷, 胡文立. 头晕/眩晕患者脑小血管病总负荷的危险因素分析[J]. 中国卒中杂志, 2022, 17(4): 354-359.
[13]Ling X, Yan SM, Shen B, et al. A modified essen stroke risk score for predicting recurrent ischemic stroke at one year[J]. Neurol Res, 2018, 40(3): 204-210.
[14]Weimar C, Diener HC, Alberts MJ, et al. The essen stroke risk score predicts recurrent cardiovascular events: a validation within the REduction of atherothrombosis for continued health (REACH) registry[J]. Stroke, 2009, 40(2): 350-354.
[15]Brown WR, Thore CR. Review: cerebral microvascular pathology in ageing and neurodegeneration[J]. Neuropathol Appl Neurobiol, 2011, 37(1): 56-74.
[16]Klarenbeek P, van Oostenbrugge RJ, Rouhl RP, et al. Ambulatory blood pressure in patients with lacunar stroke: association with total MRI burden of cerebral small vessel disease[J]. Stroke, 2013, 44(11): 2995-2999.
[17]Wardlaw JM, Smith C, Dichgans M. Mechanisms of sporadic cerebral small vessel disease: insights from neuroimaging[J]. Lancet Neurol, 2013, 12(5): 483-497.
[18]Fang F, Cao R, Luo Q, et al. The silent occurrence of cerebral small vessel disease in nonelderly patients with type 2 diabetes mellitus[J]. J Diabetes, 2021, 13(9): 735-743.
[19]Conen D, Rodondi N, Müller A, et al. Relationships of overt and silent brain lesions with cognitive function in patients with atrial fibrillation[J]. J Am Coll Cardiol, 2019, 73(9): 989-999.
[20]Romero JR, Beiser A, Seshadri S, et al. Carotid artery atherosclerosis, MRI indices of brain ischemia, aging, and cognitive impairment: the Framingham study[J]. Stroke, 2009, 40(5): 1590-1596.
[21]见秀丽, 张敏, 马阳, 等. 脑动脉粥样硬化性狭窄与脑小血管病影像学征象相关性的研究进展[J]. 中国脑血管病杂志, 2022, 19(6): 427-432.
[22]Chung JH, Lim J, Jeong JH, et al. The significance of neutrophil to lymphocyte ratio and platelet to lymphocyte ratio in vestibular neuritis[J]. Laryngoscope, 2015, 125(7): E257-E261.
[23]Tao C, Wang J, Hu X, et al. Clinical value of neutrophil to lymphocyte and platelet to lymphocyte ratio after aneurysmal subarachnoid hemorrhage[J]. Neurocrit Care, 2017, 26(3): 393-401.
[24]Corriere T, Di Marca S, Cataudella E, et al. Neutrophil-to-Lymphocyte Ratio is a strong predictor of atherosclerotic carotid plaques in older adults[J]. Nutr Metab Cardiovasc Dis, 2018, 28(1): 23-27.
[25]Biswas T, Gawdi R, Jindal C, et al. Pretreatment neutrophil-to-lymphocyte ratio as an important prognostic marker in stage Ⅲ locally advanced non-small cell lung cancer: confirmatory results from the PROCLAIM phase Ⅲ clinical trial[J]. J Thorac Dis, 2021, 13(10): 5617-5626.
[26]Gasparyan AY, Ayvazyan L, Mukanova U, et al. The platelet-to-lymphocyte ratio as an inflammatory marker in rheumatic diseases[J]. Ann Lab Med, 2019, 39(4): 345-357.
[27]von Hundelshausen P, Schmitt MM. Platelets and their chemokines in atherosclerosis-clinical applications[J]. Front Physiol, 2014, 5: 294.
[28]Zhang Y, Yang P, Wang J. Peripheral blood platelet to lymphocyte ratio as potential diagnostic and prognostic markers of acute cerebral infarction and its clinical significance[J]. Clin Lab, 2019, 65(4):551-556.
[29]孔双艳, 邢岩, 卫景沛,等. 孤立性眩晕患者不同类型眩晕比较分析[J].神经损伤与功能重建,2015,10(4):320-321,343.
[30]牛晓波, 缑元冲, 郭旭亮, 等. 脑小血管病各亚型相关危险因素分析[J]. 中国实用神经疾病杂志,2014,17(21):46-49.
[31]纪叶, 曹端华, 韩敬哲, 等. TCD联合颈动脉超声鉴别急性眩晕的价值[J]. 中国老年学杂志, 2022, 42(12): 2945-2949.
[32]马迪, 王晶, 苏醒麒,等.脑血流调节障碍与老年特发性直立性头晕/眩晕[J].中风与神经疾病杂志,2023,40(11):971-975.
[33]Hainsworth AH, Markus HS, Schneider JA. Cerebral small vessel disease,hypertension,and vascular contributions to cognitive impairment and dementia[J]. Hypertension, 2024, 81(1): 75-86.
[34]Mu L, Jiang L, Chen J, et al. Serum inflammatory factors and oxidative stress factors are associated with increased risk of frailty and cognitive frailty in patients with cerebral small vessel disease[J]. Front Neurol, 2021, 12: 786277.


