Cancer Commun | 高ORR和可控安全性:KN026 联合多西他赛成为HER2阳性乳腺癌一线治疗新希望
时间:2025-01-26 12:08:44 热度:37.1℃ 作者:网络
乳腺癌是全球女性中最常见的恶性肿瘤,也是癌症相关死亡的主要原因之一。其中,约15%-20%的乳腺癌患者HER2(人表皮生长因子受体2)表达阳性,这类乳腺癌更具侵袭性,复发风险更高。目前,针对HER2阳性复发/转移性乳腺癌的标准一线治疗方案是帕妥珠单抗联合曲妥珠单抗和紫杉烷类药物化疗。多项临床试验证实,这种“双HER2阻断”方案可以将客观缓解率(ORR)提升至79.0%-80.2%,显著改善患者预后。然而,该方案的无进展生存期(PFS)仍有提升空间,通常在14.5至19.6个月之间。KN026是一种抗HER2双特异性抗体,能够同时结合HER2蛋白上的两个非重叠表位,分别与帕妥珠单抗和曲妥珠单抗识别的位点相对应。临床前研究表明,KN026在治疗HER2阳性乳腺癌方面具有与曲妥珠单抗和帕妥珠单抗联合使用相当的抗肿瘤活性,并且能够中和对标准双疗法产生耐药性的肿瘤细胞。因此,这项开放标签、单臂、多中心II期临床试验旨在评估KN026联合紫杉醇一线治疗HER2阳性复发/转移性乳腺癌的有效性和安全性。

方法
这是一项在中国19个中心进行的开放标签、单臂、II期临床试验,纳入标准为年龄≥18岁,经组织学证实的转移性或局部复发性、不可切除且无法治愈的HER2阳性乳腺癌患者,患者既往未接受过转移性阶段的全身抗肿瘤治疗,但允许接受最多2线的全身内分泌治疗,患者基线时至少有一个可测量病灶,如果只有一个可测量病灶,则该病灶未接受过既往放疗或放疗后显著进展;器官功能良好,东部肿瘤协作组(ECOG)体能状态评分为0或1。所有患者均接受KN026治疗,每21天为一个周期。KN026于每个周期的第1天静脉注射30 mg/kg。KN026输注后2小时,患者接受紫杉醇静脉注射75 mg/m2,研究治疗持续至疾病进展、开始新的抗肿瘤治疗、患者撤回知情同意、失访或试验结束。主要终点为研究者评估的ORR和DOR,次要终点包括PFS、6个月和12个月PFS率、CBR、OS、6个月和12个月OS率以及安全性。
研究结果
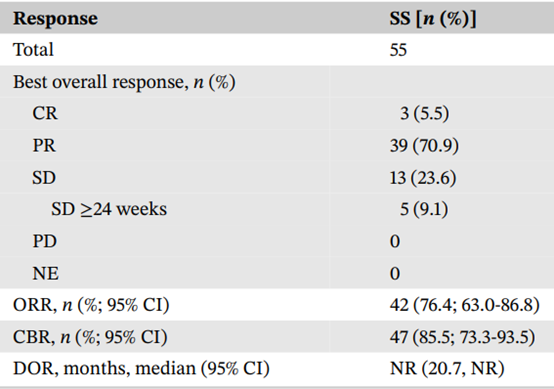
55例患者进入疗效分析集(EAS)。EAS中,3例患者达到完全缓解(CR),39例患者达到部分缓解(PR),ORR为76.4%(95% CI,63.0%-86.8%)。CBR为85.5%(95% CI,73.3%-93.5%)。42例应答患者的DOR中位数未达到(95% CI,20.7个月-未达到)。57例患者进入安全性分析集(SS)。SS中,PFS中位数为27.7个月(95% CI,18.0个月-未达到)。OS中位数未达到,12个月、24个月和30个月的OS率分别为93.0%、84.1%和78.5%。

安全性分析
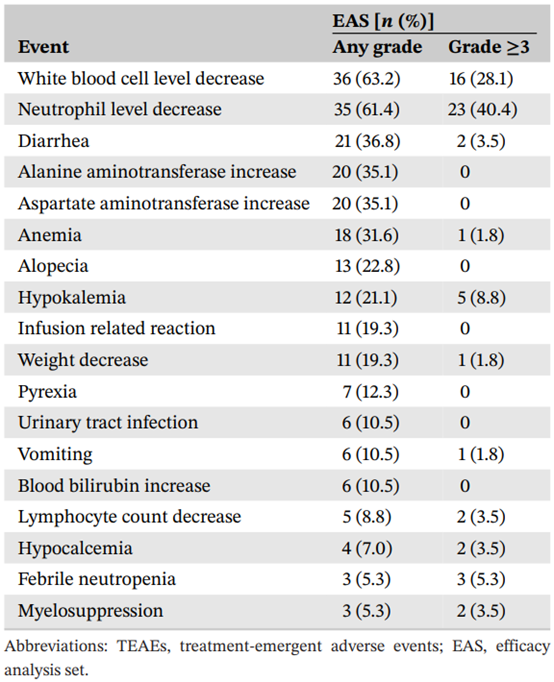
所有患者均出现治疗期间出现的不良事件(TEAEs),36例患者(63.2%)出现≥3级TEAEs,12例患者(21.1%)出现严重不良事件(SAEs),其中10例患者(17.5%)的SAEs为≥3级。11例患者死于疾病进展。无死亡事件归因于KN026或紫杉醇。常见TEAEs(发生率≥20%)为白细胞计数减少(63.2%)、中性粒细胞计数减少(61.4%)和腹泻(36.8%)。常见≥3级TEAEs(≥2%)包括中性粒细胞计数减少(40.4%)、白细胞计数减少(28.1%)和低钾血症(8.8%)。5例患者(8.8%)出现特殊关注AEs。其中,3例患者(5.3%)出现2级肺炎,2例患者(3.5%)出现左心室射血分数(LVEF)较基线绝对值降低≥15%,均为2级。
结论
这项 II 期临床试验评估了 KN026(一种抗 HER2 双特异性抗体)联合多西他赛治疗 HER2 阳性复发/转移性乳腺癌的疗效和安全性,该方案疗效显著且安全性可控,未来需要进一步的大型随机对照试验来验证其临床益处。
原始出处
Ma J, et al. 2025. Efficacy and safety of KN026 and docetaxel for HER2-positive breast cancer: a phase II clinical trial. Cancer Communications n/a.


