Cancer Res:复旦大学李辉等团队合作研究发现激活ACE2轴可以克服HCC的免疫抑制微环境
时间:2025-01-24 12:08:35 热度:37.1℃ 作者:网络
抗PD-L1联合免疫疗法已成为不可切除肝细胞癌(HCC)的首选治疗方法。然而,客观反应率低于40%,这突显了识别免疫检查点抑制剂耐药机制和准确的反应生物标志物的必要性。
2025年1月15日,复旦大学李辉,叶青海,孙惠川,Bo Zhang和中国医科大学洪明奇共同通讯在Cancer Research在线发表题为“ACE2 Enhances Sensitivity to PD-L1 Blockade by Inhibiting Macrophage-Induced Immunosuppression and Angiogenesis”的研究论文。该研究使用下一代测序分析了10名接受抗PD-L1治疗的HCC患者的样本。
与反应者相比,非反应者的肾素-血管紧张素系统的激活水平较高,且血管紧张素转化酶2(ACE2)表达在非反应者中显著下调。ACE2缺失促进了HCC的发展并导致抗PD-L1耐药,而ACE2过表达则抑制了免疫竞争性小鼠中的HCC进展。通过飞行时间质谱分析发现,ACE2缺失的小鼠原位肿瘤组织中,M2型肿瘤相关巨噬细胞增加,呈现CCR5+PD-L1+免疫抑制表型,并且高表达VEGFα。ACE2通过ACE2/血管紧张素-(1-7)/Mas受体轴抑制NF-κB信号通路,从而下调肿瘤固有的趋化因子(C-C基序)配体5(CCL5)表达。较低的CCL5水平导致JAK-STAT3通路的激活减少,抑制了巨噬细胞中的PD-L1和VEGFα表达,阻止了巨噬细胞的浸润和M2型极化。通过马拉维洛克(maraviroc)药理学靶向CCR5,增强了抗PD-L1治疗的肿瘤抑制效果。综上所述,这些发现表明,激活ACE2轴可以克服HCC的免疫抑制微环境,并可能作为免疫治疗靶点以及PD-L1阻断反应的预测生物标志物。

肝细胞癌(HCC)是全球第六大常见恶性肿瘤,也是癌症相关死亡的第三大原因。近年来,分子靶向治疗与免疫检查点抑制剂(ICIs)联合使用显著改善了HCC患者的预后。根据III期临床试验IMBrave150的积极结果,阿替利珠单抗联合贝伐单抗治疗已成为不可切除HCC患者的首选联合治疗方案。然而,缺乏潜在的预测生物标志物来评估抗PD-L1治疗的反应及耐药性,并且对其潜在机制的了解不足,这凸显了开发预测HCC治疗效果的生物标志物以及识别新型联合治疗方案的必要性。
血管紧张素转化酶2(ACE2)是肾素-血管紧张素系统(RAS)中的重要酶。ACE2切割血管紧张素II(Ang II)的第八个氨基酸生成血管紧张素-(1-7)(Ang-1–7),其可以结合MAS受体,抑制过度的炎症反应。ACE2/Ang-(1-7)/MAS轴已被识别为经典RAS(包括ACE/Ang II和AT1受体)的生理对抗因子。近年来,越来越多的证据表明,ACE2/Ang-(1-7)轴在阻止癌细胞进展和治疗耐药性方面具有关键作用。然而,ACE2在HCC肿瘤免疫微环境(TIME)中的作用尚未得到研究。
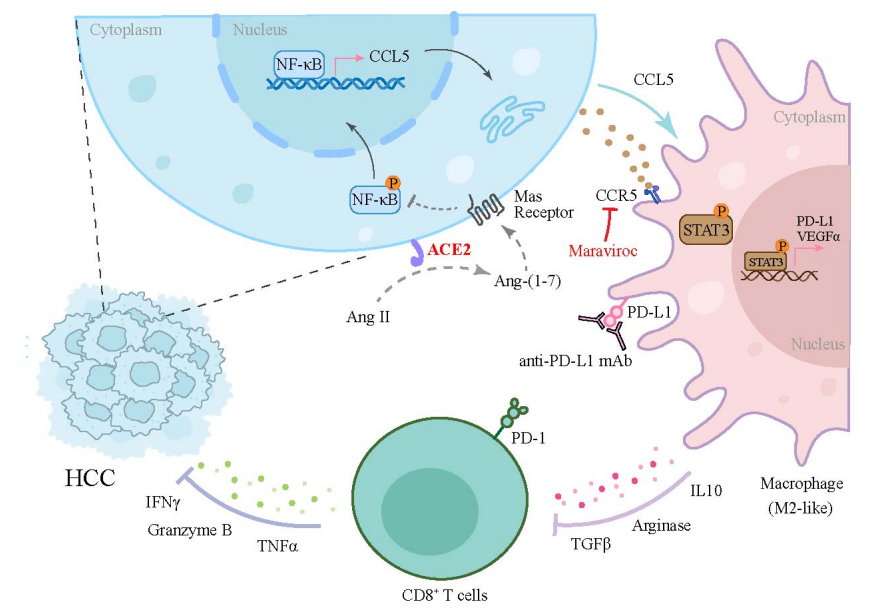
模式机理图(图片源自Cancer Research )
巨噬细胞是肿瘤基质中白细胞浸润的主要成分,通常可以分为经典激活的巨噬细胞(M1或M1样表型)和替代激活的巨噬细胞(M2或M2样表型)。促肿瘤的M2型肿瘤相关巨噬细胞(TAMs)是TIME中的重要成分,在建立免疫抑制肿瘤微环境(TME)以促进免疫逃逸、血管生成、肿瘤进展和治疗耐药性方面发挥重要作用。越来越多的证据揭示了趋化因子如集落刺激因子1(CSF-1)、趋化因子(CC基序)配体2(CCL2)和趋化因子(CC基序)配体5(CCL5)在招募TAMs至TIME中的关键作用。因此,研究和靶向趋化因子-趋化因子受体信号通路在TAM极化中的作用,可能有助于开发与免疫检查点抑制剂协同作用的新型治疗策略,从而提高治疗效果并克服治疗耐药性。
ACE2在RAS中发挥着至关重要的作用,并对抗经典的Ang II/血管紧张素II受体1(AT1)通路。然而,ACE2在HCC TIME中的作用及其潜在机制尚未得到充分研究。本研究揭示了ACE2通过影响HCC免疫景观的一个此前未被探索的机制。ACE2/Ang-(1-7)/MAS轴在通过阻断M2型TAM极化来抑制免疫抑制TME方面发挥着至关重要的作用。作者的研究首次揭示了一个前所未有的机制,并为抗PD-L1阻断疗法提供了有效的预测生物标志物,同时也为HCC治疗提供了潜在的联合治疗策略。
原文链接:
https://doi.org/10.1158/0008-5472.CAN-24-0954


