郑州大学杨炜静教授/秦志海教授/张振中教授ACS Nano:开发新型STING激活性聚合物纳米载体,助力个性化肿瘤免疫治疗
时间:2025-01-22 12:09:08 热度:37.1℃ 作者:网络
肿瘤特异性T细胞在抗肿瘤免疫中发挥关键作用,但其效果往往受抗原呈递和天然免疫反应的时空调控限制。STING(干扰素基因刺激因子)通路激活后,可通过分泌I型干扰素诱导炎症反应并促进抗原呈递,增强抗肿瘤免疫反应。然而,传统的小分子STING激动剂由于细胞内化能力差,难以发挥有效作用。因此,开发能够直接激活STING通路的纳米载体,成为当前研究热点。
近日,郑州大学杨炜静教授、秦志海教授、张振中教授开发了一种基于STING激活性聚合物纳米载体的个性化纳米疫苗(DIPNV),显著抑制了肿瘤生长并诱导长期免疫记忆反应。研究发现,该聚合物纳米载体(DIPNP)中的冠醚结构通过干扰树突细胞(DCs)内钾离子(K⁺)稳态诱导内质网应激,进而激活STING通路促进干扰素调节因子3磷酸化,级联诱导I型干扰素分泌。而纳米载体表面的伯胺基团可激活Toll样受体4(TLR4),促进树突状细胞成熟。在B16-OVA和EG7-OVA两种肿瘤模型中,DIPNV展现出强大的预防性及抗肿瘤免疫疗效。包裹自体肿瘤细胞膜构建个性化纳米疫苗(DIPNP@M)后,在治疗同源远端肿瘤方面亦展现了强抑瘤活性及免疫响应。该工作以“Personalized Nanovaccine Based on STING-Activating Nanocarrier for Robust Cancer Immunotherapy”为题发表在ACS Nano上。郑州大学李永娟副教授为文章第一作者。该研究得到了国家自然科学基金、郑州大学启动基金等项目的资助。

研究团队设计了一种双免疫功能聚合物纳米平台(DIPNP),其能够同时作为STING激动剂和免疫佐剂。该纳米载体可通过静电作用高效包裹卵清蛋白(OVA),并促进树突细胞摄取与内涵体逃逸(图1)。体外实验结果表明,该聚合物纳米载体能通过干扰细胞内K⁺平衡诱导内质网应激,激活STING通路(图2)。
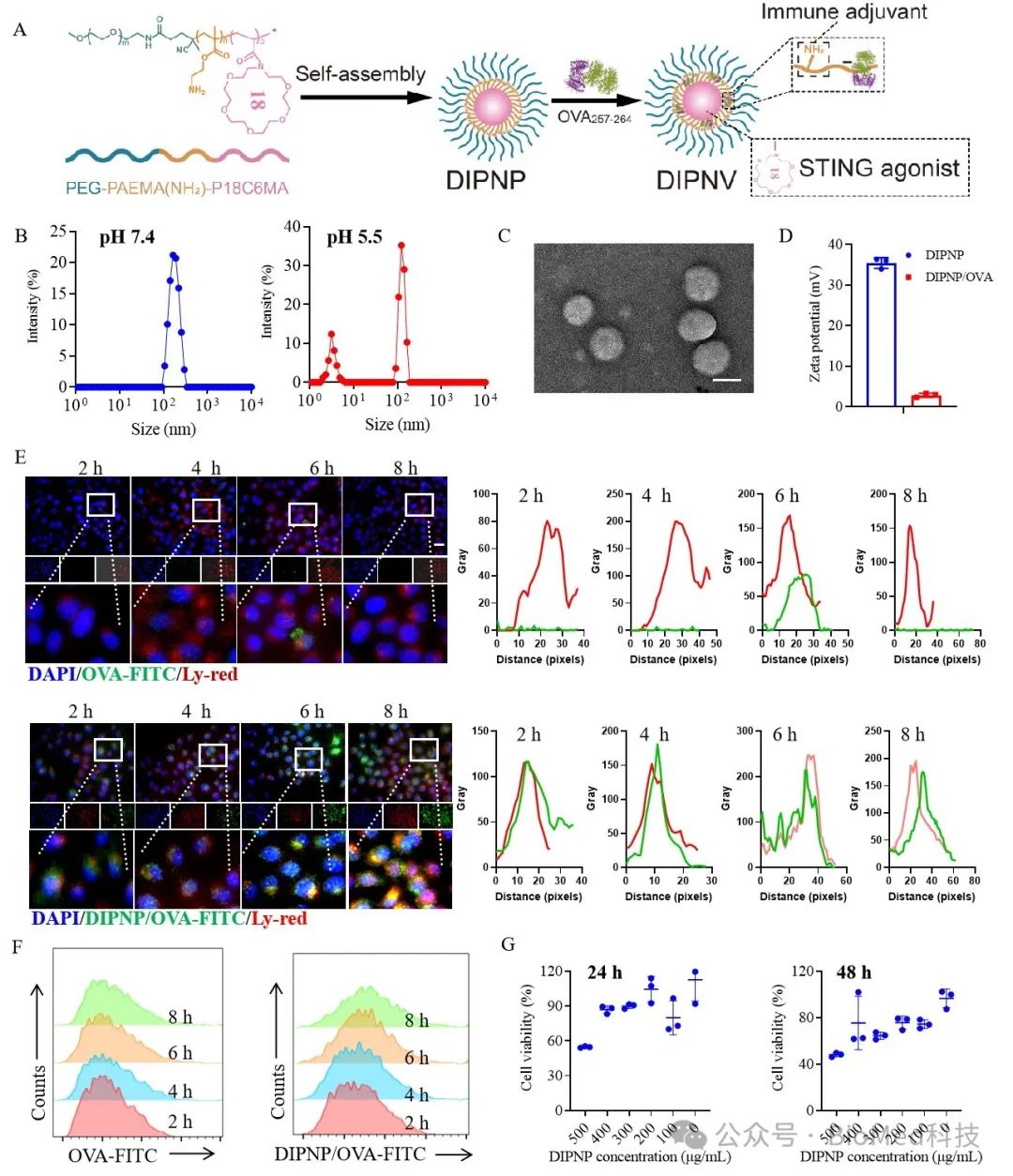
图1 DIPNV的制备和表征。
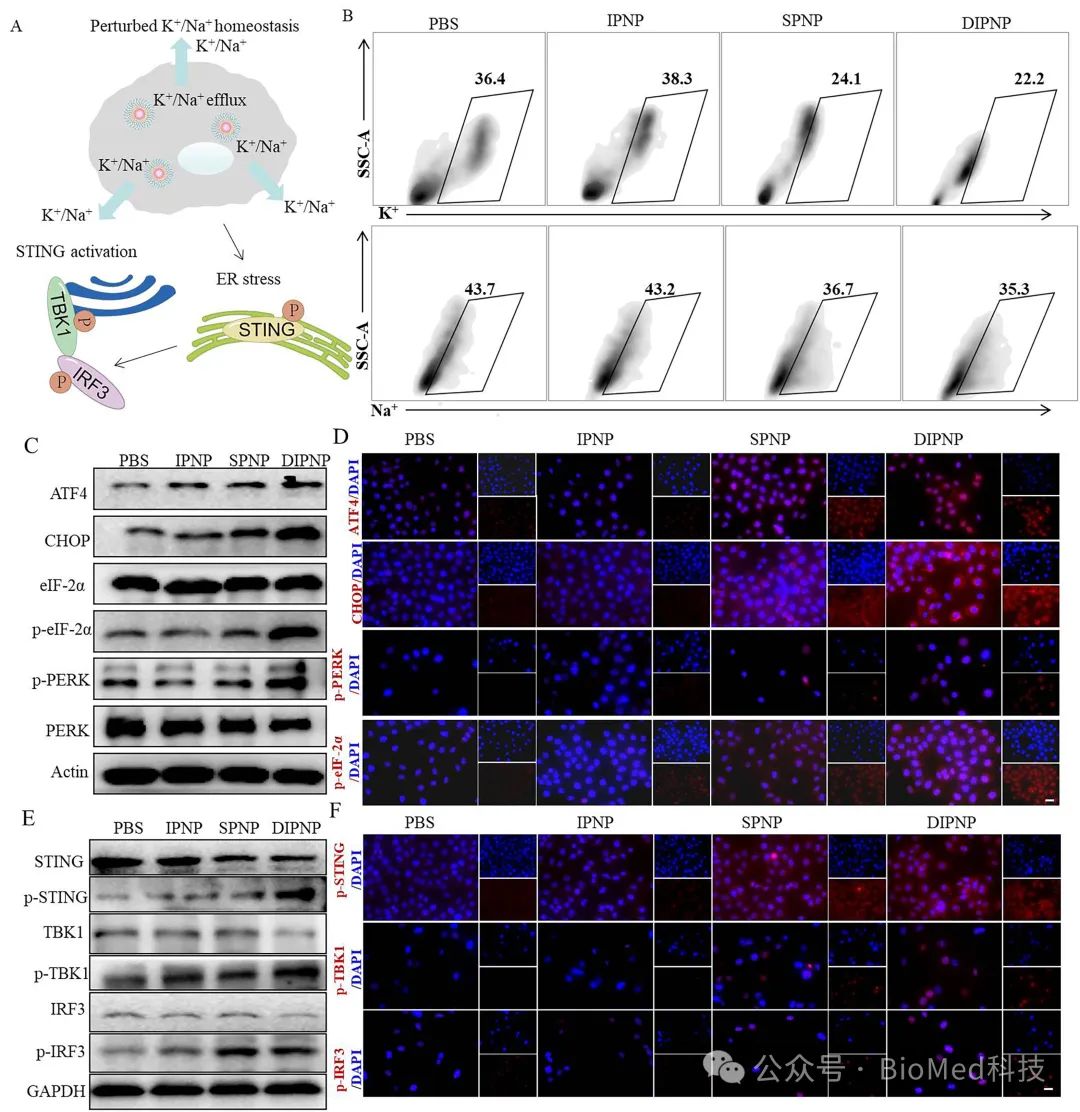
图2 胞内钾离子稳态及STING激活研究。
在B16-OVA和EG7-OVA两种肿瘤模型中,该纳米疫苗显著抑制了肿瘤生长,并诱导了长期免疫记忆反应(图3)。
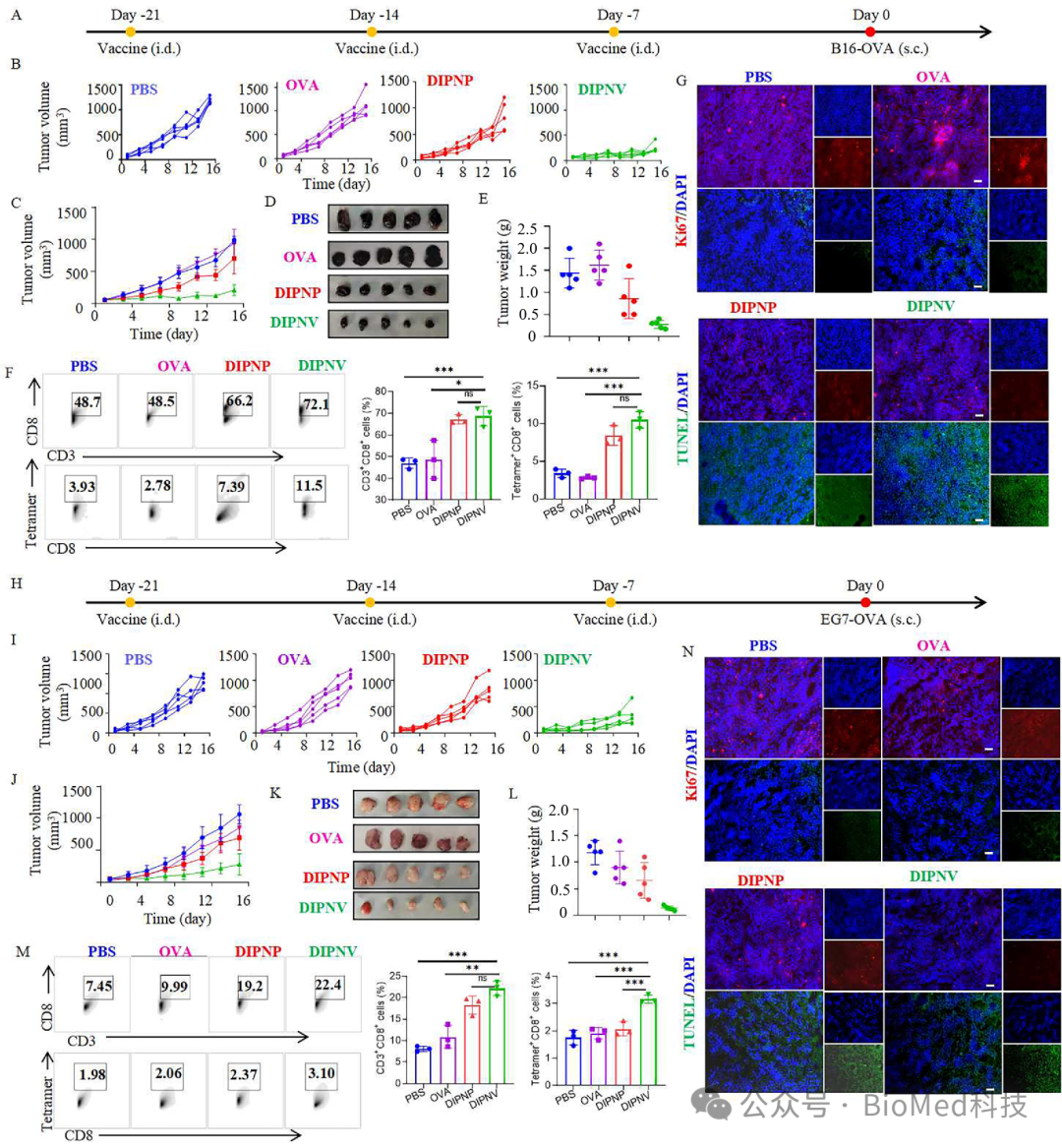
图3 DIPNV的体内预防性抗肿瘤免疫疗效。
研究团队进一步利用切除的自体原发肿瘤细胞膜修饰聚合物纳米载体,开发了一种个性化纳米疫苗(DIPNP@M)。研究发现,其在同种肿瘤模型中表现出强大的抗肿瘤活性,为术后预防肿瘤复发和转移提供了新的思路(图4)。
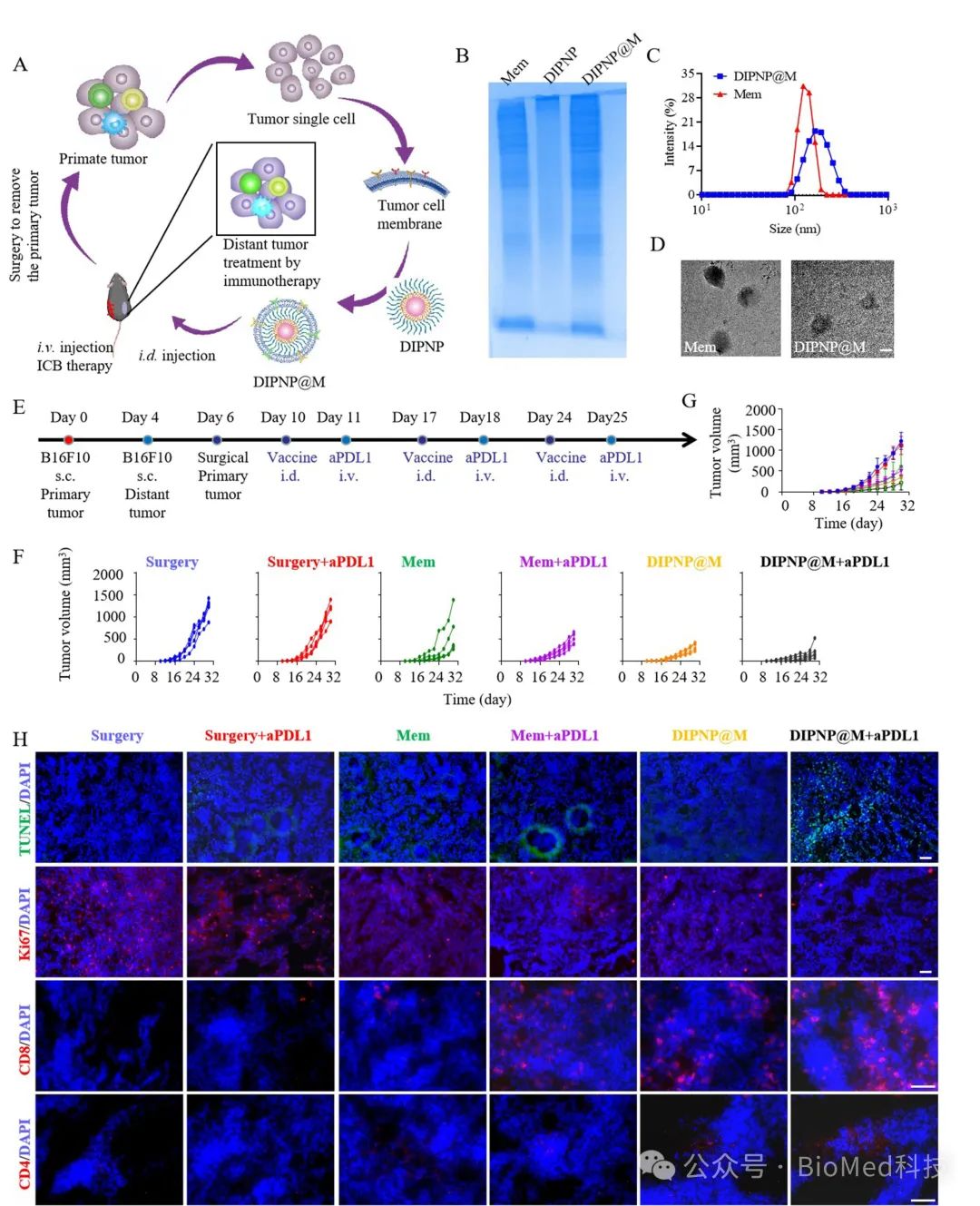
图4 DIPNP@M个性化纳米疫苗与ICB协同治疗术后远端肿瘤。
该研究首次揭示了聚合物纳米载体通过干扰树突细胞内离子稳态诱导STING激活的机制,包裹OVA得到聚合物纳米疫苗后,在多种肿瘤模型中展现了预防性及抗肿瘤免疫活性;制备得到个性化纳米疫苗后,亦可显著抑制同源远端肿瘤体积增长。这种“多功能一体化”的聚合物纳米平台,利用载体自身免疫活性不仅简化了设计,还保留了强治疗效果。另其具有合成简单、可重复操作等优势,在临床转化方面具有巨大应用潜力。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c11014


