Nat Commun:南京医科大学吴剑卿/吴双双等合作发现SOAT2表达的增加与胆固醇代谢改变和抗肿瘤免疫力降低有关
时间:2025-01-21 12:09:02 热度:37.1℃ 作者:网络
免疫功能会随着年龄的增长而下降,导致对包括肿瘤在内的各种疾病的易感性增加。因此,探索老年癌症患者衰老相关的分子靶点备受追捧。
2025年1月13日,南京医科大学吴剑卿、吴双双及南通大学褚敏捷共同通讯在Nature Communications 上在线发表题为“Increased SOAT2 expression in aged regulatory T cells is associated with altered cholesterol metabolism and reduced anti-tumor immunity”的研究论文。研究发现ER跨膜酶,固醇o -酰基转移酶2 (SOAT2)在老年肺鳞状细胞癌(LSCC)患者的调节性T细胞(Treg)中过表达,而LSCC患者的影像组学分析表明SOAT2表达增加与免疫浸润减少和不良预后相关。
机械上,体外人类和小鼠Treg细胞数据和体内小鼠肿瘤模型表明,在Treg细胞中SOAT2过表达通过激活SREBP2-HMGCR-GGPP通路促进胆固醇代谢,从而增强Treg抑制功能,但降低CD8+ T细胞的增殖,迁移,稳态和抗肿瘤免疫。因此,研究确定了在免疫衰老的背景下,Treg功能改变的潜在机制,并提示SOAT2可作为肿瘤免疫治疗的潜在靶点。

根据国际癌症研究机构(IARC)发布的最新全球癌症数据,2021年乳腺癌新发病例达到226万,超过肺癌的220万,成为全球最大的癌症。然而,在40岁以上的男性和60岁以上的女性中,肺癌造成的死亡人数远远超过乳腺癌、前列腺癌、结直肠癌和白血病的总和,使其成为威胁老年人健康的主要癌症。老年人肺鳞状细胞癌(LSCC)的发病率较高,并随着年龄的增长而逐渐增加。近一半的患者在确诊时年龄超过70岁。此外,老年LSCC患者的中位生存期比其他非小细胞肺癌(NSCLC)亚型患者短约30%。因此,探索影响老年LSCC进展的分子机制并寻找改善老年患者预后的特定治疗靶点具有重要意义。
免疫系统识别并消除体内衰老和癌细胞,在免疫监视和维持身体内部环境的稳定性中发挥重要作用。众所周知,免疫系统功能下降是生物体衰老的主要特征之一,这导致了许多与衰老相关的疾病的发生。此外,衰老和肿瘤发生的机制也有一定的相似性。越来越多的证据表明,由类似机制驱动的基因组和表观基因组改变在衰老细胞和癌细胞中均可发现。此外,在DNA损伤剂诱导的衰老细胞和癌细胞中,细胞核cGAS可以介导L1逆转录转座的抑制。因此,阐明肿瘤发病机制与衰老之间的因果关系对于制定有效的老年肿瘤治疗策略至关重要。
越来越多的证据表明,调节性T(Treg)细胞的免疫功能增强被认为是老年癌症人群预后不良的罪魁祸首。Treg细胞依靠脂肪酸氧化和氧化磷酸化生存,并通过糖酵解促进增殖、分化和抑制功能。此外,细胞内糖脂代谢物通过调节FOXP3的表达影响Treg细胞的转录程序和功能可塑性。此外,mTORC1促进体内Treg细胞的代谢重编程,导致依赖于甲羟戊酸通路的脂肪生成和胆固醇生物合成增加,以支持Treg细胞增殖和功能。糖脂代谢紊乱的老年人比例远高于年轻人。探究糖脂代谢异常后Treg细胞的功能变化,或为老年癌症患者的治疗提供新的线索。
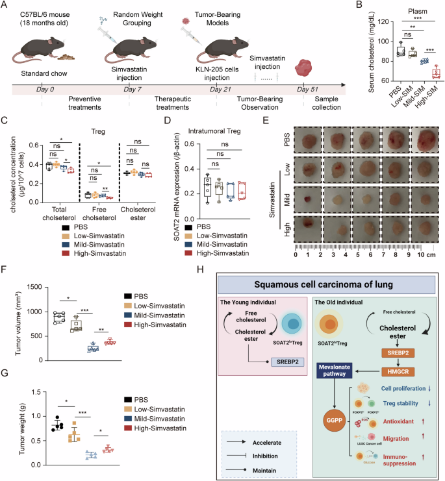
胆固醇的过度抑制会促进老年小鼠的肿瘤生长(摘自Nature communications )
固醇o -酰基转移酶2(SOAT2)是一种内质网跨膜酶,可将胆固醇和脂肪酸转化为储存在细胞质液滴中的胆固醇酯(CE),保护细胞免受游离胆固醇的毒性。SOAT2在人类白细胞和单核细胞中的表达调节免疫细胞的分化和功能维持。此外,有研究表明,抑制SOAT2的酶活性可以抑制T细胞的增殖。然而,SOAT2药物调节Treg细胞的潜在机制仍不清楚。
在这项研究中,发现SOAT2基因在老年人群的Treg细胞上特异性过表达。使用体外和体内实验,观察到SOAT2表达的Treg细胞通过促进Treg细胞中的胆固醇代谢来诱导效应T细胞衰老,并最终抑制抗肿瘤免疫。Treg细胞中过表达SOAT2通过激活SREBP2-HMGCR-GGPP通路促进Treg细胞中的胆固醇代谢,导致效应T细胞衰老的诱导和抗肿瘤免疫的抑制。这些研究确定了一种导致老年人群肿瘤免疫发病机制的新机制,表明SOAT2可能是肿瘤免疫治疗的潜在靶点。
参考消息:
https://doi.org/10.1038/s41467-025-56002-w


