西南交通大学郭星、周绍兵教授Biomaterials:抑制星形胶质细胞LCN2促使其向A2表型转换:缺血性脑卒中治疗新策略
时间:2025-01-20 12:12:43 热度:37.1℃ 作者:网络
星形胶质细胞在缺血再灌注损伤后被激活为“反应性星形胶质细胞”,其中A1表型会导致神经元和少突胶质细胞死亡,而A2表型则具有神经保护作用,因此将反应性星胶调控为A2型是卒中治疗的潜在靶点。Lcn2水平与星胶的表型转变密切相关。通过AAV-Lcn2-shRNA腺病毒沉默Lcn2基因,可导致MCAO小鼠脑内A1型星胶显著减少,A2型星胶增加。基于此,西南交通大学郭星、周绍兵教授团队开发了一种通过抑制Lcn2治疗卒中的纳米平台,该平台由PGP肽修饰的棒状PLGA纳米粒子装载罗利普兰(AP@R)制备而成。AP@R可同时通过形态介导的被动靶向和CXCR2受体介导的主动靶向被中性粒细胞高效捕获,并由其介导穿过血脑屏障(图1)。AP@R入脑后释放罗利普兰通过抑制NF-κB通路降低Lcn2水平,从而逆转促炎的A1表型星胶极化为抗炎的A2表型,缓解神经炎症,促进血脑屏障修复。相关工作以“Regulating astrocyte phenotype by Lcn2 inhibition toward ischemic stroke therapy”为题发表于Biomaterials。
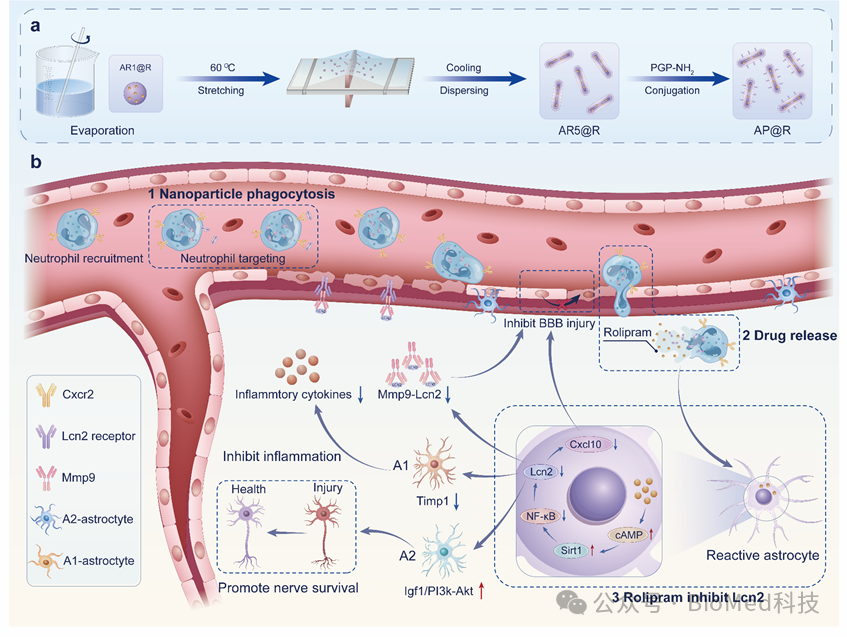
图1棒状PLGA纳米颗粒搭乘中性粒细胞入脑抑制LCN2逆转星型胶质细胞表型
我们利用AAV-Lcn2-shRNA腺病毒沉默小鼠脑内Lcn2基因,研究Lcn2的表达是否影响体内星形胶质细胞表型(图2a)。通过免疫荧光染色观察星形胶质细胞表型变化,AAV-对照组和AAV-Lcn2组均表现出较强的AAV荧光,表明腺病毒在小鼠脑内成功复制(图2b)。与C3和S100A10信号较弱的Sham组相比,MCAO手术引起AAV对照组A1和A2表达上调。预先用AAV-Lcn2-shRNA腺病毒治疗卒中小鼠的脑内具有较弱的C3荧光及增强的S100A10荧光。与免疫荧光结果一致,AAV-Lcn2处理显著抑制MCAO小鼠C3基因表达,同时上调S100A10表达水平(图2c)。接下来,我们以AP@R治疗卒中小鼠,检测抑制Lcn2对星形细胞表型极化的影响。由于反应性星形胶质细胞的异常增殖,MCAO组显示出强烈的GFAP、Lcn2和C3荧光信号,且大部分Lcn2或C3与GFAP共定位,说明Lcn2主要由反应性星形胶质细胞表达,且反应性星形胶质细胞多为A1表型。罗利普兰在一定程度上降低了Lcn2和C3的强度,并增强了S100A10的荧光。在AP@R治疗的小鼠大脑中可以观察到最弱的Lcn2和C3信号以及最强烈的S100A10信号(图2d)。qPCR检测mRNA表达进一步验证了免疫荧光结果,AP@R治疗导致C3基因水平下调50.7%,S100A10基因水平上调73.1%(图2e)。以上结果说明AP@R可有效将A1星形胶质细胞极化为A2表型。
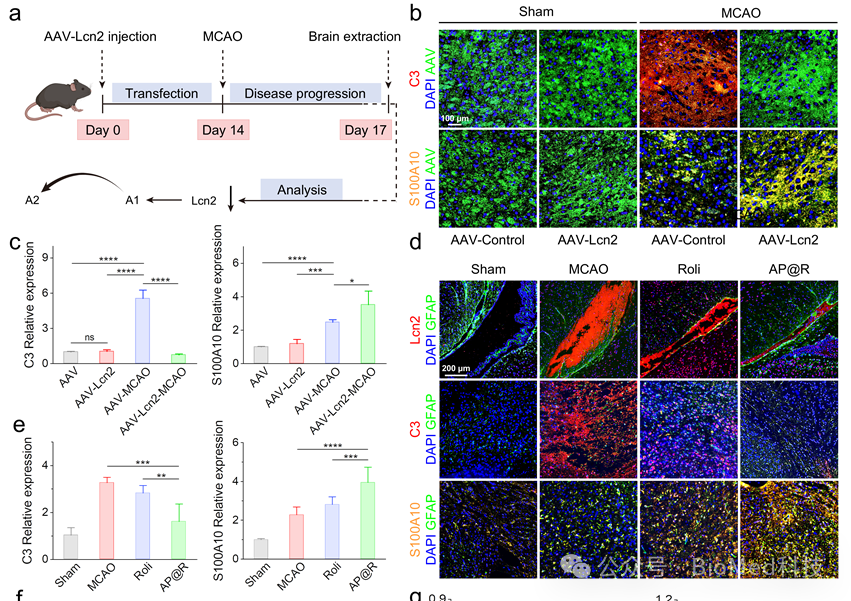
图2 AP@R纳米颗粒治疗MCAO小鼠后大脑星形胶质细胞向A2表型极化
在MCAO小鼠的大脑中,NF -κB p65的核荧光信号非常明显(图3a)。这表明细胞应激和炎症反应促进了NF -κB从细胞质向细胞核的转移,从而增强了其在转录调控中的作用。AP@R治疗显著降低了核荧光强度,信号主要定位于细胞质,结合Western blot和qPCR结果共同表明(图3b-e),AP@R治疗通过上调cAMP水平激活SIRT1,进而增加细胞质中的IκBα以抑制NF -κB p65的核转移,最终阻断NF-κB信号传导,下调Lcn2的表达。为了进一步确认AP@R的治疗机制,进行了转录组分析。与MCAO组相比,AP@R组中有32个与卒中相关的基因表现出显著差异表达(图3f)。基因分析表明,调节星胶表型的作用可能涉及SIRT1-NF-κB和PI3K-Akt信号通路(图3g),从而减轻炎症反应并实现神经保护效果。
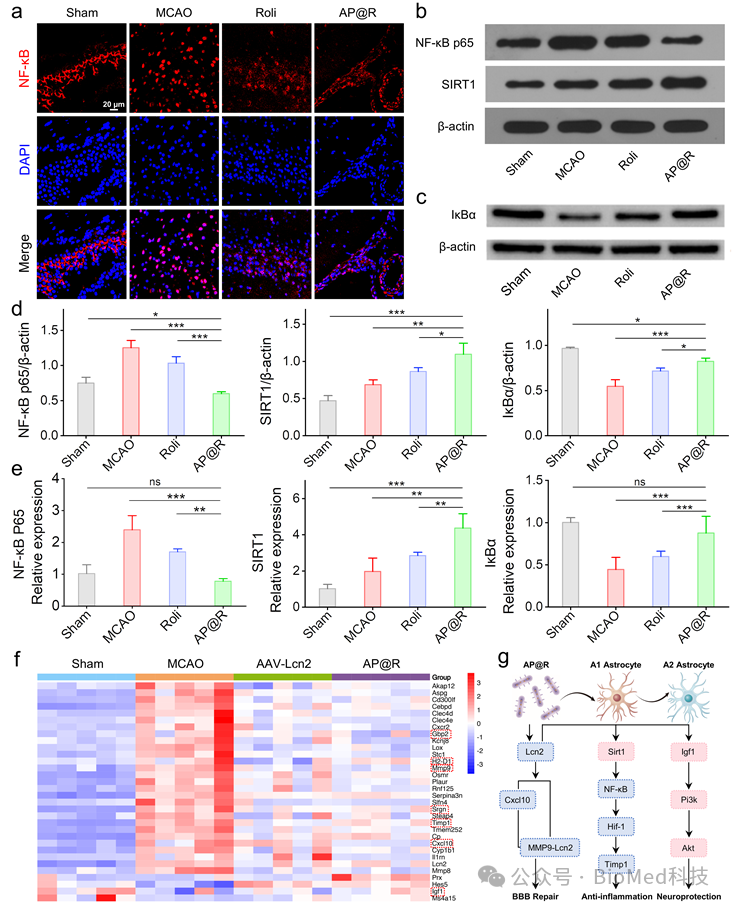
图3 AP@R调控星形胶质细胞表型转变的机制
原文链接:
https://www.sciencedirect.com/science/article/abs/pii/S0142961225000213


