Nat Commun:苏州大学徐杨/吴德沛/陈苏宁合作研究发现CPSF6-RARγ促进RARG融合急性髓系白血病的髓系转化
时间:2025-01-17 12:10:56 热度:37.1℃ 作者:网络
视黄酸受体γ(RARG)融合的急性髓系白血病(AML)是一种临床特征与急性早幼粒细胞白血病(APL)相似、预后较差的新型白血病亚型。RARG融合白血病的潜在机制仍然知之甚少,需要紧急探索以指导制定有效的治疗策略。
2025年1月13日,苏州大学徐杨、吴德沛及陈苏宁共同通讯在Nature communications 上在线发表题为“CPSF6-RARγ interacts with histone deacetylase 3 to promote myeloid transformation in RARG-fusion acute myeloid leukemia”的研究论文。研究使用最普遍的RARG融合,CPSF6-RARG(CR)作为代表,揭示了CR融合增强了骨髓祖细胞的扩增,损害了它们的成熟,并与RAS突变协同作用,以驱动更具侵袭性的骨髓恶性肿瘤。
机制上,CR融合与组蛋白脱乙酰酶3(HDAC3)相互作用,以抑制与骨髓分化相关的基因的表达,包括骨髓转录因子PU.1。破坏CR-HDAC3相互作用,恢复PU.1表达和髓系分化。此外,HDAC抑制剂在体外和体内有效抑制CR驱动的白血病。因此,研究数据揭示了致癌CR融合的分子基础,并通过CR融合提供了一种针对AML的潜在治疗方法。

用全反式维甲酸(ATRA)和三氧化二砷(ATO)治疗急性早幼粒细胞白血病(APL)的成功通过诱导未成熟癌细胞的分化,彻底改变了癌症治疗。分化疗法使PML-RARA融合患者受益匪浅,总生存率超过95%。APL携带t(15:17)染色体易位,导致PML基因与视黄酸受体α(RARA)融合。虽然PML-RARA融合驱动APL的发病机制,但它也决定了对ATRA或ATO的敏感性。除了PML基因外,RAR基因还经常易位到基因组中的其他区域,导致APL样髓系白血病的各个亚类出现不同的RAR融合基因。尽管与t(15:17)易位具有相似的临床特征,但APL样髓系白血病对ATRA和/或ATO治疗不敏感,通常预后不佳。此外,发病机制的分子机制在很大程度上是未知的,亟需开发有效的治疗策略。
视黄酸受体γ(RARγ)是正常血细胞发育的关键调节因子。它通过Notch1信号传导调节造血干细胞(HSC)自我更新。中断RARG基因突变会损害正常的造血功能,并易导致髓系恶性肿瘤的发展。最近,随着高通量测序技术在诊断中的进步和应用,RARG重排在骨髓恶性肿瘤中经常被报道。一项全球研究表明,RARG融合患者形成了一个独特的组,其形态、免疫表型、转录景观和其他特征与PML-RARA的APL患者相似。然而,这些患者对ATRA或ATO治疗不敏感。携带RARG融合的患者临床结局较差,2年复发率为68.7%,生存率为33.5%。
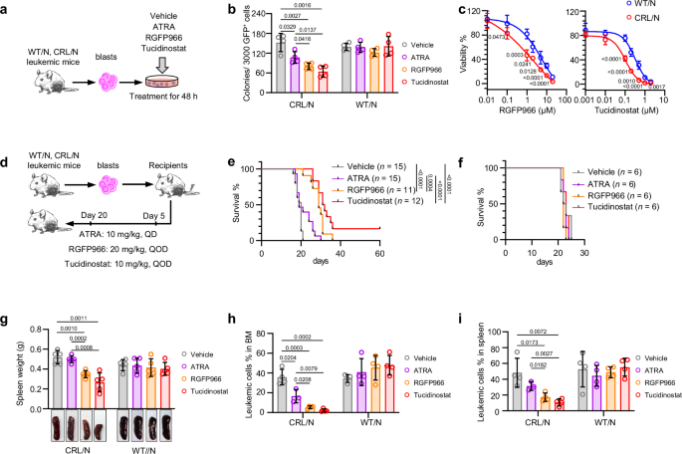
CR 融合性白血病对HDAC抑制剂敏感(摘自Nature communications )
已报道超过6种不同类型的RARG融合,包括CPSF6-RARG(CR)、NUP98-RARG、HNRNPc-RARG、HNRNPm-RARG、PML-RARG和NPM1-RARG。CR和NUP98-RARG是患者最常观察到的2种融合,发生率分别为41%和32%。有趣的是,RARG融合患者经常携带RAS家族基因的并发突变,表明白血病发生中的2个遗传事件之间可能存在合作。所有RARG融合都保留了保守的DNA结合结构域,这些结构域在转录调控中起着重要作用。RARγ发挥转录抑制和激活的双重作用,同时通过募集辅阻遏物和组蛋白脱乙酰酶(HDAC)来抑制转录。RARG与不同伴侣基因的融合可能通过募集不同的抑制因子来改变转录调控的基因组占有率和功能,这可能导致疾病的发展。
在这里,研究证明CR融合会损害CR敲入小鼠和人CD34+细胞异种移植模型中的骨髓发育。CR融合与HDAC3相互作用以抑制基因表达,并与NRASG12D或KRASQ61H协同驱动更多晚期髓系恶性肿瘤。干扰CR- HDAC3相互作用可选择性地抑制CR融合白血病,这可能是一种潜在的治疗选择。
参考消息:
https://doi.org/10.1038/s41467-024-54860-4


