CAR-T治疗T细胞肿瘤的现状和未来
时间:2025-01-15 12:14:52 热度:37.1℃ 作者:网络
CAR-T
CAR-T疗法对 B 细胞淋巴瘤和白血病有效,也促使了针对 T 细胞恶性肿瘤的 CAR-T 疗法的发展。T 细胞淋巴瘤和 T 细胞急性淋巴细胞白血病(T-ALL)具有高度异质性,但都有一个共同点,即在复发/难治性(r/r)环境中预后不良,并且缺乏新型靶向治疗。CAR-T 疗法是治疗这些疾病有前景的解决方案,但也存在挑战,主要在于靶抗原通常在恶性 T 细胞和正常 T 细胞之间共享,可能导致自相残杀(antigens)和 T 细胞发育不良(aplasia)。
《Blood Advances》近日发表综述,讨论了CAR-T治疗 T-ALL 和 T 细胞淋巴瘤的现状,重点介绍了针对 T 细胞恶性肿瘤的最新临床数据,并讨论了未来可以吸取的经验教训。

引言
T 细胞白血病和淋巴瘤是一组异质性的侵袭性血液肿瘤,往往对化疗耐药,预后不良。在成人和儿童ALL中,T-ALL/T 细胞淋巴母细胞淋巴瘤(T-LBL)分别占 25%和 10-15%。T 细胞淋巴瘤(TCL)约占所有非霍奇金淋巴瘤(NHL)的 12%,它们要么是惰性的,如大多数皮肤 T 细胞淋巴瘤(CTCL),要么是侵袭性的,如外周T 细胞淋巴瘤(PTCL)。
T 细胞恶性肿瘤的免疫疗法方面进展缓慢,唯一获批用于 T 细胞淋巴瘤的单克隆抗体(MoAb)是莫格利珠单抗(mogamulizumab),这是一种人源化的抗 CCR4 IgG1 抗体。T-ALL中尽管没有获批药物,但抗 CD38 单克隆抗体达雷妥尤单抗显示出临床疗效。抗体药物偶联物(ADC)是替代方法,2022 年美国FDA批准了 靶向CD30的 ADC 维布妥昔单抗用于 CD30 阳性 T 细胞淋巴瘤。贝林妥欧单抗等双特异性 T 细胞衔接抗体(TCE)已成为治疗 B-ALL的有效选择,但目前还没有治疗T-ALL 的类似药物。
CAR-T 疗法是近年来 B 细胞恶性肿瘤治疗方面最重要的进展之一,经过改造的 T 细胞表达一种合成嵌合抗原受体(CAR),以不依赖主要组织相容性复合物(MHC)的方式靶向肿瘤抗原。因此业内一直热衷于为 T 细胞恶性肿瘤开发类似的 CAR-T 疗法,然而存在一些独特的挑战。但最近的临床突破表明,CAR-T 在T-ALL和TCL中的未来前景非常广阔,CAR-T 或许可以为许多患者带来治愈的希望。
CAR-T治疗T细胞恶性肿瘤的挑战
大多数可靶向的 T 细胞抗原并非肿瘤特异性,它们也表达在健康的 T 细胞上(图 1)。其中一个最重要的障碍是“自相残杀”,即在 CAR-T 细胞上表达的靶抗原会导致自体杀伤,从而给制备带来困难,并有可能导致 CAR-T 产品在体内功能丧失。
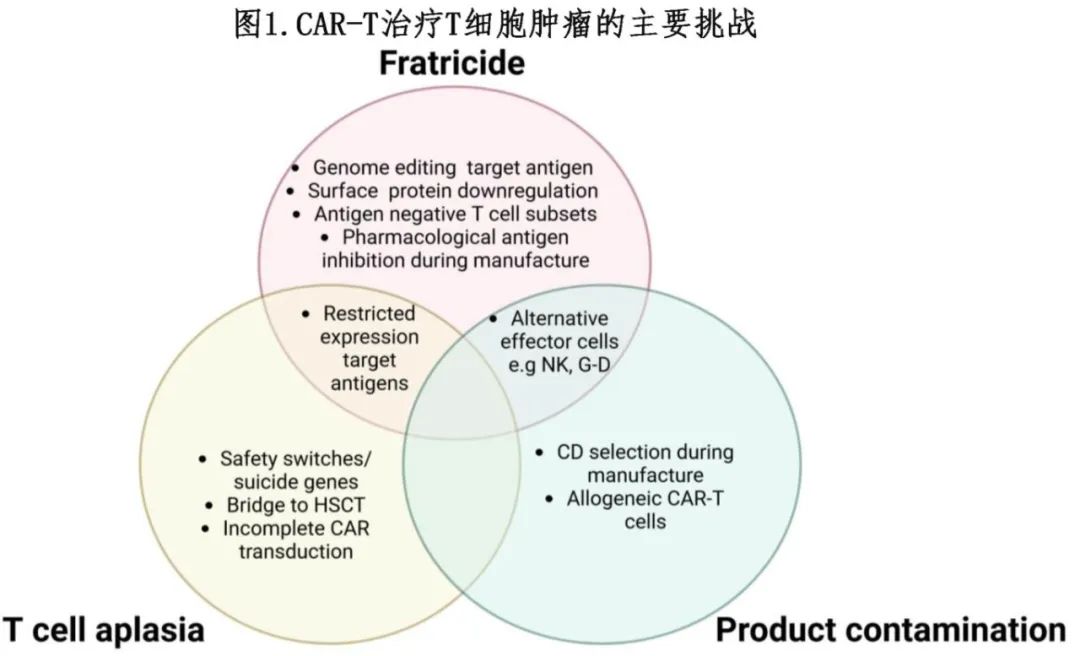
T 细胞发育不良是泛T抗原CAR-T 治疗的自然结果。对于B 细胞发育不良,B 细胞发育不良时 IgG 免疫球蛋白可以提供一定的免疫保护,而 T 细胞没有类似的替代疗法,可能导致重度机会性感染率较高。
产品污染描述了这样一种理论风险,即在 CAR-T 生产过程中,恶性 T 细胞在不经意间被采集、重新输注和/或转染 CAR 构建体,从而导致复发风险——正如之前在 B-ALL中抗 CD19 CAR-T所报道的那样。由于缺乏能区分正常 T 细胞的细胞表面标志物,且患者体内循环肿瘤水平往往较高,这种风险在 T 细胞恶性肿瘤中可能更高。
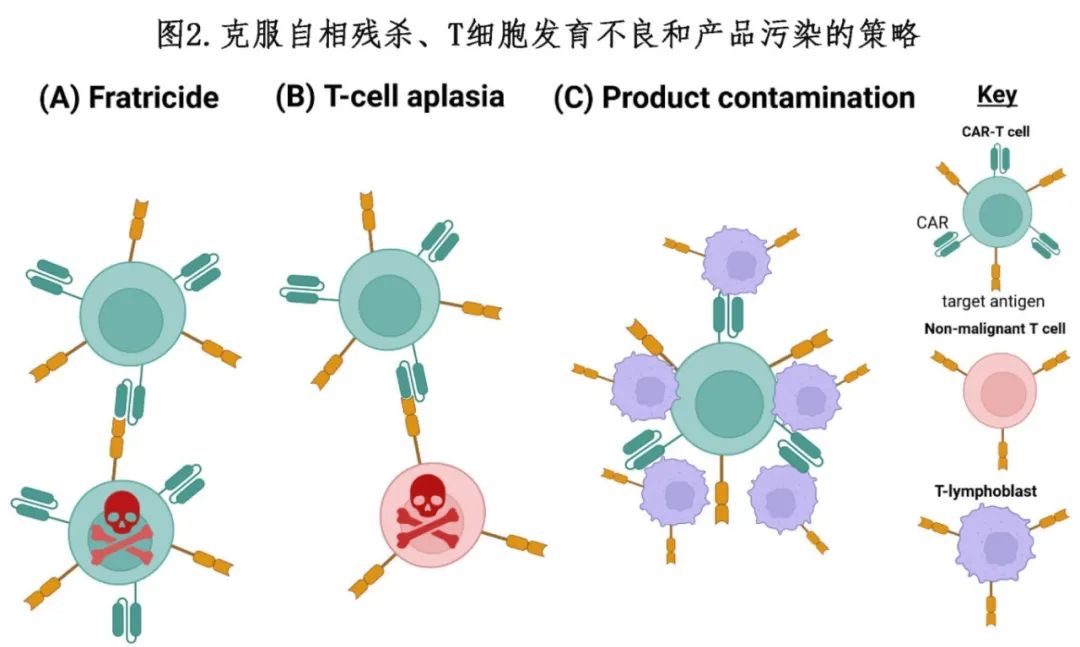
关于减少自相残杀、T 细胞发育不良和产品污染的方法见图 2。在克服自相残杀和 CAR-T 制备方面取得的成功,使得推进到临床阶段测试成为可能。
CAR-T 治疗T细胞恶性肿瘤的临床试验数据
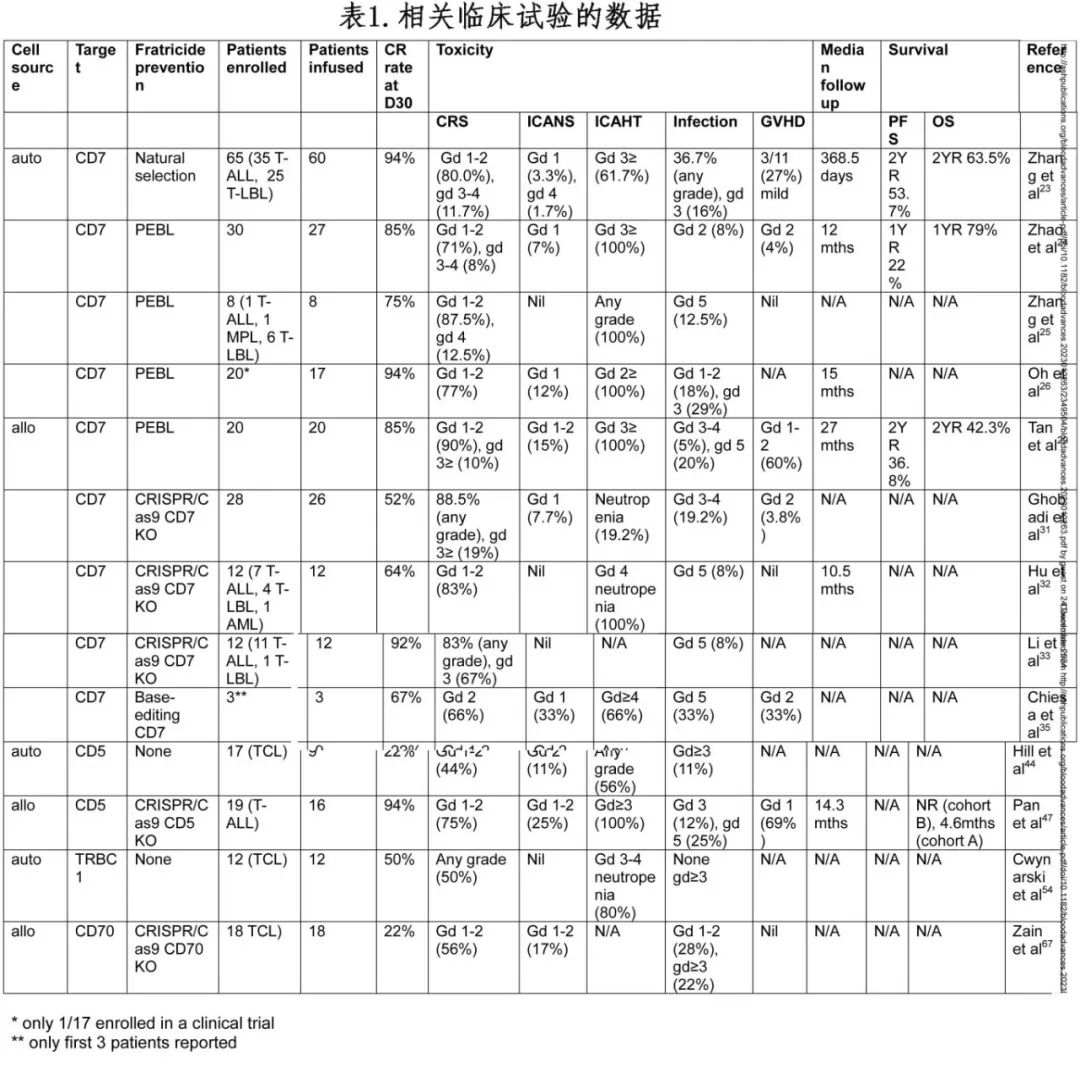
针对 T 细胞恶性肿瘤的 CAR-T 临床试验仍处于起步阶段,但在 T-ALL方面近期出现了令人兴奋的临床进展。下文为正在进行的试验和已报告结果的试验(表 1)。
T-ALL/T-LBL
CD7
CD7 是一种 1 型跨膜糖蛋白,在 95%的T-ALL、一部分TCL、成熟的 T 细胞和 NK 细胞中表面表达水平高且均匀,但在其他非造血细胞中不存在。CD7 在 T 细胞中的作用尚不清楚,但CD7 缺陷型小鼠没有明显的免疫缺陷。<5%的 T 细胞为 CD7 阴性。
自体CD7 CAR-T细胞制品
在一项 I 期试验(NCT04572308)中,在进行 CD7 CAR 转导之前,T 细胞未经过处理,在制备过程中经历 CD7 阴性细胞的“自然选择”。95%的患者(14 例 T-ALL,6 例 T-LBL)实现MRD阴性骨髓完全缓解(CR),25%实现髓外CR。18 例患者出现≤2 级细胞因子释放综合征(CRS),其中 1 例为 3 级 CRS,2 例1 级神经毒性(ICANS)。在 II 期随访中(35 例 T-ALL和 25 例 T-LBL),两年总生存率(OS)和无进展生存率(PFS)分别为 63.5%和 53.7%,其中 37 例CR患者接受allo-HSCT巩固治疗后PFS显著提高。10 例未移植患者中有 8 例复发,且大多为 CD7 阴性疾病。36.7%的患者出现任何级别感染(败血症、肺部感染及CMV/EBV)。
另一项研究(NCT04840875)使用抗 CD7 蛋白表达阻滞剂(PEBL)下调表面CD7。只有检测不到外周淋巴母细胞的患者才纳入研究,并且在确认无白血病后才放行 CAR-T 产品。血液毒性(ICAHT)是最常见的不良事件,但第 30 天时63%的患者≤2 级。发生两起 3/4 级 CRS 事件,但只有两起 1 级 ICANS 事件。20/27 例患者接受了allo-HSCT。所有 7例未接受allo-HSCT的患者均进展,为 CD7+或CD7-疾病。移植的20 例患者中有 15例在中位随访 14.1 个月时仍为MRD阴性状态。4 例患者在移植后复发(3 例CD7+,1例CD7-),1 名患者死于败血症。
在一项关于自体纳米体来源、PEBL CD7 CAR-T 细胞的试验(NCT04004637)中,28 天时6/8(75%)达到CR。有 1 例 4 级CRS,无ICANS。1 例CR患者死于腹部感染。
在一组接受 PEBL 阻断 CD7 CAR 治疗的患者中,所有 17 例初始产品均有白血病细胞污染(0.01-60.3%),但制备后均未检测到。未出现≥3 级CRS 或 ICANS,但均发生2+级ICAHT。16/17例实现MRD阴性CR。中位随访 15 个月,allo-HSCT巩固的患者中9/9存活且无白血病,而未移植的 8 例中有 2 例;其余 6 例中有 3 例复发(2/3 为 CD7-疾病)。所有复发的 T-ALL均未显示 CAR 表达。缓解期3 例死亡,1 例为真菌感染,2 例为神经系统并发症。
异基因CD7 CAR-T细胞制品
一项PEBL 阻断 CD7 CAR-T 细胞的 1/2 期试验(NCT04689659)纳入20 例 T-ALL,接受由之前人类白细胞抗原(HLA)相合或单倍体相合造血干细胞移植供者或新的配型供者制备的 CAR-T 细胞治疗。17/20 实现MRD阴性CR,7 例患者接受allo-HSCT。10%发生3-4 级CRS,60%发生1-2级急性GvHD。4 例发生病毒再激活。1 例未移植的患者在 5.5 个月时死于真菌性肺炎。在2 年的随访中,PFS和OS分别为 36.8%和 42.3%。移植患者中6/7复发(4/6 为 CD7 阴性)(NCT04689659)。12 例未进行allo-HSCT的患者中的长期严重不良事件包括 4 例 5 级感染和 1 例 4 级肠道 GvHD。
在 2 期 WU-CART-007 试验(NCT04984356)中,对 CD7 和 T 细胞受体α恒定区(TRAC)进行编辑。在可评估的患者中,82%(9/11)达到CR。中位随访 2.7 个月,6/11 例患者仍缓解。所有患者均出现CRS(4例患者为 3+级)。5/13例患者发生3+级感染。未发生GVHD。有两例 5 级事件(真菌性败血症和 CRS/疾病进展)。
在一项纳入 12例患者(11例T-ALL/T-LBL和1例AML)的 1 期试验(NCT04538599)中,使用健康供者的外周血单个核细胞(PBMC)制备CD7 CAR-T 细胞,通过 CRISPR/Cas9 编辑 CD7、T 细胞受体(TCR)和 HLA II 类分子,并引入 NK 细胞抑制剂。63.6%(7/11)达到CR。三例应答者接受了allo-HSCT。中位随访 10.5 个月,4 例患者仍处于缓解状态。未报告GVHD或ICANS。10例患者出现1-2 级CRS。观察到CMV和EBV再激活,并且有 1 例患者死于 EBV+ DLBCL。
GC027 是一种 CD7 CAR-T 疗法,采用 CRISPR/Cas9 技术破坏 CD7 和 TRAC。在 11/12 例r/r T-ALL/T-LBL患者中实现CR(ChiCTR1900025311)。1 例患者接受allo-HSCT巩固治疗但死于GVHD。4 例患者复发,包含CD7+和CD7-。
最近报道了一种新颖的CD7 CAR-T 疗法策略,随后进行单倍体相合HSCT,无需清髓或预防GVHD。10 例患者中CRi达到 100%。中位随访 15.1 个月6 例患者仍处于缓解状态,而 2 名患者复发伴CD7-疾病,其中1例患者死于败血症。
在最初使用经过碱基编辑以使 CD52、CD7 和 TRBC 失活的抗 CD7 异基因 CAR-T 的报告中,2 例r/r T-ALL患儿在 CAR-T 治疗后持续分子学缓解,并在CAR-T序贯allo-HSCT巩固治疗后实现免疫重建。还有 1 例患者实现MRD+缓解,但死于机会性真菌感染。
CD5
CD5 是一种跨膜糖蛋白,在约 80%的 T-ALL和 87.5%的PTCL中表达。正常表达仅限于 T 细胞和一小部分 B 细胞。
关于未经改造的抗 CD5 CAR-T 细胞的初始临床前报告显示,存在有限且短暂的自相残杀现象,同时 CAR-T CD5 的表达下调,原因在于 CD5 迅速且完全内化。
Baylor工作组发表了在 T-ALL中使用抗 CD5 CAR-T 的初步数据。使用传统生产工艺的初始缓解率很低(1/8 缓解),与 CAR-T 细胞的终末分化表型有关。在生产过程中添加酪氨酸激酶抑制剂(TKI)达沙替尼和伊布替尼后缓解率有所改善。在 TKI 制备组,4/7例患者获得MRD阴性CR。两例患者出现EBV血症,并死于移植后淋巴组织增生性疾病(PTLD)。
一项异基因基因编辑 CD5 CAR-T 的 1 期试验(NCT05032599)纳入 19例r/r T-ALL患者,其中 16 例成功制备 CAR-T 细胞;CAR-T 产品来自之前的移植供者(A 组,n=11)或新配型的供者(B 组,n=5)。100%(16/16)实现CR/CRi。患者为重度经治,包括 10/16 曾接受过 CD7 CAR-T 治疗。所有患者都出现 3 - 4 级ICAHT,其中 A 组中有 7/11未恢复。75%的患者出现1-2 级CRS,25%的患者出现 1-2 级ICANS。69%的患者出现 1 级皮肤GVHD。随访中位 14.3 个月,4 例接受巩固性allo-HSCT的患者中有 3 例仍处于缓解状态;12例未移植的患者中有 2例仍处于缓解状态,而 3例复发(CD5 阴性),5例死于感染,2例死于血栓性微血管病。A 组因致命晚期感染导致试验终止:出现2例 3 级和4例 5 级感染,包括细菌、真菌、EBV 和 CMV 感染。
TCL
CD5
MAGENTA 试验(NCT03081910)报告了 17 例 TCL 患者的结果,13 例患者制备CAR-T 细胞,9 例患者接受治疗。未观察到>2 级CRS或ICANS。ORR为 44%,2 例CR。该研究采用上述更新的生产工艺。
三例血管免疫母细胞性 T 细胞淋巴瘤(AITL)和皮下脂膜炎样 T 细胞淋巴瘤(SPTCL)的患者接受 CD5 CAR-T 治疗,其带有工程化的 tEGFR 安全开关(NCT04767308)。1例患者达到CR,但死于败血症;2例患者达到PR,其中一例接受allo-HSCT,另1例在第 102 天复发。3例患者均出现 1 级CRS,并且均出现 3-4 级病因不明的皮疹。
TRBC1/2
在αβTCR+ T 细胞中,T细胞受体β常数(TRBC)基因编码TCR中的β链。人类成熟 T 细胞是 TRBC1+或 TRBC2+ TCR 的混合体,而克隆性 T 细胞淋巴瘤则对其中一种呈阳性。>95%的PTCL 和>30%的 T-ALL 病例表达αβTCR,表明其可能是 CAR-T 细胞疗法的靶点,且自相残杀或 T 细胞发育不全的风险较低。抗 TRBC1 CAR-T 细胞在 T-ALL 的临床前模型中效果显著,同时保留健康的 TRBC2+细胞群。此外还利用计算生物学开发了一种互补的 TRBC2 特异性抗体。
关于抗 TRBC1 CAR-T 细胞治疗PTCL的 AUTO4(NCT03590574)临床试验已有报道。输注患者中有5/10 例50%)达到CMR,另外还有 2例PR;33%(n=3)的患者无反应。仅有 33%(n=3)的患者出现CRS(≤3 级),无ICANS或DLT。在接受最高剂量(450×106 CAR-T 细胞)的4例患者中有3例获得CMR。1 周后外周血中未检测到 CAR-T 细胞,但在淋巴结中可检测到。通过恢复正常的 TRBC1+T 细胞来“反向杀伤”CAR-T 细胞可能是 CAR-T 细胞持久性短的原因。
CD4
CD4 是一种跨膜糖蛋白,存在于一部分 T 细胞上,是 T 细胞受体(TCR)的核心受体。约 50%的成人PTCL和部分T-ALL表达CD4。
在一项关于 CD4 CAR-T 细胞治疗 T 细胞淋巴瘤和白血病的进行中的试验(NCT03829540)中,已有3例患者的结果。制备是可行的,并且没有发生DLT。两例患者(1例PTCL,1例AML)实现CR,1例(蕈样肉芽肿)实现血液学CR。
3例TCL患者接受 CD4-IL15/IL15sushi CAR-T 细胞治疗(NCT03829540),其中1例患者(Sezary综合征)实现CMR,且持续到 15 个月,第2例患者(蕈样肉芽肿)实现PR,第3例患者(AITL)实现CR。观察到了 CD4 T 细胞发育不良,但 CD3+ CD8+ T 细胞和 NK 细胞扩增,无显著的感染性毒性,也无>3级CRS或ICANS。
CD30
CD30 在霍奇金淋巴瘤以及某些 TCL(尤其是ALCL)中表达,靶向CD30 的抗体药物偶联物维布妥昔单抗治疗 ALCL 有效。CD30 在正常组织中的表达仅限于活化的 T 细胞。
早期临床试验中很少有专门靶向 CD30 的试验,但也有几项试验纳入部分 PTCL 患者(NCT04083495、NCT04526834、NCT02917083)。在一项试验的2例 ALCL 患者中,有 1 例CR且在 CAR-T 细胞输注后持续 9 个月。另一项试验中 CD30 CAR-T 细胞作为自体移植的巩固治疗,包括 6 例 TCL 患者,无DLT且安全性可接受。中位随访 48.2 个月时所有 TCL 患者均已死亡,其中 5 例死于复发,1 例死于无关的肺癌。
CD70
CD70 是一种 2 型跨膜糖蛋白,除活化的 T 细胞外,在正常组织中表达有限。除 ALK 阳性的 ALCL 外,大多数 TCL 中均有 CD70 表达的报道。
在一项纳入 18 例r/r TCL(COBALT-LYM - NCT04502446)患者的异基因 CD70 CAR-T 的I期研究中,采用多重 CRISPR/Cas9 技术删除 TRAC、B2M 和 CD70 基因,CTX130 治疗显示CR率为 22%,无DLT。发生1 例≥3 级感染,1 例因无关的肺炎死亡。中位缓解持续时间仅为 1.8 个月,且 CAR-T 持久性较短。
CD37
CD37 是一种四次跨膜蛋白,在CTCL和PTCL中表达。正常表达仅限于淋巴细胞。
一项关于 CD37 CAR-T 细胞治疗 B 细胞和 T 细胞肿瘤的 1 期试验(NCT04136275)报告了最初的 5例患者,其中只有 1例患者为鼻腔 NK/T 细胞淋巴瘤。该患者在治疗后反应混合,随后 CD37 迅速缺失;在 CAR-T输注后第 32 天因疾病进展而死亡。
关于CAR-T治疗T细胞恶性肿瘤,我们学到什么?
关于 CAR-T 治疗 T 细胞恶性肿瘤的临床数据表明是可行的,并且可能有效。然而这些早期试验也引发了许多问题,其答案将指导未来合理的 CAR-T 和临床试验设计。
自体制备需要担心产品污染吗?
尽管在部分初始单采产品中检测到淋巴母细胞,但迄今为止在最终制备的产品中均未检测到。此外,在 CD7 和 CD5 CAR-T 治疗后的复发中也未报告过 CAR 转基因,表明在临床上具有重要意义的意外原始细胞转导并未发生。
减轻产品污染的方法多种多样。部分试验仅纳入MRD阴性/低疾病水平的患者,而其他试验则选择检测单采产物和CAR-T 产品放行前进行最终产品的检测。在最近的一个病例系列中,即使存在高水平的循环疾病,也仍成功制备 CAR-T 产品,且在生产后未检测到恶性细胞,这表明恶性细胞存在“自我清除”。
因此,虽然没有证据表明循环疾病水平高的患者进行制备会增加污染风险,但在可能的情况下,在单采前使用桥接疗法减少肿瘤负荷似乎是谨慎做法,特别是考虑到在低负荷疾病的情况下CAR-T 治疗后的结局有所改善。还需要进一步研究来确定未来临床试验的最佳且安全的纳入/排除标准,且这些标准可能因靶点和疾病而异。
首选自体还是异基因CAR-T?
异基因 CAR-T 在治疗 T 细胞恶性肿瘤时具有理论上的优势,包括消除产品污染的担忧以及T 细胞健康度(fitness);“现货型”产品还可以提供快速治疗。异基因 CAR-T 也存在重要的潜在局限性,例如供者细胞可能导致GvHD:在一项使用先前或新的 HLA 配型的异基因供者抗 CD7 研究中,60%的患者出现 GvHD。为了降低 GvHD 风险并允许使用现货型 CAR-T,研究人员使用 CRISPR-Cas9 或碱基编辑技术删除与 GvHD(TCR)以及自相残杀(CD7、CD70)±免疫排斥(CD52/B2M)相关的基因。虽然研究显示消除 GvHD 风险,但基因工程也带来其他挑战,包括制备的后勤困难,可能对 T 细胞产品质量产生影响,易位风险,基因编辑细胞的长期安全性未知,以及快速免疫排斥的风险。
在 T 细胞恶性肿瘤中研究的大多数异基因 CAR-T 细胞都是从HLA相合/单倍体相合供者细胞制造的,并非真正的“现货型”细胞。在T-ALL中,HLA 相合CD7 和 CD5 CAR-T 细胞显示出与自体 CAR-T 相当的初始应答率。令人鼓舞的是,在不进行allo-HSCT的情况下也可看到扩增和长期持续。
现货型CAR-T 疗法的数据有限。关于 CRISPR-Cas9 编辑的 TRAC/CD7 缺失的抗 CD7 CAR-T 的最大规模研究纳入 12 例T-ALL患者。虽然 11/12 达到CR,但 12 个月时仅有 2/12 的患者保持CR且存活。此外持久性很短,超过 1 个月就无法检测到细胞。值得注意的是,这些患者并未接受强制allo-HSCT巩固治疗。GOSH小组正在研究基于编辑的抗 CD7 CAR-T 作为强制allo-HSCT的桥接,可解决 CAR-T 持久性短的问题,并且在一份病例报告中显示有效。
因此,虽然HLA相合抗 CD7 供者细胞似乎与自体 CAR-T 细胞疗法具有相似的疗效,但它们需要相合供者可用性以及定制生产,并且存在显著的GvHD风险。现货型 CAR-T 细胞疗法仍处于起步阶段,其能否与自体 CAR-T 细胞疗法一样有效、能否作为独立疗法发挥作用以及长期安全性仍有待证实。
CAR-T治疗T细胞恶性肿瘤的毒性是否过大?
在临床试验中,针对CD7、CD5、TRBC1等抗原的 CAR-T 细胞特异性毒性(CRS和ICANS)的发生率总体上较低,且严重程度为轻度至中度;而在同时靶向 CD7 和 CD5 的 CAR-T 试验中则报告显著且往往持久的血液毒性。目前仍不清楚这种血液毒性是否归因于 CAR-T 本身,因为患者往往重度性质,并接受过桥接化疗及清淋化疗。总体而言,这些与 CAR-T相关的毒性发生率似乎与 B 细胞恶性肿瘤中 CD19 CAR-T 的发生率大致相当。
在目前所有 CD7 CAR 试验中,CD7+ T 细胞和 NK 细胞均迅速且完全地清除;而与此同时,通常数量较少的天然 CD7 阴性 T 细胞和 NK 细胞亚群有所扩增,不过总的 T 细胞和 NK 细胞数量仍低于正常水平。CD7 阴性细胞尽管表现出有限的 TCR 多样性,但仍能对病毒和真菌病原体作出反应。在所有 CD7 试验中都报告了 ≥3 级细菌、病毒和真菌感染事件。然而,尽管在 CD7 CAR-T 治疗后接受移植的患者数量众多,但抗 CD7 CAR-T 的免疫抑制性似乎低于最初预期。
在 CD5 CAR-T 试验中,对正常 T 细胞的影响不太明确。在有报道的最大规模T-ALL研究中,正常CD5+T 细胞有所损失,但天然存在的或基因编辑的 CD5 阴性 T 细胞有所恢复,可能具有部分保护作用。然而也观察到病毒重新激活,在 23例患者中有多例感染性死亡,包括 4 例因 EBV+ PTLD导致的死亡。
目前仍不清楚 CD7+/CD5+ T 细胞和 NK 细胞的缺失对免疫谱系和感染毒性的长期影响,而这个问题对于了解这些疗法是否可以在不allo-HSCT的情况下作为治愈性治疗手段至关重要。
抗CD7或抗CD5 CAR-T细胞疗法能够成为独立的疗法吗?
在临床评估之前人们普遍认为,靶向泛 T 细胞抗原的 CAR-T 疗法需要强制进行allo-HSCT来挽救预期的深度免疫抑制。此外在r/r T-ALL中HSCT是一种有效的治疗方式,而在B-ALL中,抗 CD19 CAR-T 的短期持久性几乎不可避免地导致复发。然而这些患者中功能性 T/NK 细胞的意外恢复对这一假设范例构成挑战。鉴于allo-HSCT相关毒性,如果 CAR-T 疗法无需allo-HSCT即可治愈,则肯定是有益的。
自体抗 CD7 CAR-T 的完全缓解率一直>90-95%,然而在未allo-HSCT的患者中缓解往往短暂。在一项CD7 CAR-T 的 II 期研究中,接受巩固性移植的患者PFS明显长于未移植的患者;此外80%的复发患者呈 CD7 阴性疾病。此外在最近的一个病例系列中,9/9 接受巩固性allo-HSCT的患者在中位随访 15 个月时存活且无白血病,而未移植的患者中仅有3/8。在一项异基因 CD5 CAR-T 的试验中也观察到类似模式,末次随访时12 例未移植的患者中有 2例仍处于缓解状态,而移植患者中高达3/4。
值得注意的是,这些研究均为将患者随机分配到异基因移植组或非异基因移植组,而且这些组之间可能存在显著差异(例如移植的适合度)。然而基于观察到的抗原阴性复发的高发生率,似乎初始对 CD7 或 CD5 CAR-T 的反应可能需要allo-HSCT巩固以实现长期缓解,此外也可恢复或正常化 T 细胞群。然而对于许多患者来说,HSCT并非可行,尤其是在T-ALL中,由于高危特征患者往往已经在早期接受移植,因此还需要进一步探索可能实现CAR-T 疗法独立的方法。
还有哪些其他靶点正在研究?
尽管泛 T 抗原在肿瘤中高表达且近乎普遍存在,但其在正常 T 细胞中的高表达也带来相当大的挑战,而理想的靶点应该是表达仅限于肿瘤性 T 细胞的抗原。针对此类抗原可以避免自相残杀、T 细胞发育不良和产品污染,使得自体 CAR-T 的制备简单化,并有可能避免allo-HSCT巩固。
应利用多组学技术对T-ALL和TCL进行研究,以确定更多新型肿瘤选择性靶点。相关抗原如下。
CCR9
CCR9(C-C 趋化因子受体 9 型)在胸腺 T 细胞的发育和肠道归巢中发挥作用,其表达于胸腺细胞和小肠淋巴细胞。CCR9 在>70%的T-ALL(r/r中>85%)中表达,但仅在<5%的成熟 T 细胞中表达,且在非淋巴组织中不表达。抗 CCR9 CAR-T 细胞增殖时无自相残杀现象,在 T-ALL的临床前模型中效果显著。一项纳入T-ALL的抗 CCR9 CAR-T 细胞的 1 期临床试验不久将在英国展开。
CD1a
CD1a 是一种跨膜糖蛋白,可向 T 细胞呈递脂质来源的抗原,其表达仅限于皮质胸腺细胞和Langerhans细胞。在原发性皮质T-ALL小鼠模型中,抗 CD1a CAR-T 细胞扩增无自相残杀现象,并可根除疾病。然而CD1a 仅在皮质T-ALL中表达,其预后良好。对 103 例r/r T-ALL病例的分析发现,仅有 8/103 例呈高/均匀CD1a 表达。一项纳入T-ALL 给予抗 CD1a CAR-T 细胞的 I 期试验正在进行中(NCT05679895)。
CD38
CD38 是一种 II 型跨膜糖蛋白,可介导免疫细胞中的信号转导。T-ALL中75%呈高表达。CD38 也存在于活化的 T 细胞、B 细胞、树突状细胞和 NK 细胞上。达雷妥尤单抗是一种抗 CD38 单抗,在 T-ALL 的 PDX 模型中显示出疗效,DELPHINUS 研究(NTC03384654)显示,在儿童和成人患者中ORR分别为 83.3%和 60%,表明 CD38 靶向治疗具有潜力。
CD38 CAR-T 细胞在临床前模型中对 NK/T 细胞淋巴瘤显示出活性,对 5 种儿童T-ALL PDX模型显示出不同程度的活性,其中 4/5 模型中患者存活期延长。激活 T 细胞上 CD38 的表达并未损害其扩增或功能。然而在正常人造血异种移植模型中,它们确实耗尽造血祖细胞,这也是临床转化中的潜在担忧。目前还没有关于抗 CD38 CAR-T 的试验数据。
CD21
CD21 在 B 细胞、滤泡树突状细胞和一部分成熟的 T 细胞上表达。CD21 在 50%的T-ALL样本中表达,但在成熟的 T 细胞中仅表达 10%。抗 CD21 CAR-T 细胞对 T-ALL 的临床前模型有强大的作用,且增殖时没有自相残杀现象。
CCR4
CCR4 是一种 C-X-C 趋化因子 G 蛋白偶联受体,在Treg、TH2、TH17 和血小板细胞上表达,并在信号传导中发挥作用。CCR4 在大多数成人ATLL和CTCL中高表达,在 30%-40% 的PTCL中也有表达。CCR4-CAR-T 细胞对患者源性细胞系和小鼠 T 细胞淋巴瘤模型有强大的抗肿瘤作用,选择性杀伤作用可保留TH1 和 CD8+T 细胞亚群。
总的来说,这些肿瘤性 T 细胞受阻抗原很有前景,但临床开发落后于泛 T 抗原。正在进行的临床试验有望带来初步疗效的信号。
如何预防抗原阴性复发?
CD7 CAR-T 治疗中抗原阴性复发的发生率似乎很高,具有相当大的治疗挑战。目前正在研究多抗原靶向的 CAR-T 疗法,以预防 B 细胞恶性肿瘤中的抗原阴性复发,主要靶向 CD19 和 CD22。
在T-ALL中,经 CRISPR 编辑的 CD5/CD7 双CAR在体内显示出强大的抗白血病活性。CD5 或 CD7 的缺失对抗白血病活性无影响。
碱基编辑的 CD3/CD7 CAR-T 细胞对具有不同 CD3 和 CD7 表达的细胞系和儿童T-ALL样本表现出强大且特异性的细胞毒性。在体内模型中,双靶 CD3/CD7 CAR-T 细胞显示出最高的肿瘤清除率。
靶向正常 T 细胞上高表达的两种抗原,很可能需要更复杂的 CAR 工程设计以避免自相残杀,且由于不止一个 T 细胞亚群的消融,可能会导致高感染性毒性。此类疗法可能需要强制进行allo-HSCT巩固。
一种靶向两种 T 细胞受限抗原 CCR9 和 CD1a 的CAR已有报道。在研究的T-ALL病例中,86%(155/186)表达其中一种或两种靶点。这种双靶CAR在 T-ALL 的临床前模型中比各自的单抗原靶向CAR更有效。
在T-ALL中,多抗原 CAR-T 疗法尚未进入临床试验阶段,但从 B-ALL的经验来看,未来很可能会出现此类临床数据;其能否克服抗原阴性逃逸并提高长期生存还有待观察。
总结
尽管针对 T 细胞肿瘤的 CAR-T 疗法的发展比B 细胞肿瘤晚了约十年,但靶向泛 T 细胞和肿瘤选择性抗原的无数临床前和临床研究仍充满希望。
在T-ALL中,靶向 CD7 和 CD5 的CAR-T细胞已显示出令人瞩目的缓解率,且部分患者可持久缓解,尤其是在allo-HSCT巩固治疗时,表明 CAR-T 对 T-ALL 可能非常有效。其制备是可行的,采用多种策略来克服自相残杀,且无淋巴母细胞污染的报告。在成熟TCL中缓解率总体上不佳,抗原异质性使得确定理想CAR-T 靶点更加困难,然而使用抗 CD5 和抗 TRBC1 CAR-T 可获得部分持久缓解。
目前仍然存在重大障碍——如何在不进行移植的情况下提高长期生存,如何降低抗原阴性复发率,如何最小化感染毒性,以及开发有效的异基因产品的最佳方法。尽管仍存在这些挑战,但细胞疗法似乎有可能在不久的将来为更多 T 细胞恶性肿瘤患者提供治愈方案。
参考文献
Nicola C Maciocia, Brandon Garnett Wade, Paul Michael Maciocia; CAR-T cell therapies for T cell malignancies: does cellular immunotherapy represent the best chance of cure?. Blood Adv 2024; bloodadvances.2023012263. doi: https://doi.org/10.1182/bloodadvances.2023012263


