南医大易笑教授Biomaterials :“自愈性防粘连屏障材料”剖宫产术后组织损伤修复福音
时间:2025-01-15 12:14:58 热度:37.1℃ 作者:网络
剖宫产是目前全球最常见的手术之一。据统计,全球约21%的产妇通过剖宫产分娩。手术时,医生通常会在孕妇腹部下段横向切开一个约15厘米的切口,依次切开皮肤、皮下脂肪、腹直肌前鞘、肌肉层、腹膜、子宫浆膜层、子宫肌肉层、子宫黏膜层,然后通过这个切口将胎儿娩出。剖宫产通常为二级手术,但根据孕妇是否为二次剖宫产或合并粘连等情况,手术风险也会相应改变,甚至划分为四级手术。虽然剖宫产能够解决许多难产的情况,挽救母婴生命,但手术会破坏子宫的完整性,增加出血、切口愈合不良和术后粘连等并发症的风险。这些并发症可能导致慢性盆腔疼痛、继发性不孕,在二胎妊娠时还可能诱发前置胎盘、胎盘植入甚至子宫破裂等危及生命的情况。因此,如何预防和减少剖宫产术后并发症,一直是医学界关注的重要难题。

2025年1月8日,南方医科大学珠江医院易笑教授、王沂峰教授团队联合中山大学附属第三医院帅心涛教授团队在《Biomaterials》杂志在线发表了题为 “Biomimetic Nanostructural materials based on placental amniotic membrane-derived nanofibers for self-healing and anti-adhesion during cesarean p” 的工作。该研究设计了一种来源于人胎盘羊膜的生物仿生纳米材料(Amniotic membrane-derived biomimetic nanostructural materials, AM-BNMs),实现了剖宫产术后防粘连和促进组织再生的双重功能。
【文章要点】
人羊膜(Amniotic membrane, AM)是一种来源丰富且没有伦理限制的医疗废弃物,其细胞外基质(Extracellular matrix, ECM)衍生材料表现出良好的人体组织相容性,能够抗菌、抗炎,支持细胞生长,是制作伤口敷料的前景材料。以间充质干细胞(Mesenchymal stem cells, MSCs)衍生物细胞外囊泡(Extracellular vesicles, EVs)为代表的无细胞疗法,近年来也展现出对各种疾病的治疗潜力,能够促进细胞增殖与迁移加快伤口愈合。然而,如何高效获取、分离MSCs衍生物并减少EVs失活,实现精准递送仍是限制该疗法发展的重要问题。
这项研究创新性的基于AM-ECM制备了纳米级纤维,调控粘弹性网络结构作为载体,结合富含EVs的AM-MSCs分泌组,用于制备AM-BNMs(图1)。为实现生物界面微结构仿生,促进材料与子宫之间的融合,团队系统分析和筛选了材料的力学特性、微观结构和表面形态。借助扫描电镜观察,发现构建的AM-BNMs能够与大鼠子宫表面的拓扑结构匹配,紧密贴附于组织表面,形成稳固的物理屏障,实现了组织界面的高度仿生。与此同时,流变学测试证实该材料具有的剪切稀化特性,在保持良好形态稳定性的同时,也便于通过注射方式给药。基于这些优异性能,研究团队进一步构建了多种剂型的AM-BNMs,以适应复杂多变的解剖结构表面。
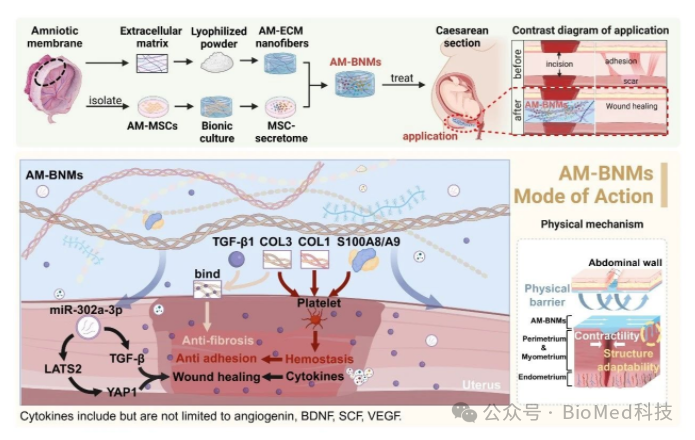
图1 AM-BNMs 双组分协同作用预防粘连并促进子宫与腹壁组织再生
针对AM-BNMs的组成成分,研究人员进行了深入的分析。结果显示,纳米纤维中富含胶原蛋白、S100A8、S100A9等止血蛋白,能够高效触发机体的凝血级联反应,并通过PI3K-Akt信号通路的活化,促使血小板迅速聚集在创面部位。借助大鼠肝出血模型,研究人员充分验证了AM-BNMs卓越的止血性能。在分泌组中则鉴定出多种组织再生相关的关键因子,包括miR-302a-3p、血管生成素和VEGF等。进一步的生物信息学分析提示,分泌组中部分miRNA通过调控其靶基因,参与了雌二醇信号通路的调节,这可能是其增强子宫组织修复特异性的重要机制。综合来看,纳米纤维与分泌组形成了协同效应,共同促成了显著的组织修复效果。(图2)。
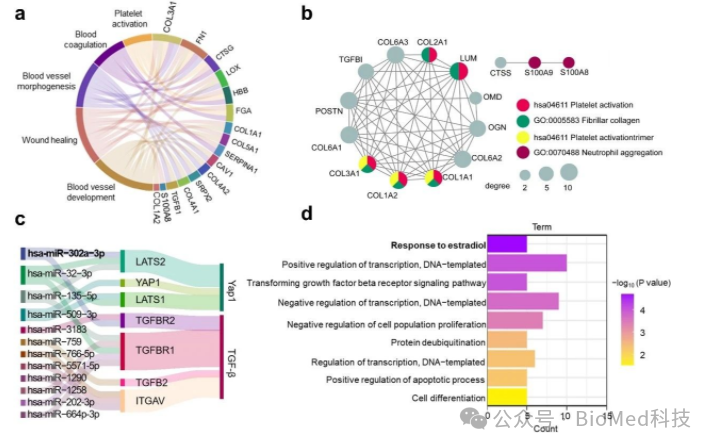
图2 AM-BNMs组成分分析与验证
为系统评估该材料的临床应用潜力,研究团队进一步在大鼠剖宫产模型中开展了深入验证。结果表明,AM-BNMs具有多项突出优势:首先,优异的可塑性使其能够随形就势,完美贴合解剖结构复杂的创面,而无需额外缝合固定,极大地简化了手术操作流程;其次,材料能够在创面上快速形成稳定的物理屏障,有效控制术后出血和预防粘连;再者,可控降解的特性确保了局部微环境中活性因子浓度的稳定,发挥长效治疗作用。组织学分析提示,使用AM-BNMs修复的切口愈合良好,增殖细胞比例显著升高,平滑肌组织结构连续性佳,且瘢痕粘连的发生率明显降低。(图3)。
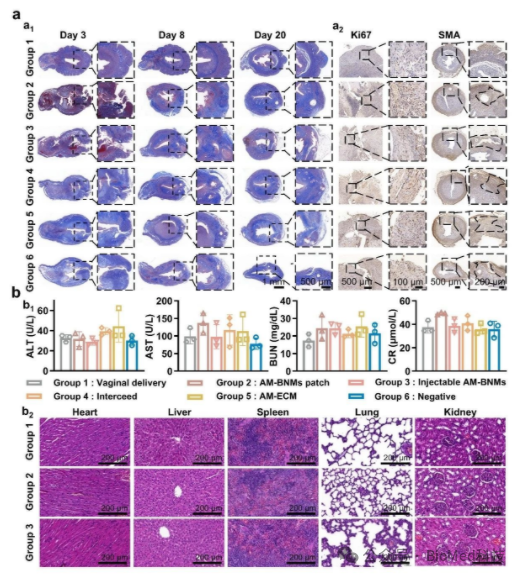
图3 AM-BNMs 促进伤口愈合和再生
“这就像是在子宫创面上覆盖了一块'仿生创可贴'。”该项目负责人易笑教授形象地解释道,“它不仅能够智能适应组织结构,与创面精准贴合,还能持续释放多种促进组织再生的生物活性因子,从而增速自体修复过程。更为重要的是,材料来源于人体自身组织,生物相容性好,安全性高,无论制备成贴片亦或注射剂,均便于临床使用与推广”。
【结论与展望】
综上所述,研究团队成功研发出一种新型仿生复合材料AM-BNMs,具有良好的抗粘连特性和促进组织自我修复的能力。该材料从设计构想到制备工艺,再到动物模型实验,均经过了系统、全面的验证和优化。选择人羊膜作为原料,不仅因其来源丰富、获取便捷,更重要的是,作为医疗废弃物,羊膜基质在生物学特性上与新生儿组织高度同源。这不仅意味着极低的免疫排斥风险,更保证了其良好的重构能力。构建后的AM-BNMs兼具细胞外基质的多维结构支持与干细胞源性生物活性因子,协同发挥"仿生支架"与"再生促进"的双重作用,为预防和治疗剖宫产术后创面愈合不良、瘢痕粘连等并发症提供了全新的解决方案,未来将有望应用于临床,让更多产妇能够安心选择剖腹产,为母婴健康保驾护航。
南方医科大学珠江医院易笑教授、王沂峰教授和中山大学附属第三医院帅心涛教授为该论文的共同通讯作者,南方医科大学珠江医院为第一单位。本研究获得了国家重点研发计划、国家自然科学基金、广东省自然科学基金杰出青年项目、广州市科学技术局重点研发计划等基金的资助。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0142961224006173


