Nature子刊:余健秀、杜春玲和赵晓菁团队揭示组蛋白水平下降引发基因组不稳定性及肺腺癌发生的机制
时间:2024-12-16 17:00:23 热度:37.1℃ 作者:网络
FBXO45是一个基因组守护者
肺癌是全球癌症相关死亡的主要原因,其中肺腺癌(LUAD)是最常见的组织学类型,占所有病例的40%。LUAD的特征是存在大量的基因突变,包括已知驱动基因如EGFR和KRAS以及许多未明确基因的突变。然而,LUAD高频基因突变的分子机制仍不清楚。染色质不稳定性(CIN)是肿瘤发生的主要内在驱动力。在细胞周期的各个阶段及DNA模板化过程中,染色质结构的完整性对于维持基因组稳定性至关重要。目前染色质功能稳定性相关的研究主要集中在组蛋白的翻译后修饰(PTMs)、组蛋白变体、核小体内部和之间的相互作用以及ATP依赖的染色质重塑等方面,而组蛋白供应不足的影响很少受到关注。有证据表明,组蛋白供应不足可能会显著导致染色质的不稳定性,这就引出了一个关键的科学问题:组蛋白水平不足是否导致了高频基因突变并直接介导 LUAD发生及肿瘤异质性?
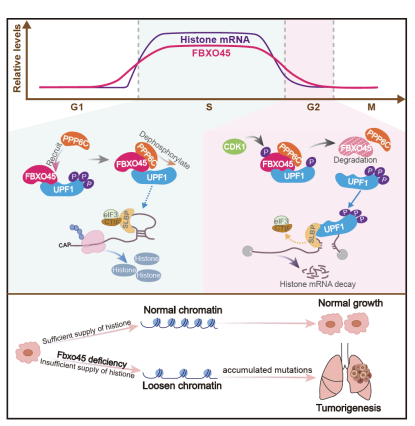
组蛋白水平不足与衰老和多种癌症密切相关。有研究表明,组蛋白水平在老年人中和肿瘤病人中均下降,暗示着为什么癌症多发生于老年的机制。长期的组蛋白缺乏会损害DNA复制叉的进程及新合成DNA上的核小体占据,导致染色质松弛、染色体不稳定性及DNA损伤,最终引发基因组不稳定性和肿瘤发生。复制依赖型(RD)组蛋白mRNA有保守的茎环结构特征,只在S期大量表达,并在S期结束或DNA合成抑制时通过保守的途径快速降解,以防止细胞毒性。UPF1是这一组蛋白mRNA降解(HMD)途径的关键调控因子,其磷酸化对于启动包括HMD和无义介导的mRNA降解(NMD)在内的多个RNA降解过程至关重要。然而,在生理条件下,UPF1的磷酸化如何被调控以激活HMD的机制仍不明确。
2024年12月13日,上海交通大学医学院余健秀教授领导的研究团队在 Cell Death and Differentiation 在线发表题为 “Loss of Fbxo45 in AT2 cells leads to insufficient histone supply and initiates lung adenocarcinoma” 的文章。该研究以肺泡上皮2型细胞(AT2)Fbxo45条件性敲除小鼠为研究模型,揭示组蛋白水平下降引发基因组不稳定性及肺腺癌发生的机制。

该团队先前的研究表明,FBXO45一种非经典的泛素化酶,主要介导EMT转化相关的转录因子如ZEB1/2、Snail、Twist1的降解。此项研究中,该团队发现在小鼠AT2细胞中Fbxo45的敲除会导致自发性LUAD。随后,他们首先证实了FBXO45是一种新型的细胞周期调节蛋白,在S/G2期被CDK1磷酸化后会迅速降解。在S期或DNA损伤修复期间,FBXO45不发挥其泛素化酶的功能,而是与UPF1结合并募集磷酸酶PPP6C,进而抑制UPF1的磷酸化。该过程对于防止复制依赖性(RD)组蛋白mRNA的降解和确保足够的组蛋白供应至关重要。在FBXO45缺失或表达下调的情况下,PPP6C和UPF1之间的相互作用受损会导致整个细胞周期中UPF1持续过度磷酸化,导致组蛋白供应不足、染色质松弛、基因组不稳定和基因突变率增加,最终导致LUAD自发发生及肿瘤异质性。值得注意的是,临床LUAD标本的分析证实了FBXO45的缺失与基因组不稳定性之间存在正相关性,这与在小鼠模型中的发现一致。该研究首次揭示FBXO45是一个基因组稳定的新“守护神”(p53被认为是第一个基因组守护者),阐明了FBXO45在协调组蛋白供应与DNA复制过程中的核心作用,为理解肺腺癌中基因组不稳定性和大量驱动基因突变的分子机制提供了新视角。研究团队表示,这一发现不仅深化了对肺腺癌发生机制的认知,还为未来靶向治疗提供了新的潜在策略。
上海交通大学医学院生物化学与分子细胞生物学系余健秀教授、复旦大学附属中山医院青浦分院杜春玲教授和上海交通大学医学院仁济医院赵晓菁教授为该论文的共同通讯作者。程金科教授在此项研究中提供了帮助和讨论。博士后李莲、博士生李俊雅、技术员陈冉、黄彩湖博士和左勇教授为论文共同第一作者,参与课题研究的还包括上海交通大学医学院程金科教授等。该研究得到了国家自然科学基金委重点项目和面上项目、上海自然科学基金项目等资助。
参考消息:
https://www.nature.com/articles/s41418-024-01433-z


