Nature子刊:清华大学傅阳心等合作研究开发了新型瘤内Treg和CD8 T细胞双功能融合蛋白抗肿瘤药物!
时间:2024-12-05 14:01:28 热度:37.1℃ 作者:网络
大多数关于4-1BB的研究最初都集中在它对CD8+ T细胞的激动特性上。然而,强效抗4-1BB激动剂引起的相当大的肝毒性是其临床应用的一个重要障碍。弱激动剂抗体降低毒性,但显示有限的T细胞活化。
2024年12月2日,清华大学傅阳心、中国科学院生物物理研究所彭华共同通讯在Nature Biomedical Engineering在线发表题为“Concurrent intratumoural Treg cell depletion and CD8+ T cell expansion via a cleavable anti-4-1BB–interleukin-15 fusion protein”的研究论文,该研究通过构建anti-4-1BB抗体和IL-15-IL-15Rα(Super IL-15)的融合蛋白,实现对肿瘤浸润的Treg细胞特异性地清除以及CD8+T细胞的激活,在有效增强抗肿瘤免疫反应的同时避免IL-15-IL15Rα引起的副作用。
在此,基于对肿瘤微环境中4-1BB消耗调节性T(Treg)细胞的弱激动剂的观察,而不会导致功能失调的细胞毒性T细胞(CTL)的实质性恢复,研究们表明,通过一种对肿瘤酶敏感的肽融合白细胞间素-15(IL-15)的抗4-1BB抗体,可以通过Treg细胞消耗和CTL扩增同时实现有效的肿瘤控制。在晚期癌症小鼠模型中,腹腔注射双功能蛋白减弱了主要在原发肿瘤周围的白细胞介素的活性,同时允许肿瘤微环境内CTL的扩张,与使用非联抗4-1BB抗体和IL-15联合治疗癌症相比,导致更有效的肿瘤抑制和更低的全身毒性,并降低了肿瘤对检查点封锁的抵抗力。同时根除Treg细胞和激活肿瘤浸润淋巴细胞可能是有效控制晚期转移性肿瘤的一般策略。

尽管各种激动剂或双特异性抗体(将肿瘤靶向部分与抗4-1BB激动剂结合)显示出潜在的抗肿瘤免疫,但巨大的毒性和有限的疗效仍然是其临床进展的巨大障碍。最近的研究表明,在不同癌症类型的肿瘤内调节性T(Treg)细胞中普遍存在高水平的4-1BB表达,抗4-1BB抗体能够有效地消耗表达4-1BB的Treg细胞。一种具有小鼠IgG2a同型的适度抗-4-1BB激动剂抗体显示出有效的Treg细胞消耗和类似的治疗效果,其毒性低于其强效激动剂mIgG1版本。这些温和的抗4-1BB药物正获得越来越多的关注。
有限的T细胞驱动的细胞因子是否可以阻碍抗4-1BB程序性肿瘤浸润淋巴细胞(TILs)。最近观察到IL-2和IL-15的阻断受体β限制了免疫检查点阻断(ICB)的效力。这增加了有限的细胞因子可能无法挽救TILs的可能性,特别是在治疗后的晚期癌症中。由于IL-2在Treg细胞上的高亲和力受体的高水平表达,IL-2比CTL更倾向于Treg细胞,而IL-15在临床前研究中因其刺激自然杀伤细胞(NK)、NK T细胞和记忆性CD8+ T细胞的分化和增殖的潜力而被广泛研究。它还在癌症患者的1期和2期临床试验中进行了测试。
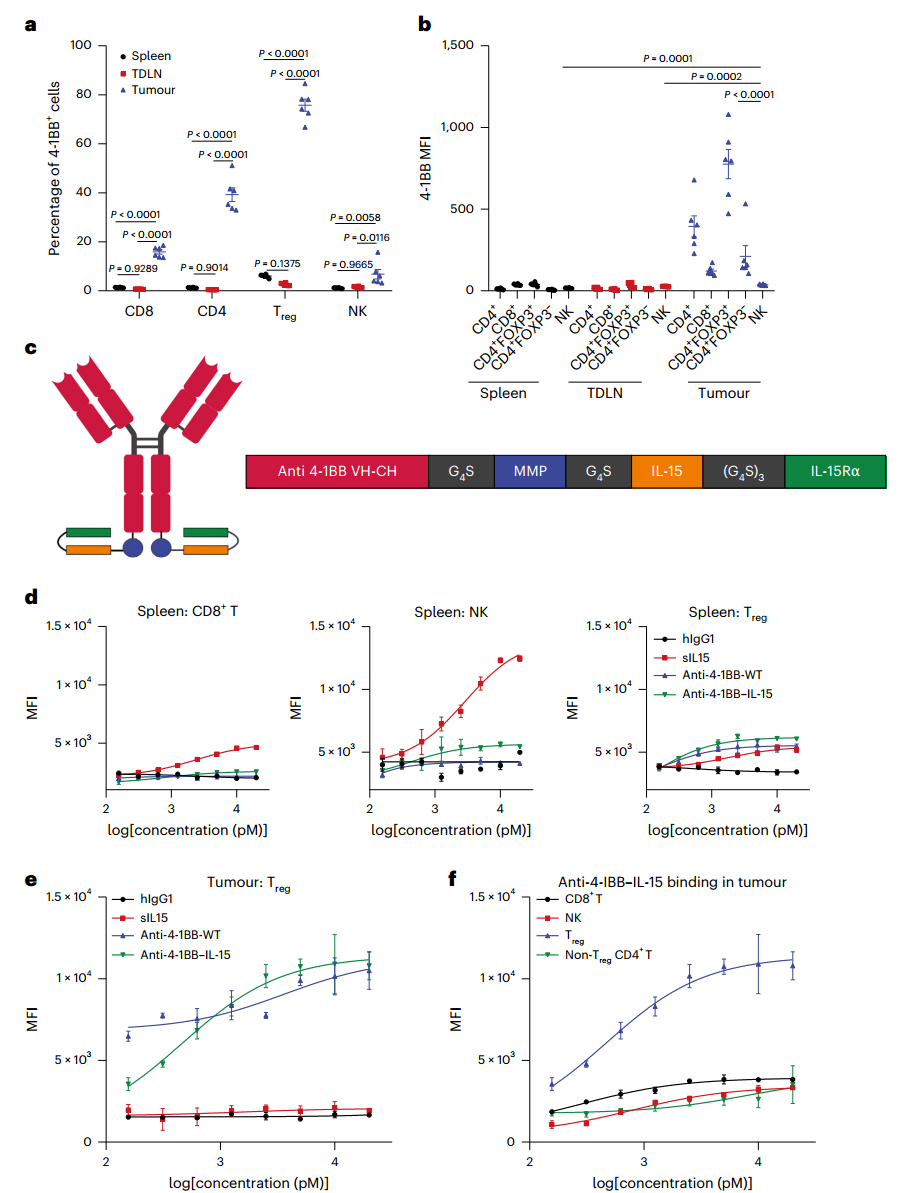
抗-4-1BB-IL-15优先靶向肿瘤内Treg细胞,与外周免疫细胞的结合有限
(图源自Nature Biomedical Engineering)
尽管IL-15和IL-2具有相同的受体β和γ在NK细胞和CD8+ T细胞上表达,IL-15受体α (IL-15Rα)是IL-15在单核细胞和树突状细胞上表达的独特受体,使IL-15 - IL-15Rα(也称为超级IL-15, sIL-15)与CD8+ T细胞和NK结合具有更高的亲和力。与IL-2不同,IL-15诱导NK和CD8+ T细胞增殖更强,同时最小化Treg细胞活化。然而,sIL-15的应用仍然受到剂量依赖性毒性和有限的抗肿瘤功效的阻碍,这导致了sIL-15提高疗效或降低毒性的策略的发展。
该研究设计了一种抗4-1BB抗体屏蔽sIL-15。这种融合蛋白可能通过抗4-1BB抗体有策略地靶向Treg细胞,消耗Treg细胞,同时在外周很好地屏蔽sIL-15,通过对肿瘤相关膜蛋白酶敏感的连接物将其适当地释放到TME内的CTLs。总之,该研究结果表明,开发能够同时根除Treg细胞和激活TILs的下一代生物制剂,从而有效控制晚期和转移性肿瘤的可行性。这项研究证明了抗4- 1BB-IL-15融合蛋白如何有效地消耗肿瘤内Treg细胞并扩大肿瘤特异性CD8+ T细胞,而不会引起全身毒性。
参考消息:
https://www.nature.com/articles/s41551-024-01303-6


